感染性心内膜炎合并脑出血伴多器官梗死1例
2021-09-03徐昳陈淑芬韩翔
徐昳,陈淑芬,韩翔
1 病例介绍
患者男性,34岁,因“突发左侧肢体、口舌麻木2小时余”于2021年2月22日至本院急诊就诊。患者就诊当日晨起出现左侧肢体及口舌麻木症状,无言语不清、肢体无力、头痛、恶心、呕吐、肢体抽搐等不适。急诊头颅CT检查(09∶32)结果示右侧额叶稍高密度影,出血性病变可能(图1A~D);头颅CT复查(18∶04)结果示右侧额叶脑出血(图1E~H)。遂后患者以脑出血收入神经内科。
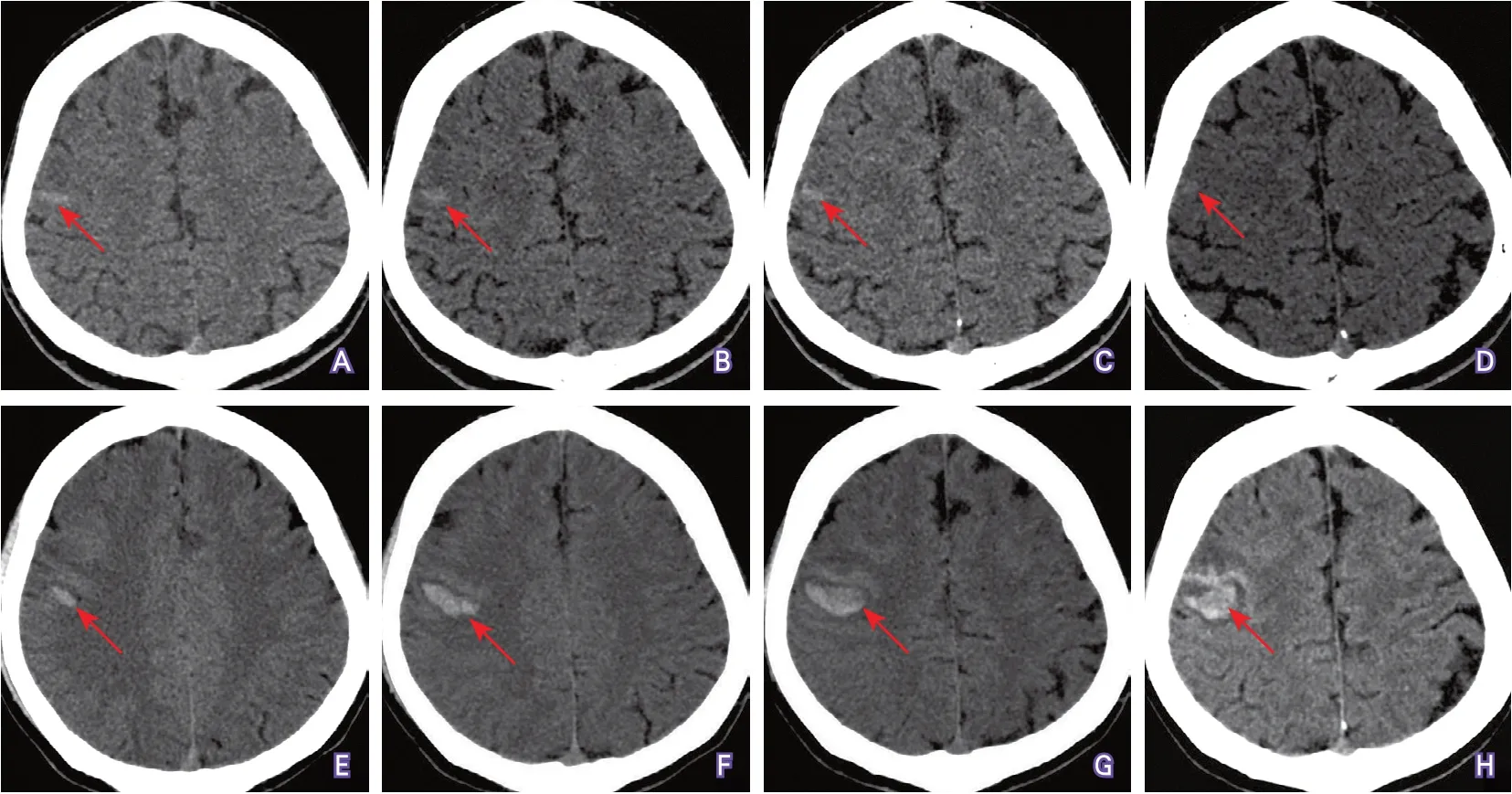
图1 头颅CT检查结果
既往史:2019年延髓海绵状血管瘤出血史;胰十二指肠+胆囊切除及胃大部切除术后并出现2次吻合口出血;否认高血压、糖尿病及过敏史。
入院查体:体温36.5 ℃,血压131/81 mm Hg(1 mm Hg=0.133 kPa),心率78次/分,NIHSS 1分,GCS 15分,心、肺、腹部查体无明显异常。双侧瞳孔直径不等(左侧2 mm,右侧4 mm),对光反射灵敏,左侧眼裂小,额部少汗,余颅神经查体无异常。神清语利,对答切题,脑膜刺激征阴性,四肢肌力5级,肌张力正常;双侧深浅感觉对称存在,双侧共济运动正常,四肢腱反射正常,病理征阴性。
实验室检查(2021-02-25):心肌酶谱、心肌标志物、肝脏及肾脏功能、电解质均正常;D-二聚体、红细胞沉降率、中性粒细胞、CRP指标均升高。腰椎穿刺(2021-03-03)脑脊液蛋白、白细胞水平升高,脑脊液压力100 mm H2O,余脑脊液指标结果均正常。血培养(2021-03-05)结果显示草绿色链球菌阳性(青霉素敏感)。重要血清学指标检查(2021-03-09至2021-03-29)结果显示:氨基末端脑钠肽前体随病程进展较正常水平升高,但经治疗后较病程初期降低;血清淀粉样蛋白A、红细胞沉降率及CRP等炎症指标入院后明显升高,治疗过程中虽然偶有波动,但经治疗后均呈下降趋势;D-二聚体、降钙素原水平与上述炎症指标波动趋势基本符合;白细胞计数在病程后期呈下降趋势,中性粒细胞比例基本在正常范围内;血红蛋白水平有所降低,经前期治疗后无明显升高(表1)。
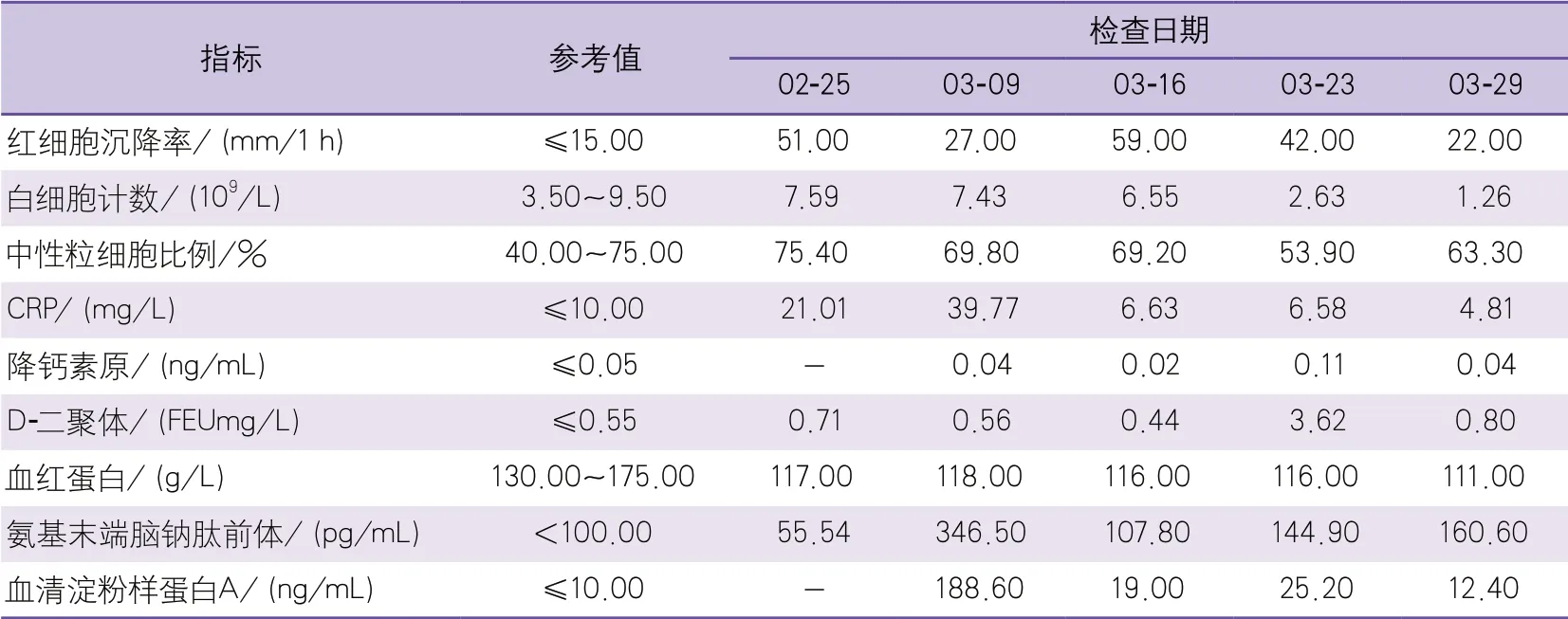
表1 重要血清学指标检查结果
影像学检查:经胸超声心动图(2021-02-26)结果示先天性二叶式主动脉瓣畸形可能,轻度主动脉瓣反流,左心室收缩及舒张功能正常。头颅MRI平扫(2021-02-26)结果显示:右侧额叶周围可见斑片状水肿区,并存在出血灶,右侧额叶可见T2WI、T2FLAIR及DWI高信号,提示亚急性梗死灶(图2A~I);头颅MRISWI(2021-02-28)结果显示:未见明显静脉畸形,存在右侧额叶出血(图2J~L)。
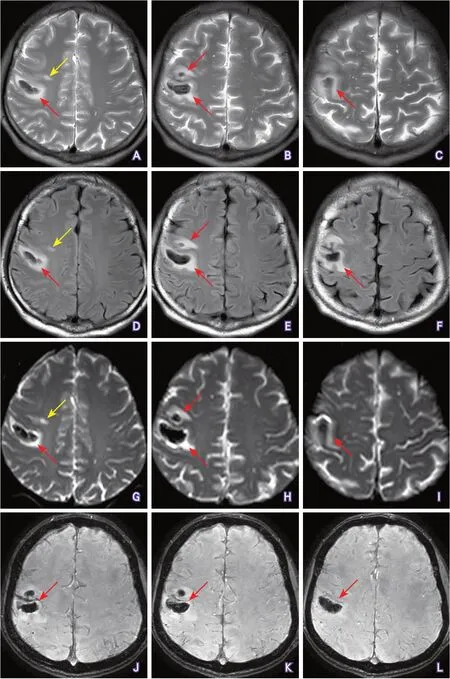
图2 头颅MRI检查结果
经食管超声心动图(2021-03-03)结果显示:主动脉瓣为先天性二叶式畸形,交界垂直走行,两个瓣叶边缘均可见不规则中等回声凸起,活动性不明显,共4枚,最大5 mm×3 mm(图3);彩色多普勒检查可见两束偏心性反流,起源于交界两端,程度为轻中度,余瓣膜未见明显异常。眼科会诊(2021-03-03)结果:双眼视网膜平伏,视盘边界清,未见明显出血、水肿、渗出及中心白点网膜出血。门静脉CTV增强扫描(2021-03-11)结果显示:胰十二指肠+胆囊切除术后改变,脾内梗死灶可能(图4A~C),左肾下极梗死灶可能(图4D~F);门静脉CTV、腹主动脉CTA、头颅CTA、头颅MRV增强扫描、颈部及下肢血管超声检查结果均未见异常。
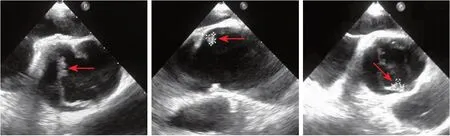
图3 经食管超声心动图检查结果
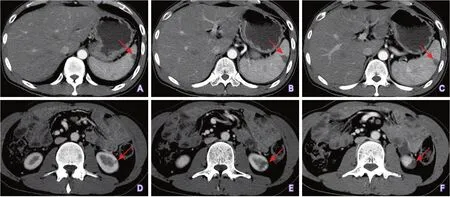
图4 门静脉CTV增强扫描结果
入院诊断:脑出血;脑梗死;胰十二指肠+胆囊切除术后状态;胃大部切除术后改变。
诊疗经过:追问病史后发现患者近期出现反复不明原因发热,体温37.5~38.3 ℃,伴全身肌肉酸痛,无畏寒、寒战、咳嗽、咳痰等不适,多次查血常规均无异常。自行口服头孢类抗生素后体温可降至正常,但数天后体温再次升高。患者自诉外院经胸心脏彩超检查结果无异常,腹部增强CT检查结果提示右肾梗死,未予特殊处理。结合患者入院后血培养结果显示草绿色链球菌阳性,以及经食管超声心动图检查结果提示心脏主动脉瓣瓣缘存在多枚赘生物,最终诊断为感染性心内膜炎(infective endocarditis,IE)。由于患者存在二叶式主动脉瓣畸形,伴多枚赘生物,且已发生脑、肾脏和脾脏梗死,随时有再次出现赘生物脱落致其他器官梗死的可能,具有心脏瓣膜置换手术指征,但患者既往胰十二指肠切除及胃大部切除术后曾出现2次吻合口出血,并且本次因脑出血入院,故心脏瓣膜置换手术后服用抗凝药物会增加出血风险。
患者入院后予脑出血常规治疗:控制血压,防治各系统并发症(呼吸道阻塞和感染、消化道出血、尿路感染等)。联合感染科、心内科及胸外科共同评估制订治疗方案,给予患者阿米卡星联合青霉素钠抗感染治疗,住院期间定期复查经食管超声心动图,密切监测心脏内赘生物情况。患者经10 d抗感染治疗后体温逐渐恢复正常,复查血培养未见细菌生长,提示抗感染治疗方案有效,故暂缓手术治疗,继续给予药物治疗。患者经抗感染治疗1个月后病情稳定,住院期间无新发IE相关并发症,故予出院密切随访,出院mRS 1分。
最终诊断:感染性心内膜炎合并脑出血及脑、脾脏、肾脏梗死。
2 讨论
心源性卒中具有高复发率、高致残率及高致死率的特点[1]。25%~70%的IE患者会发生脑血管疾病并发症[2],不同于其他心源性卒中的病因,IE既可导致脑栓塞也易引起脑出血。
近年来,链球菌相关IE发病率明显升高[3],IE患者在确诊1个月时栓塞风险最高[4]。脑和脾脏是左心IE最常见的栓塞部位,而肺栓塞在右心和起搏器相关的IE中最常见[5]。30%~40%的IE患者可出现无症状脑栓塞[6],因此头颅MRI检查对于IE相关脑血管疾病并发症的诊断至关重要。本文病例入院后头颅MRI检查结果提示右侧额叶亚急性梗死,考虑为无症状脑栓塞。IE患者也可出现脑出血事件[7-8],其中大部分患者为缺血性卒中后出血,并且IE与脑微出血间具有密切关联[9]。此外,在IE患者中也可出现颅内感染性动脉瘤,尤其是位于血管分叉处。有学者建议在有神经系统症状的IE患者中常规筛查颅内感染性动脉瘤,若检查结果为阴性,但仍高度怀疑颅内动脉瘤者,应常规行血管造影检查[5]。故此,与其他病因所致心源性卒中相比,IE更易合并脑出血。
该病例虽合并脑、脾脏和肾脏梗死,但未予抗栓治疗,而是尽早根据血培养及药敏结果选择合理的抗生素治疗[10],这是IE常规治疗原则。与其他心源性卒中不同,抗凝治疗不能降低IE患者的栓塞风险,甚至还会增加颅内出血风险[1],在采用合理的抗生素治疗后,严重栓塞事件的发生率亦显著下降[11]。因此,个体化地评估IE患者抗栓治疗指征、权衡获益风险具有重要意义。对于急性卒中合并IE患者,目前指南推荐无论是否具有其他抗凝治疗的适应证,均应停止抗凝治疗,且不建议采用阿司匹林或其他抗血小板药物作为IE的辅助治疗[5]。此外,溶栓治疗可能增加IE相关性卒中患者的颅内出血风险,且IE患者溶栓的良好预后率远低于未合并IE的缺血性卒中患者[12],故不推荐对此类患者进行溶栓治疗。
IE患者除应给予抗感染治疗外,还应由心内科及心胸外科专家联合评估早期手术治疗指征,其适应证包括心力衰竭、持续感染、脓肿、心脏传导阻滞及复发性栓塞等。缺血性卒中(非昏迷)及TIA患者,在排除脑出血后,若符合手术指征应尽早采取手术治疗[5]。然而,IE患者在出血性事件发生后4周内具有极高的手术风险,建议手术应推迟至颅内出血发生后至少1个月[7,10,13]。
IE的延迟诊断和治疗可能会进一步导致心力衰竭、多器官血栓栓塞事件及脓毒血症等可能危及生命的并发症,故IE的早期诊断和治疗至关重要。该病例因反复不明原因发热,表现为多器官梗死及脑出血,经食管超声心动图检查结果提示存在心脏内赘生物,结合血培养检查链球菌阳性的结果,最终被确诊为IE,经多学科联合治疗,患者获得良好预后。因此,对于发热合并多器官栓塞患者,应考虑IE的可能性;对于高度疑似心源性卒中患者,即使常规经胸超声心动图检查结果无异常,仍需进一步完善经食管超声心动图检查。IE合并卒中患者预后不尽相同,多学科协同诊治对减少IE相关并发症、降低死亡风险具有重要意义。
