市售水产品中副溶血性弧菌的毒力及药敏性分析
2021-09-02黄志深许喜林张明明肖剑雷燕
黄志深,许喜林,张明明,肖剑,雷燕
(1.华南理工大学食品科学与工程学院,广东广州 510640)(2.广州市食品检验所,广东广州 511400)
副溶血性弧菌是引起水产品食源性疾病的主要致病菌。我国海岸线较长,且沿海城镇往往是人员居住密集的地方,水产品是沿海居民钟爱的食品,居民不慎食用受到副溶血性弧菌污染的水产品造成集体食物中毒是沿海人民细菌性食物中毒主要原因,而副溶血性弧菌食物中毒通常表现为出现中毒症状人数多,但较少死亡。金连梅等[1]对2004年至2007年全国食物中毒事件分析,及何洁仪等[2]对1997年至2007年广州市发生的副溶血性弧菌食物中毒事件和中毒样品进行统计分析,均表明副溶血性弧菌在各食源性致病菌食物中毒事件中居首位,故对水产品中的副溶血性弧菌的毒力及药敏性研究具有重要意义。
在副溶血性弧菌致病因子的研究方面,耐热性直接溶血毒素(TDH)、耐热性相关溶血毒素(TRH)、不耐热溶血毒素(TLH)是副溶血性弧菌的主要溶血毒素。耐热直接毒素TDH是Obara在KP试验(神奈川试验)呈现阳性的副溶血性弧菌液体培养基中分离得到的,化学成分主要为无糖、脂质的蛋白质,分子质量为42000 u,该毒素在100 ℃仍能保持10 min活性,属耐高温毒素,所以称为 TDH[3]。Nishibuchi等在食物中毒病例中分离出一批副溶血性弧菌为KP试验呈现阴性,但不产生TDH,认为除TDH外,副溶血性弧菌还有其他致病因子,研究发现这种因子同样可导致溶血现象、细胞致死现象、引起肠毒性、心脏毒性等与TDH相似的症状,但相比TDH,其在100 ℃10 min不能存活,呈现不耐热,且溶解牛红细胞、不溶解马红细胞,与 TDH引起溶血作用的敏感动物红细胞种类不同,分子质量为48000 u,与KP阳性无关,命名为 TRH[4]。TLH[5]需要卵磷脂的存在才具有溶血活性,由两种具有交叉免疫原性,分子质量为43000 u和45000 u的蛋白质组成,能溶解人和马的红细胞,是一种非典型的磷脂酶。而在副溶血性弧菌脲酶生化研究方面,有研究表明副溶血性弧菌脲酶阳性与致病性有相关性,脲酶阳性菌株能引起小鼠腹泻。也有发现表明副溶血性弧菌的脲酶与人的感染联系不大,但有试验表明脲酶阳性菌株与trh之间呈正相关[3,4]。
在副溶血性弧菌毒力基因携带情况的研究方面,对副溶血性弧菌的毒力基因,认识比较清楚的是溶血素基因,包括编码TDH的基因tdh,编码TRH的基因trh,以及编码TLH的基因tlh。研究发现Ⅲ型分泌系统基因(type three secretion system,TTSS)及tdh毒力基因等组成一个 80 kb的毒力岛。trh基因分为trh1和trh2两种,研究发现镍转运系统操纵子、尿素酶基因簇及trh基因是紧密相连在染色体上,故检测尿素酶活性可判断该副溶血性弧菌菌株是否trh阳性[6]。陈伟伟等对1998年以来从福建省分离的48株副溶血性弧菌进行毒力基因检测,其中包括食物中毒临床病人样品中分离的21株,食品样品分离的27株,结果为食品和临床病人分离菌株均检出tlh基因,未检出trh基因;临床患者分离的21株均检出tdh基因,而食品分离的27株中tdh基因检出率为37.00%,表明副溶血性弧菌食物中毒与副溶血性弧菌的tdh基因有关,tdh基因可作为副溶血性弧菌致病性的特异性检测项目[7]。ToxR/S是大流行株相关毒力基因,大流行株指的是可在较短时间内在较大范围引起公共卫生事件的菌株。toxR/S是膜整合蛋白,在弧菌毒力基因转运和表达中发挥重要作用,广泛存在于副溶血性弧菌无毒力和毒力菌株中[8]。
在副溶血性弧菌对抗菌类药物敏感性的研究方面,其结果在不同菌株间常表现一定差异。通常表现对氯霉素、环丙沙星、庆大霉素、头孢噻肟、磺胺等药物敏感,对头孢唑啉、呋喃唑酮、红霉素、新生霉素、万古霉素、氨苄西林等耐药。朱敏等对来自门诊腹泻患者、肉类食品、食物中毒患者等不同来源的120株副溶血性弧菌进行耐药性监测,结果表明头孢呋辛酯、头孢呋辛、头孢唑啉、头孢噻吩的耐药率均在50.00%以上,对氨苄西林耐药率为49.17%、羧苄西林耐药率为 43.33%、阿莫西林/克拉维酸耐药率为32.50%,对头孢曲松、环丙沙星、氧氟沙星、庆大霉素、米若环素、替卡西林/棒酸等11种抗生素均敏感;同时耐3种或3种以上抗生素的占总数80.00%,食物中毒菌株耐3种或3种以上抗生素的多重耐药现象较严重,有6.70%副溶血性弧菌同时耐7种抗生素的耐药株,研究表明要警惕由多重耐药副溶血性弧菌引起的食源性疾病或食物中毒[9]。
1 材料与方法
1.1 样品及菌株
样品来自几处水产市场的鱼类、虾类、蟹类、贝类等水产食品样品,菌株有来自上述水产样品中的副溶血性弧菌分离株及副溶血性弧菌标准菌株 ATCC 17802。
1.2 主要试剂
副溶血性弧菌荧光 PCR检测试剂盒(Reaction Mix、Taq polymerase)、裂解液lysis buffer,德国拜发有限公司;2×Taq PCR MasterMix、ddH2O、SYBY GREEN I染料、VITEK2革兰氏阴性细菌药敏卡AST-GN04,天根生化科技(北京)有限公司;3%氯化钠碱性蛋白胨水(3% APW)、3%氯化钠胰蛋白胨大豆琼脂、氯化钠,广东环凯微生物科技有限公司;VITEK2革兰氏阴性鉴定卡(GN鉴定卡),生物梅里埃美国股份有限公司;弧菌显色培养基,法国科玛嘉有限公司;琼脂糖,Sigma-Aldrich;DS 2000 Marker,东盛生物科技有限公司。
1.3 引物
参考相关文献中副溶血性弧菌的tdh、trh、tlh、toxR/S毒力基因引物,引物委托华大基因(深圳)有限公司进行合成,详见表1。

表1 副溶血性弧菌相关毒力基因的引物Table 1 List of Vibrio parahaemolyticus genes and primers
1.4 仪器与设备
PCR仪,ABI,Thermo Fisher赛默飞世尔(上海)有限公司;水平电泳系统、凝胶成像仪Geldoc XR+、荧光PCR仪CFX96 Touch,Bio-Rad Laboratories,inc;VITEK 2 Compact自动生化鉴定仪,法国梅里埃生物有限公司;超低温冷冻柜,松下电器(中国)有限公司;生物安全柜Ⅱ级A2型,Thermo Fisher赛默飞世尔(上海)有限公司;微型离心机Mini-10K,杭州奥盛仪器有限公司;微型离心机 C1301-230v,美国Labnet公司;生化培养箱KB240,宾德环境试验设备(上海)有限公司;高压灭菌锅GR85DR,致微(厦门)仪器有限公司。
1.5 方法
1.5.1 样品采集
样品来自2016年至2019年在南方某市几处水产市场采集的鱼类、虾类、蟹类、贝类等152份市售水产食品样品。
1.5.2 副溶血性弧菌分离鉴定
副溶血性弧菌分离具体方法参考《GB 4789.7-2013 食品安全国家标准 食品微生物学检验副溶血性弧菌检验》。鉴定部分如下:
生化鉴定:从 3%氯化钠胰蛋白胨大豆琼脂平板挑取适量菌落至3%无菌盐水中,制成0.5~0.63麦氏浊度的菌悬液,放入革兰氏阴性鉴定卡后,利用VITEK2全自动微生物生化鉴定仪进行孵育检测分析,待其完成检测后,打印报告及分析结果。
荧光PCR鉴定:从3%氯化钠胰蛋白胨大豆琼脂平板挑取适量菌落至装有 500 μL生理盐水的 EP管中,加入500 μL lysis buffer裂解液,再将EP管放至金属浴中95 ℃裂解10 min后制成样品DNA模板冷却备用。PCR反应体系:取5 μL样品DNA模板,加入副溶血性弧菌荧光 PCR检测试剂盒中 19.9 μL Reaction Mix和0.1 μL Taq polymerase,涡旋混匀并离心,总体积为25 μL。PCR反应参数:95 ℃预变性1 min;95 ℃预变性15 s,60 ℃退火30 s,45个循环。待其完成检测后,打印报告及分析结果。将上述副溶血性弧菌分离株从 3%氯化钠胰蛋白胨大豆琼脂平板挑取并转入磁珠,放于-70 ℃保存备用。
1.5.3 副溶血性弧菌毒力基因鉴定
DNA模板的制备:取出-70 ℃保存的样品副溶血性弧菌分离株,在 3%氯化钠胰蛋白胨大豆琼脂平板上划线,36 ℃培养过夜,挑取适量菌落至装有500 μL生理盐水的EP管中,加入500 μL裂解液lysis buffer,再将EP管放至恒温金属浴中95 ℃裂解10 min后冷却备用。PCR反应体系:取DNA模板5 μL、上下游引物各 1 μL、12.5 μL 的 2×Taq PCR MasterMix、5.5 μL ddH2O,总体积25 μL。PCR反应参数:94 ℃预变性3 min;94 ℃预变性 30 s,退火 30 s(退火温度见表3),72 ℃延伸40 s,35个循环;最后72 ℃延伸10 min。
PCR扩增产物电泳:称取相应质量的琼脂糖至三角瓶中,加入适量的0.5×TBE电泳缓冲液,用微波炉加热溶解琼脂糖,配制成 2%的凝胶,凝胶取出后加入万分之一GeneGreen核酸染料,并摇匀。将胶槽放入制胶板中,插入适当的梳子,倒入溶解的琼脂糖凝胶,待凝胶完全冷却凝固后,垂直拔出梳子,将凝胶取出,放至电泳槽。电泳槽中0.5×TBE电泳缓冲液应高于凝胶2 mm左右。吸取5 µL DNA模板加入点样孔,及加入DS 2000 Marker(小孔上样量为3 µL左右)。打开电泳仪电源开关,调节电压至80~100 V及合适的电泳时间(约60~90 min),开始电泳。打开电脑开启凝胶成像软件 Image Lab,待电泳结束后取出凝胶置于凝胶成像仪检测板进行拍照检测。
1.5.4 副溶血性弧菌药敏试验
取出-70 ℃保存的副溶血性弧菌分离株,在3%氯化钠胰蛋白胨大豆琼脂平板上划线,36 ℃培养过夜,从 3%氯化钠胰蛋白胨大豆琼脂平板挑取适量菌落至无菌生理盐水中,制成0.5~0.63麦氏浊度的菌悬液,再吸取145 μL至3 mL无菌生理盐水制成样液,放入革兰氏阴性细菌药敏卡AST-GN04,然后按相关操作至VITEK2全自动微生物生化鉴定仪进行孵育,待其完成检测后,打印报告及分析结果。
VITEK2系统将参照对照反应孔内的生长情况,评估每种细菌在存在抗菌药物时的生长模式。根据观察到的多个生长特征参数计算MIC值,根据鉴别性分析制订算法,以便确定系统上针对所有抗菌药物的敏感性结果。MIC结果必须与某种细菌鉴定相关联,以便确定敏感性判读。结果分为敏感(S),中介(I)和耐药(R)来表示。敏感susceptible(S)是指使用常规剂量时,细菌能生长繁殖可达到的抗菌药物抑制浓度水平。中介 intermediate(I)是指常规剂量的抗菌药物对细菌疗效低于敏感菌株,药物在浓度较大的部位有效或可使用高于正常剂量进行治疗。耐药resistant(R)细菌不能被常规剂量的抗菌药物所抑制,或能够证明抑菌药物浓度在某些特定细菌耐药机制范围内。
1.5.5 数据处理
本文数据结果统计及表格是用Excel软件进行处理制作,凝胶电泳图是用凝胶成像仪Geldoc XR+软件生成,显著性差异计算是用SPSS软件进行数据处理制作。
2 结果与讨论
2.1 水产品中副溶血性弧菌的检出结果分析
对152份水产样品进行副溶血性弧菌分离鉴定,其中有 21份样品检出副溶血性弧菌,检出率为13.82%,并从中分离出以VITEK 2 Compact自动生化鉴定仪及荧光 PCR两种方法均鉴定为副溶血性弧菌的分离株60株。与其他研究对比分析,张健等对市售水产品致病菌进行检测发现,副溶血性弧菌检出率高于本研究中的检出率,为 56.36%[11]。而林晓华等在2014年~2015年对生食水产品致病菌进行检测,其中副溶血性弧菌检出率为7.56%[12],本文副溶血性弧菌及其他致病菌检出率较高的原因一是由于在研究过程中对水产样品各部位均有采样,未针对主要食用部分进行采样;二是由于本文实验样品大多为需熟制烹饪加工才能食用的生鲜或冷冻水产品。
2.2 副溶血性弧菌生化鉴定结果分析
本节试验结果是通过VITEK2全自动生化鉴定仪进行孵育鉴定的,自动生化仪中鉴定的每种细菌或某细菌群的试验反应会和期望反应作对比,系统用鉴定准确率表示待测菌试验反应会和期望反应的相关程度[13]。通过本次研究,发现此 60株副溶血性弧菌生化反应结果是多样化的,发现与常规生化试验概率有所不同的项目有:甘露醇试验结果阳性率为93.33%,其中有1株阴性及2株弱阴性;β-半乳糖苷酶阴性率为93.33%,其中3株为阳性,1株为弱阳性;a-半乳糖苷酶阴性率为96.67%,其余2株为阳性;尿素酶试验结果阴性率为 100%;赖氨酸脱羧酶试验结果阴性率为41.67%,阳性率为58.33%。结果的差异化反映了副溶血性弧菌属在生长繁殖代谢过程中存在种或亚种的区别,有可能获得一些特殊的生化类型。而对副溶血性弧菌的生化项目进行整理,有助于下一步毒力基因分布情况及耐药性的分析。各副溶血性弧菌分离株的相关生化项目结果详见表2。
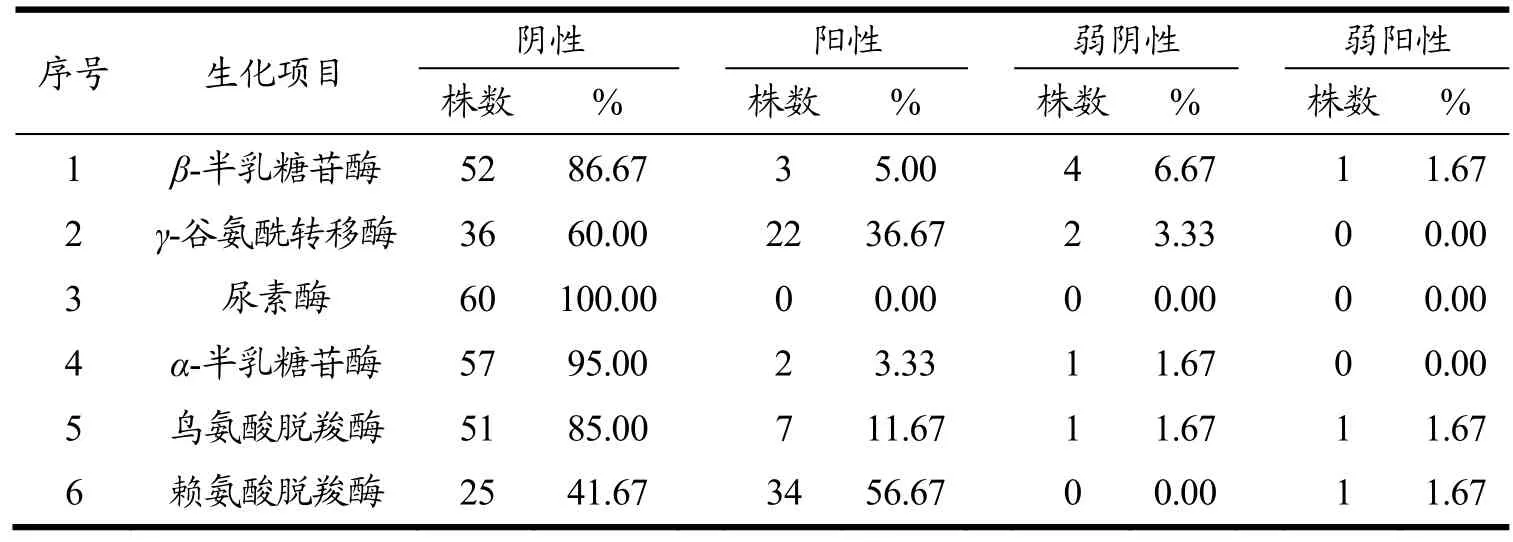
表2 60株副溶血性弧菌相关生化鉴定结果Table 2 Biochemical identification results of 60 Vibrio parahaemolyticus
2.3 副溶血性弧菌毒力基因鉴定结果
2.3.1 部分副溶血性弧菌毒力基因 PCR鉴定图谱
如toxR/S毒力基因(扩增片段长度为679 bp)。toxR/S毒力基因与其他毒力基因转运和表达相关,对60株副溶血性弧菌进行toxR/S毒力基因筛查,发现均检出toxR/S毒力基因,详见图1。
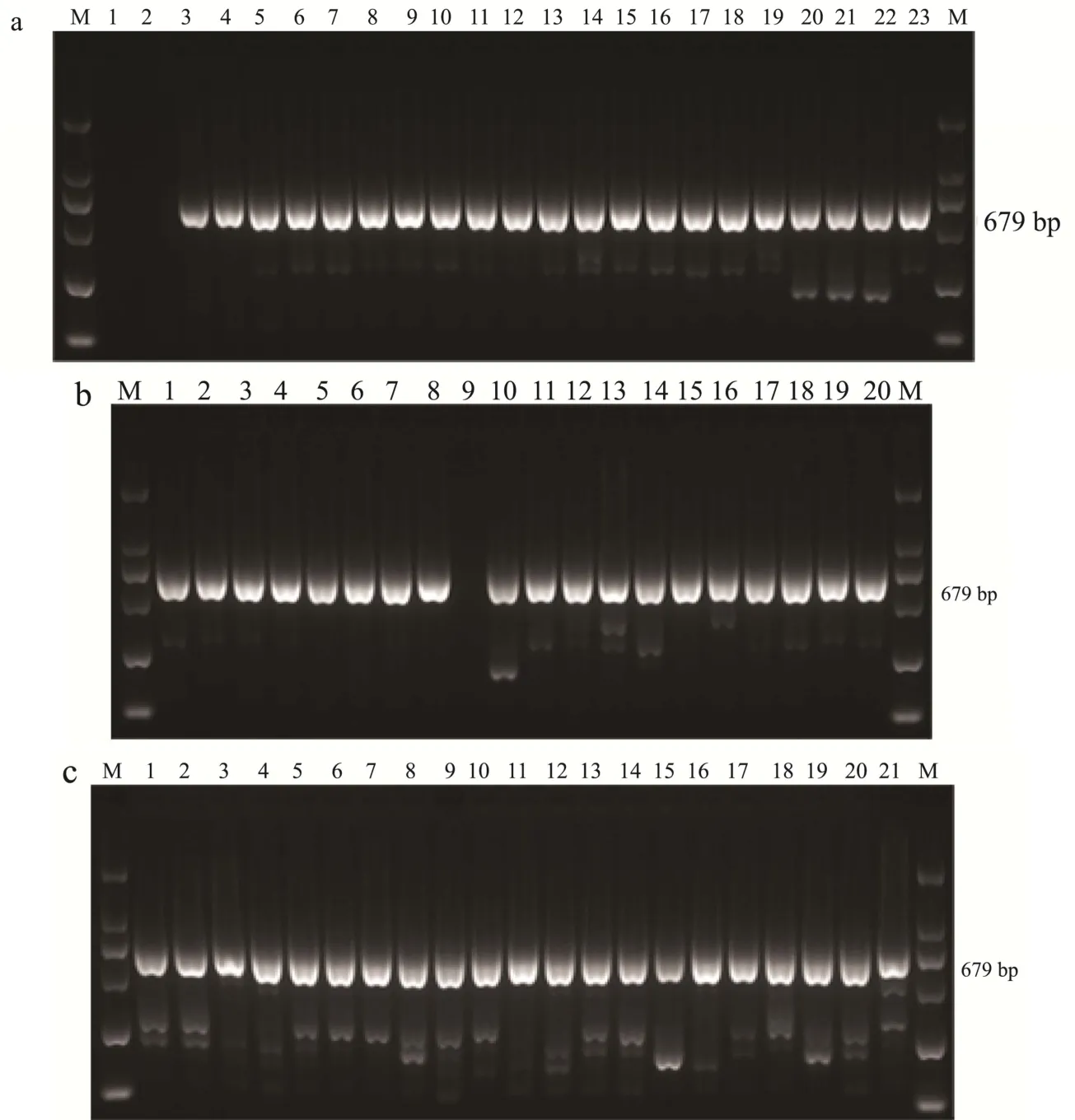
图1 水产品副溶血性弧菌分离菌株的ToxR/S毒力基因PCR扩增图谱Fig.1 PCR amplification of ToxR/S gene of vibrio parahaemolyticus isolated from aquatic products
2.3.2 60 株副溶血性弧菌的4种毒力基因鉴定结果
60株副溶血性弧菌的毒力基因分布情况详见表3。由表3可知:tdh基因阳性有 57株(携带率为95.00%),trh基因阳性有39株(携带率为65.00%),tlh基因携带率为 100.00%,toxR/S基因携带率为100.00%,其中携带四重毒力基因的菌株有37株(携带率为61.67%),娄阳[14]对上海市不同来源副溶血性弧菌tdh基因和trh基因进行检测,其tdh基因携带率为88.10%,trh基因携带率为为28.57%,较低于本文的携带率。
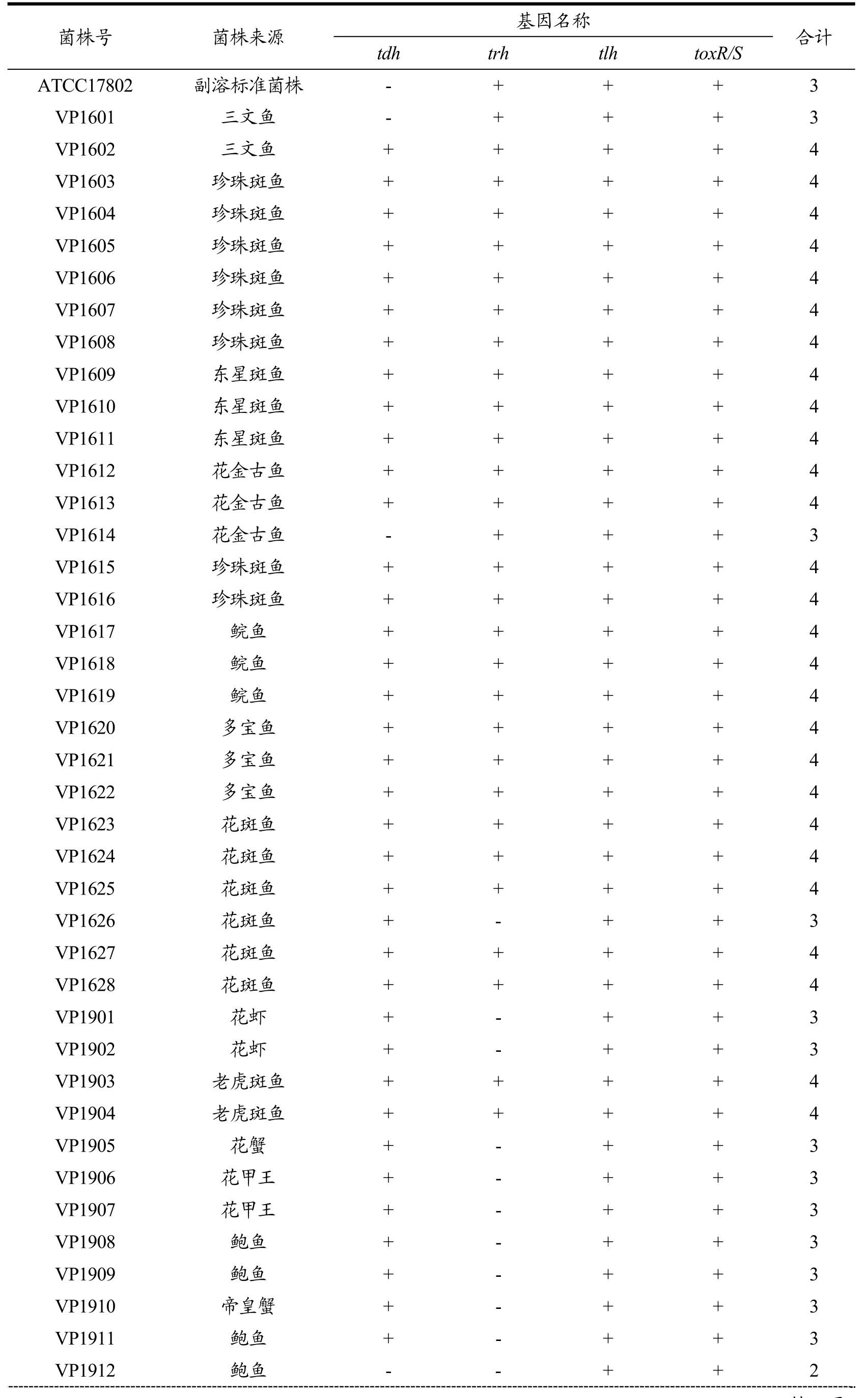
表3 60株副溶血性弧菌的4种毒力基因鉴定结果Table 3 Identification results of 4 virulence genes of 60 Vibrio parahaemolyticus
从不同水产品类分析,此 60株副溶血性弧菌在tdh基因携带率方面,鱼类分离株携带率为 93.33%(28/30),蟹类分离株携带率为100.00%(15/15),贝类分离株携带率为91.67%(11/12);在trh基因携带率方面,鱼类分离株携带率为96.67%(29/30),蟹类分离株携带率为 46.67%(7/15),贝类分离株携带率为 16.67%(2/12),鱼类与蟹类、贝类携带率均有显著性差异(鱼类与蟹类携带率 x2=12.66,p<0.05,鱼类与贝类携带率x2=22.80,p<0.05。)
结合生化鉴定结果分析,有研究发现副溶血性弧菌的脲酶与人的感染联系不大,但也有试验表明脲酶阳性菌株与trh之间呈正相关[3,4]。本文检出携带trh毒力基因的菌株有39株,而尿素酶试验中60株菌株均为阴性,未发现尿素酶阳性的菌株,未能对尿素酶与其致病性存在的关系进行判断分析。
VP1913 鲍鱼 + + + + 4 VP1914 红蟹 + - + + 3 VP1915 鲍鱼 + - + + 3 VP1916 鲍鱼 + - + + 3 VP1917 花螺 + - + + 3 VP1918 鲍鱼 + - + + 3 VP1919 蟹 + + + + 4 VP1920 蟹 + - + + 3 VP1921 蟹 + - + + 3 VP2001 蟹 + + + + 4 VP2002 蟹 + - + + 3 VP2003 蟹 + + + + 4 VP2004 蟹 + + + + 4 VP2005 蟹 + - + + 3 VP2006 蟹 + + + + 4 VP2007 蟹 + - + + 3 VP2008 蟹 + + + + 4 VP2009 龙虾 + + + + 4 VP2010 鲍鱼 + + + + 4 VP2011 蟹 + + + + 4合计 57 39 60 60检出率/% 95.00 65.00 100.00 100.00
2.4 副溶血性弧菌药敏试验结果
通过VITEK2全自动生化鉴定仪对60株副溶血性弧菌的19种抗菌药物药敏实验结果详见表4。从表4可知,此60株分离自水产品的副溶血性弧菌对氨苄西林有极高的耐药性,耐药率为96.67%,申进玲等对上海进口水产品中副溶血性弧菌耐药性研究中氨苄西林耐药率为98.53%,与本文结果相似[15]。而分离株对由舒巴坦和氨苄西林共同组成的混合物氨苄西林/舒巴坦则均为敏感;有4株对甲氧苄啶/磺胺甲恶唑呈现耐药,其余均为敏感;对头孢呋辛及头孢呋辛酯的测试结果大多为中介;有4株对哌拉西林呈中介,其余均为敏感。
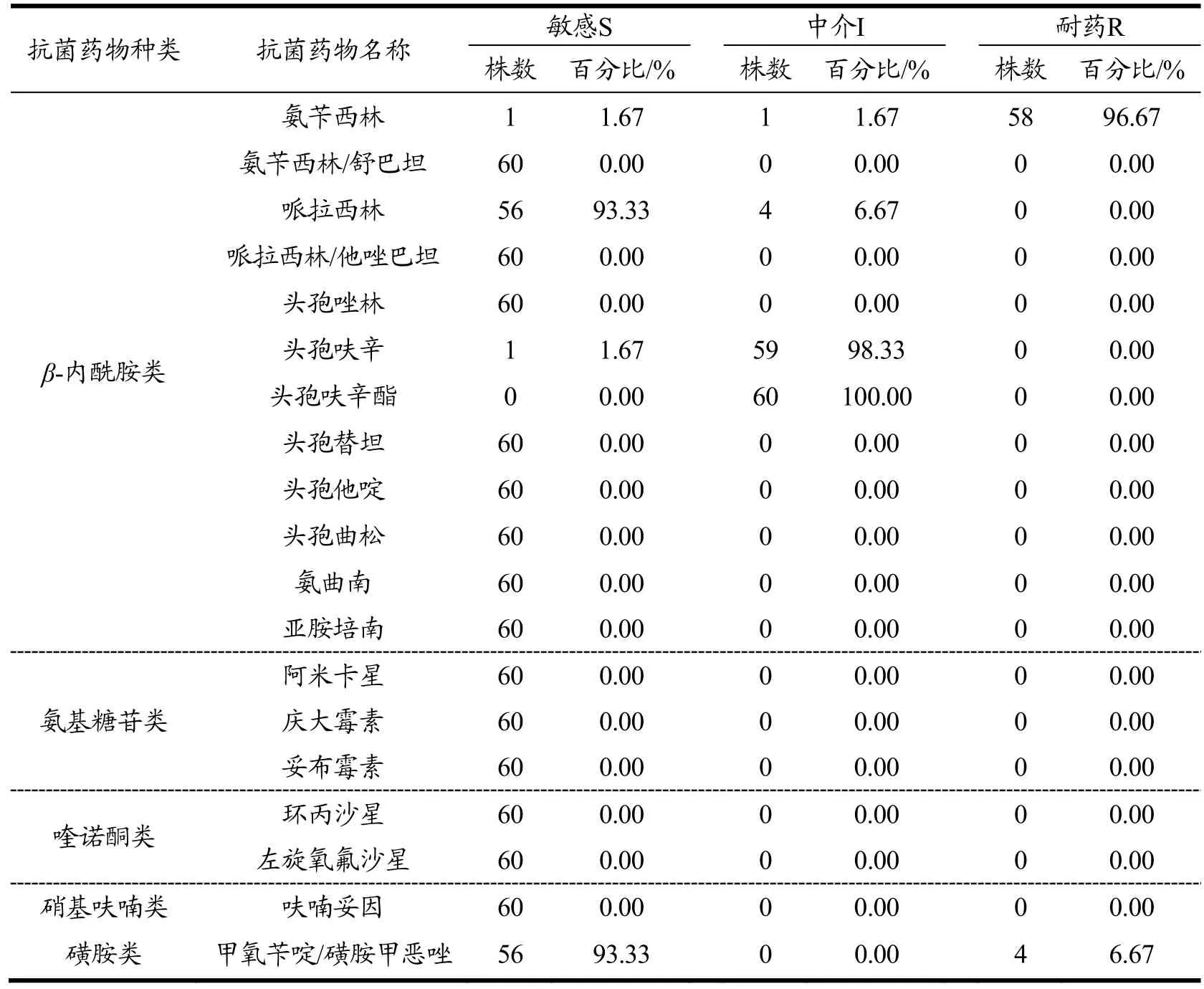
表4 60株副溶血性弧菌对19种抗菌药物敏感试验的结果Table 4 60 strains of Vibrio parahaemolyticus exposed to 19 kinds of antibiotics sensitivity test results
60株副溶血性弧菌的多重耐药情况详见表5。从表5可知,仅有4株菌株有2重耐药,多重耐药现象不突出。耐2种药物的菌株主要来自鱼类;耐1种药物及对3种药物呈中介的菌株则在鱼类、贝类及虾类均有检出。
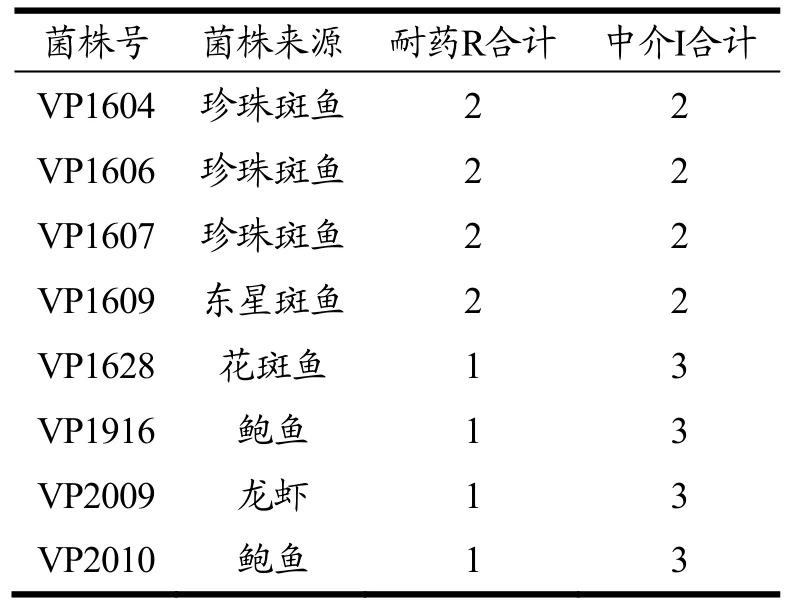
表5 60株副溶血性弧菌中具有较多耐药的菌株一览表Table 5 List of strains with more drug resistance in 60 Vibrio parahaemolyticus
结合生化结果分析,耐2种药物的菌株VP1604、VP1606、VP1607均与副溶血性弧菌典型生化相符,菌株VP1609的D-甘露醇结果为阴性,其余项目与副溶血性弧菌典型生化相符。耐1种药物及对3种药物呈中介的4株菌株均与副溶血性弧菌典型生化相符。
结合毒力基因结果分析,耐2种药物的4株菌株均具有4重毒力;耐1种药物及对3种药物呈中介的菌株VP1628、VP2009、VP2010具有4重毒力,VP1916则具有3重毒力。不携带tdh及trh毒力基因的菌株VP1912对此19种药物不呈现耐药性,对氨苄西林、头孢呋辛及头孢呋辛酯此3种药物呈现中介。本研究中 60株食源性副溶血性弧菌分离株大多具有临床菌株的特征基因,谭海芳等在对肇庆市副溶血性弧菌耐药性研究时指出,由于近年来抗生素的大量使用,各食源性病原菌耐药株日益增多,当出现耐3种或3种以上药物时,要警惕超级耐药株引起的副溶血性弧菌食源性疾病[16]。随着对副溶血性弧菌的致病机制和药敏性的研究越来越多。
3 结论
3.1 对60株副溶血性弧菌的典型生化项目特征进行分析,发现其生化反应结果是多样化的,赖氨酸脱羧酶试验等项目结果与常规生化试验概率有所不同。
3.2 对60株副溶血性弧菌分离株的毒力基因进行鉴定分析,发现毒力基因分布如下:tdh基因携带率95.00%,trh基因携带率为65.00%,tlh基因携带率为100.00%,toxR/S基因携带率为100.00%,其中四重毒力基因携带率61.67%,结果表明分离株具有较高的毒力基因携带率,且多数携带多重毒力基因。携带 trh毒力基因的菌株有39株,而尿素酶试验中60株菌株均为阴性,未发现尿素酶阳性的菌株,未能对尿素酶与其致病性存在的关系进行判断分析。
3.3 对60株副溶血性弧菌的耐药性进行鉴定分析,发现60株菌株均对氨苄西林有极高的耐药性,耐药率为96.67%;有4株对甲氧苄啶/磺胺甲恶唑呈现耐药;但对由舒巴坦和氨苄西林共同组成的混合物氨苄西林/舒巴坦则均为敏感。多重耐药现象不突出,仅有4株菌株对2种药物耐药,主要来自鱼类;耐1种药物及对3种药物呈中介的菌株则在鱼类、贝类及虾类均有检出。耐2种药物的4株菌株均具有4重毒力,不携带tdh及trh毒力基因的菌株VP1912对此19种药物不呈现耐药性。结果表明分离株耐药情况不突出,但对抗菌类药物氨苄西林的耐药率较高,需警惕水产食品中副溶血性弧菌的潜在威胁。
4 展望
随着人们对食品安全需求的日益增长及水产品市场的逐渐发展,针对水产品中副溶血性弧菌的致病机制和药敏性的研究越来越多。因时间和条件所限,本研究还有很多实验需要进一步开展,如结合相关生化及毒理实验对副溶血性弧菌的毒力表达进行研究,结合耐药基因筛查对药敏性进行深入研究等,以挖掘更多潜在的毒力及耐药因子,探索副溶血性弧菌致病机制和药敏性之间的关系,为副溶血性弧菌的快速检测及防控提供实验依据和理论基础。
