4种鳕鱼多重PCR检测方法建立
2021-09-02孙晓飞万超宋大贺贾赟
孙晓飞,万超,宋大贺,贾赟
(1.大连海关技术中心,辽宁大连 116001)(2.大连海关综合技术服务中心,辽宁大连 116001)
鳕鱼属脊椎动物门(Vertebrata)、脊椎动物亚门(Vertebrata)、真骨鱼纲(Teleostei)、鳕形目(Gadiformes)。鳕鱼多是生活在海洋底层和深海中下层的冷水性鱼类,广泛分布于世界的各大洋,是价值极高的世界级重要经济鱼类,其肉质鲜美,营养丰富;胰腺含有大量的胰岛素,可以从 1 kg胰腺中提取12000 IU胰岛素;鳕鱼的肝脏可用于提取鱼肝油(含油量 20%~40%)[1,2]。因鳕鱼具有极高的经济价值,国内外市场不断出现以假乱真、以次充好事件,原质检总局曾通报不法企业以鲶鱼内脏冒充鳕鱼内脏出口。针对这类掺假造假的判断,传统的形态特征鉴别方法已经不能满足,必须基于更精准的物种鉴定技术[3,4]。由此可见,为了更加有效地确保出口鳕鱼产品质量,防止欺诈,建立一种可以对鳕鱼DNA进行特异性检测的准确性高、实用性强的方法,从分子水平上对鳕鱼样品进行特异性检测鉴定,都是十分亟需和必要的。目前的鳕鱼PCR检测文章是针对鳕属与其他鱼类目、属的区别,并未区分鳕形目内不同属、科的鱼类,在鳕科中不同的鳕鱼也存在着差异。本文中太平洋鳕鱼以及大西洋鳕鱼无论从经济价值还是营养价值都要高于黑线鳕鱼和蓝鳕鱼,按照常规鳕鱼的检测方法是无法进行区分的,为了避免了一些不法分子混淆概念,用价格低廉的鳕鱼替代价格昂贵的真鳕,特选取4种经济鳕鱼,太平洋鳕、大西洋鳕、狭鳕、绿青鳕进行检测,为保障食品安全提供技术保障。
多重PCR技术是在常规PCR基础上改进并发展起来的一种新型PCR扩增技术,是在同一反应体系中加入多对引物同时扩增多条目的DNA片段的方法,采用这一技术可同时检测多个物种[5-8]。突触素样蛋白pantophysin(Pan I)是公认相对保守的DNA序列,动物分类学和生态学中得到了广泛应用[9-12]。由于多重PCR同时扩增多个目的基因,具有节省时间、降低成本、提高效率的优点,特别是节省珍贵的实验样品,所以一经提出,即得到众多研究者的青睐,并且发展迅速,在生命科学的各个领域得以应用。本文选取 4种经济鳕鱼,太平洋鳕、大西洋鳕、狭鳕、绿青鳕,通过设计的特异性引物,可对鳕鱼种内、种间进行分析,为鳕鱼的物种鉴定提供技术支撑。
1 材料与方法
1.1 原料
1.1.1 试剂及耗材
海洋动物基因组DNA提取试剂盒(DP324):天根生物公司;Premix Ex Taq:TaKaRa公司;琼脂糖:北京沃比森科技有限公司;引物:上海生工生物公司;广泛收集鱼类样品:太平洋鳕鱼、大西洋鳕鱼、狭鳕鱼、绿青鳕鱼、黑线鳕鱼、南蓝鳕鱼、蓝鳕鱼、红鱼、六线鱼、黄花鱼、鲈鱼、蓝鳍红娘鱼、大西洋蓝金枪、牙鲆、多宝鱼、龙利鱼、大马哈鱼、大西洋鲑鱼、太平洋鲱鱼、小体鲟鱼以及欧鳇等来自大连各水产市场及中国水产研究院。
1.1.2 仪器设备
荧光定量PCR仪:美国Bio-Rad公司,凝胶成像系统:美国Bio-Rad公司,超微量分光光度计:Nano Drop 2000;梯度PCR仪:德国eppendorf公司。
1.2 试验方法
1.2.1 DNA提取
采用海洋动物基因组DNA提取试剂盒,按照试剂盒说明书提取100 mg肉中的总DNA,保存于-20 ℃冰箱备用。并测定OD260 nm值,计算DNA质量浓度。
1.2.2 实时荧光PCR引物设计
通过大西洋鳕、绿青鳕、太平洋鳕和狭鳕比对分析,在序列的差异处设计特异性引物,序列见表1。将设计好的引物在NCBI进行序列分析,利用primer blast程序选择nr数据库,进行特异性分析:结果表明,只有大西洋鳕、绿青鳕、太平洋鳕和狭鳕的物种能和所设计的引物完全互补结合,没有检验到完全匹配的其它物种,证明引物的特异性较好。
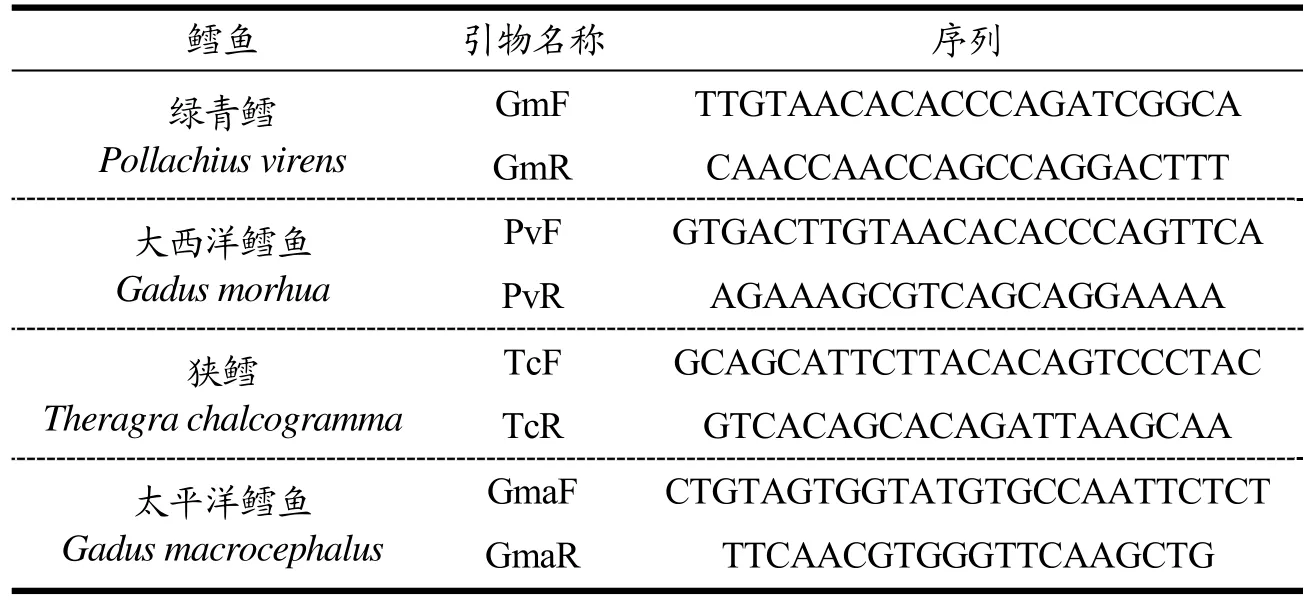
表1 特异性引物序列Table 1 Specific primer sequence
1.2.3 引物的特异性
为检测大西洋鳕、绿青鳕、太平洋鳕和狭鳕PCR法的单项引物的特异性,利用上述引物对四种鳕鱼及其他鱼类样品 DNA分别进行实时 PCR扩增。荧光PCR反应体系为50 μL,反应体系见表2。反应条件为:95 ℃预变性30 s;95 ℃变性5 s、60 ℃退火延伸30 s,40个循环。PCR产物用2%琼脂糖凝胶110 V电泳,通过凝胶成像系统进行分析。

表2 PCR反应体系Table 2 PCR reaction system
1.2.4 多重PCR方法
1.2.4.1 二重PCR
将不同鳕鱼模板两两混合(太平洋鳕+绿青鳕;太平洋鳕+大西洋鳕;太平洋鳕+狭鳕;绿青鳕+大西洋鳕;绿青鳕+狭鳕;狭鳕+大西洋鳕),PCR产物为两种鳕鱼Pan I基因片段的特异性引物,进行PCR反应。反应体系及条件见3.2.2。
1.2.4.2 三重PCR
将不同鳕鱼模板三种混合(大西洋鳕+绿青鳕+太平洋鳕、大西洋鳕+太平洋鳕+狭鳕、太平洋鳕+狭鳕+绿青鳕),PCR产物为三种鳕鱼Pan I基因片段的特异性引物,进行PCR反应。反应体系及条件见3.2.2。
1.2.4.3 四重PCR
将四种鳕鱼模版进行混合,PCR产物为四种鳕鱼Pan I基因片段的特异性引物,进行PCR反应。反应体系及条件见3.2.2。
1.2.5 灵敏度的检测
为检测鳕鱼多重 PCR法的灵敏度,将四种鳕鱼DNA梯度稀释,进行DNA浓度灵敏度实验,制备成100 ng/μL、20 ng/μL、4 ng/μL、0.8 ng/μL 4 个浓度梯度的混合样品(起始浓度100 ng/μL含每种鳕鱼样品25 ng/μL),进行灵敏度实验。
2 结果与讨论
2.1 PCR扩增结果
PCR扩增结果见图1~4。
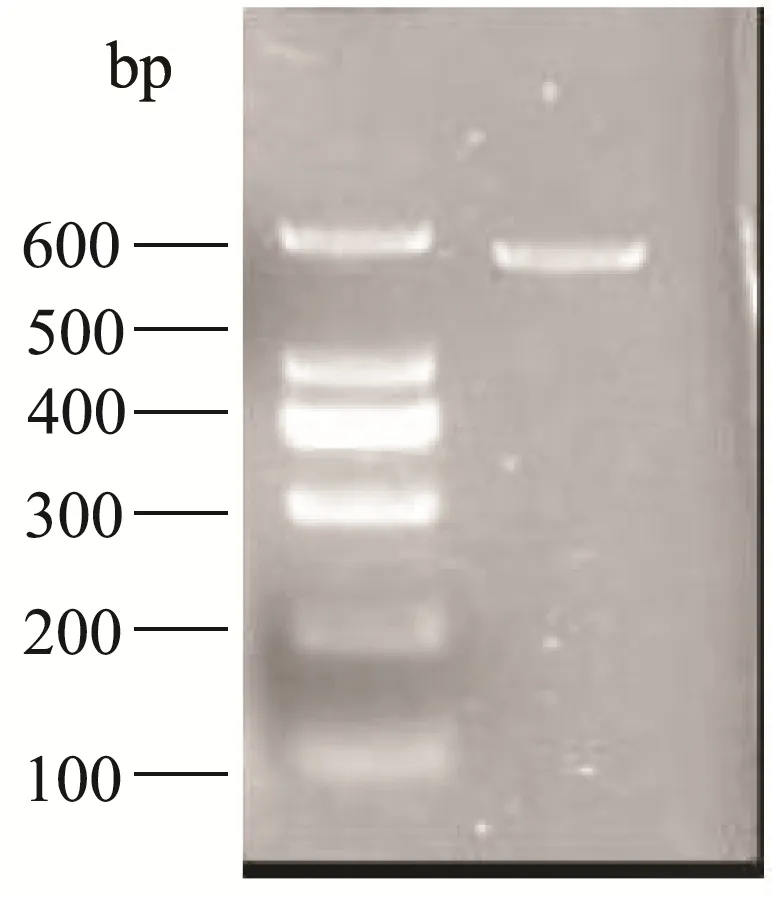
图1 大西洋鳕单对引物PCR扩增结果Fig.1 The PCR amplification results of a single pair of primers for Atlantic cod
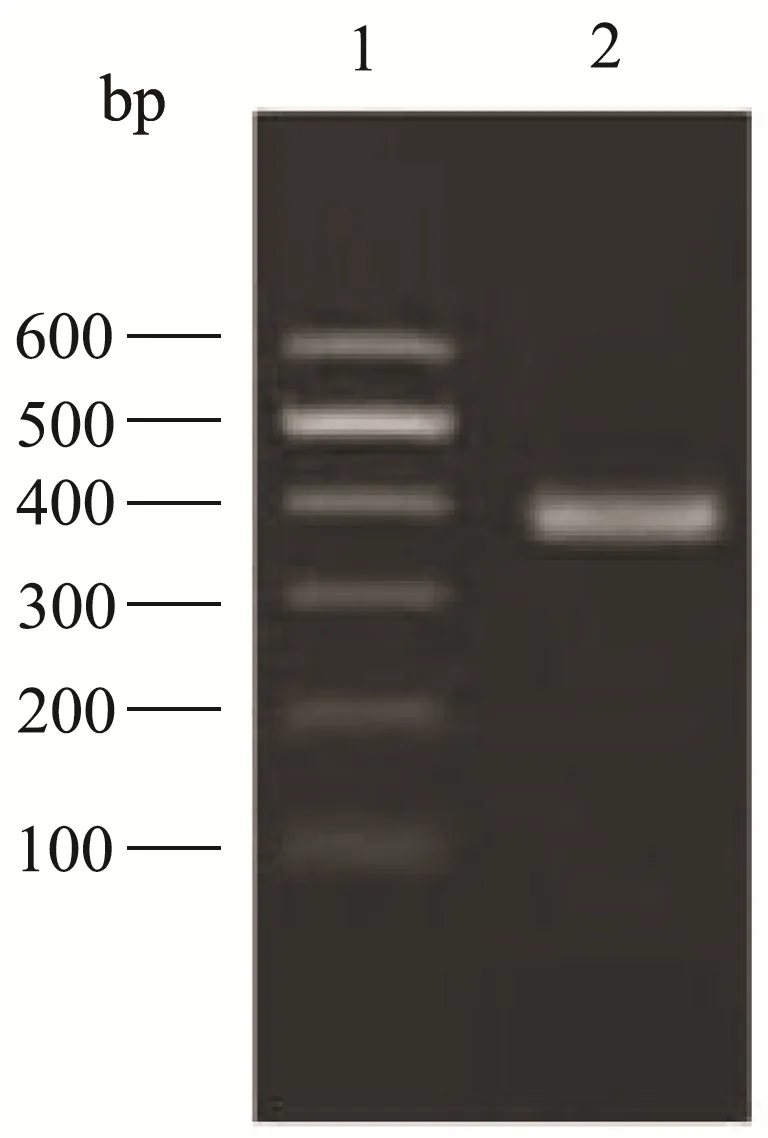
图2 绿青鳕单对引物PCR扩增结果Fig.2 PCR amplification results of a single pair of primers for Alaska pollock
图3 太平洋鳕单对引物PCR扩增结果Fig.3 PCR amplification results of a single pair of primers for Pacific hake

图4 狭鳕单对引物PCR扩增结果Fig.4 Alaska pollack single-pair primer PCR amplification results
结果显示,四种不同鳕鱼PCR均扩增出相应特异性条带。即对应的大西洋鳕、绿青鳕、太平洋鳕和狭鳕四种鳕鱼分别出现597、392、266、527 bp大小的清晰条带。说明4对引物设计满足检测需求。一般认为,在一定范围内,引物序列越长,PCR反应的特异性越高、灵敏度越低。因此,在方法设计中,选择合适长度的多重PCR引物序列,从而获得最优化的检测灵敏度、特异性及各目标片段扩增均一性将尤为关键。对此,本研究基于相同的特异性位点设计了长度不同的两套引物,试验结果显示,当把引物片段长度降低到18~24 bp时,在优化的反应条件下,对绿青鳕DNA及其两两混合物的检测表现出良好的特异性与灵敏度。使用长度为28 bp的引物,对目标绿青鳕的检测表现出扩增效率的差异,绿青鳕成分难以被检出。
2.2 特异性检测结果
以四对引物混合为PCR引物,四种不同鳕鱼PCR均扩增出相应特异性条带,并且只有该物种对应的一条条带。即对应的大西洋鳕、绿青鳕、太平洋鳕和狭鳕四种鳕鱼分别出现597、392、266、527 bp大小的清晰条带,以其他鱼类为模板作为阴性对照无条带,见图5。
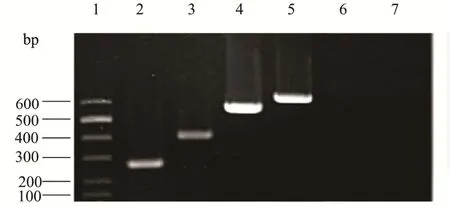
图5 大西洋鳕、绿青鳕、太平洋鳕和狭鳕引物的特异性Fig.5 The specificity of primers for Atlantic cod, Alaska Pollock,Pacific Hake and Alaska pollack
影响多重PCR反应效果的因素很多,其中引物设计直接影响PCR扩增的特异性与灵敏度;另外,PCR体系的优化可以使多重PCR得到最佳效果。通过检测结果可以看出说明4种引物之间相互不干扰,具有显著特异性。
2.3 PCR检测结果
2.3.1 双重PCR检测结果
经多次调整反应条件,优化反应体系,以2对引物混合为PCR引物,对应的2种不同鳕鱼DNA作为模板,进行PCR扩增。均扩增出相应特异性条带,阴性无条带。见图6。

图6 两重PCR结果Fig.6 Results of double PCR
2.3.2 三重PCR结果
经多次调整反应条件,优化反应体系,以3对引物混合为PCR引物,对应的3种不同鳕鱼DNA作为模板,进行PCR扩增。均扩增出相应特异性条带,阴性无条带。见图7。
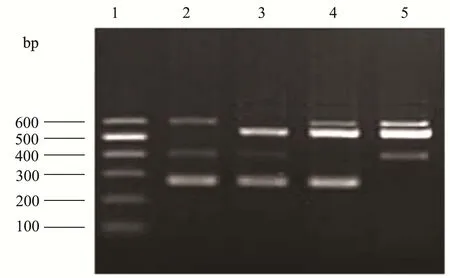
图7 三重PCR结果Fig.7 Triple PCR results
2.3.3 四重PCR结果
经多次调整反应条件,优化反应体系,以四对引物混合为PCR引物,对应的4种不同鳕鱼DNA作为模板,进行PCR扩增。均扩增出相应特异性条带,阴性无条带。见图8。
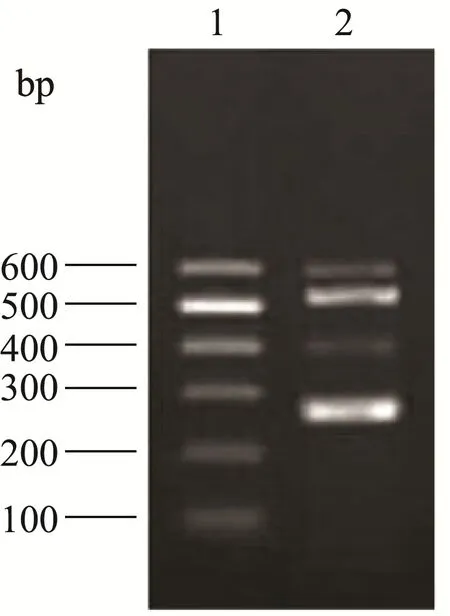
图8 四重PCR结果Fig.8 Quadruple PCR results
多重PCR的原理是在同一PCR反应体系里加上两对以上引物,同时扩增出2个以上核酸片段的PCR反应。以多重PCR为基础的成分鉴别技术具有仪器设备简单、检测通量高、操作方便且检测费用低的优点,但由于需要在同一PCR体系里加入多对特异性物,复杂的PCR体系易造成引物之间相互干扰、灵敏度降低以及对序列扩增效率差异,从而使得相关方法的使用和标准化受到极大限制。有研究报道,多重PCR多采用了正向引物通用、反向引物特异的UP-M-PCR设计策略,即应用包含1条上游或下游引物通用引物,其他3~4条差异引物的原则,最大限度地避免引物数量过多造成的交叉干扰[13-15]。目前,通用引物多重PCR方法对食品中大肠杆菌、单增李斯特菌、耶尔森氏菌、沙门氏菌及水中脊髓灰质炎病毒、柯萨奇B组病毒和埃可病毒等肠道病毒的检测已有报道[16-20]。但由于鳕鱼种属之间基因序列差异较小,差异位点挑选困难,梯度差异合适的序列更少,以通用引物法很难找到合适的多重引物,因此本文设计多条配对引物法进行多重PCR检测。结果发现,引物之间干扰较小,基本不影响PCR扩增效率。
2.3.4 四重PCR灵敏度结果
四种鳕鱼DNA梯度稀释,以100 ng/μL、20 ng/μL、4 ng/μL、0.8 ng/μL,4个浓度梯度的混合样品 DNA进行PCR扩增,100 ng/μL、20 ng/μL浓度有明显特异性条带出现,4 ng/μL浓度出现条带丢失现象,0.8 ng/μL无明显条带出现,见图9。
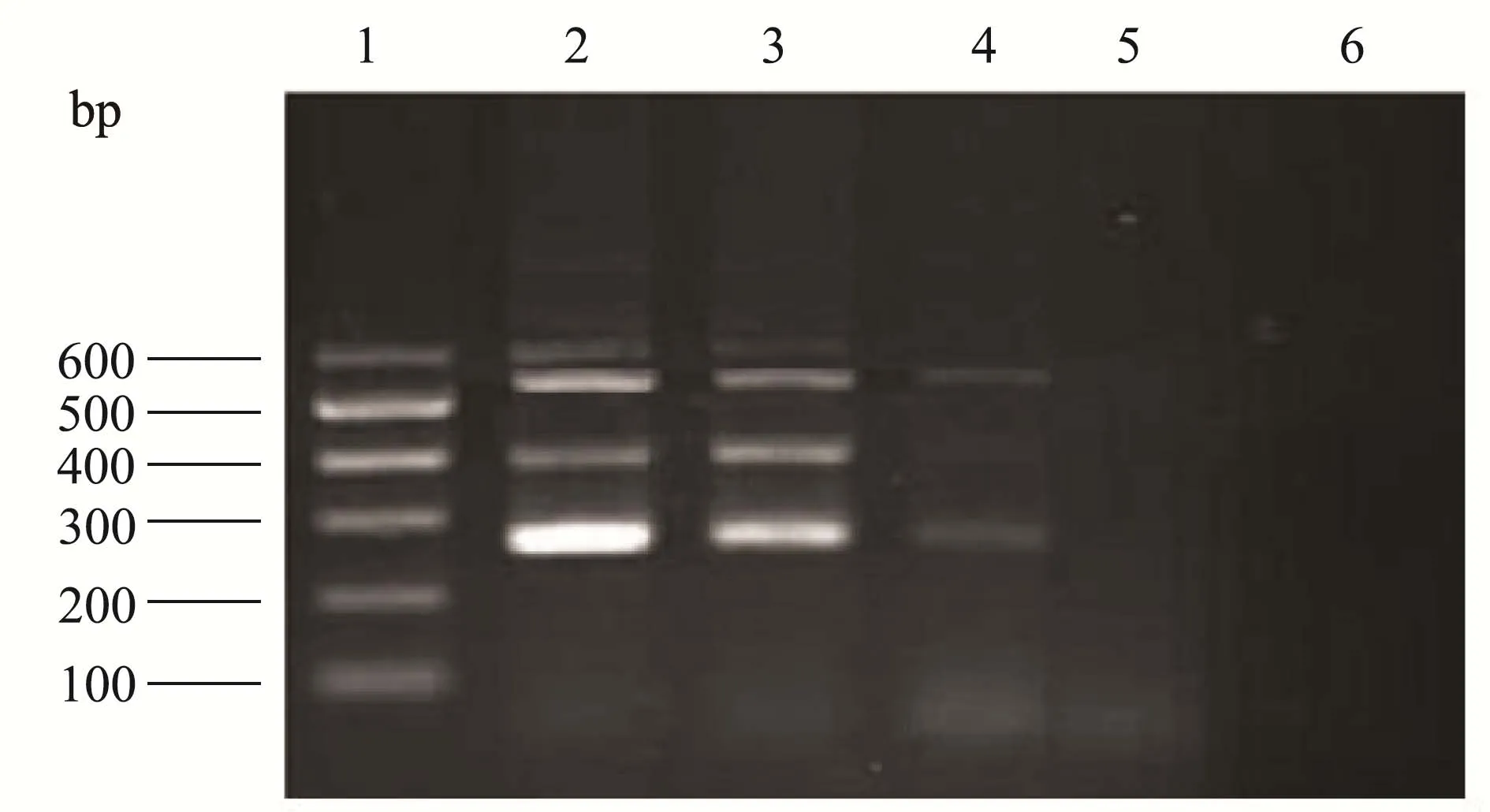
图9 四重PCR灵敏度结果Fig.9 Four-fold PCR sensitivity results
多重PCR检测结果表明,大西洋鳕、绿青鳕、太平洋鳕和狭鳕四种鳕鱼分别出现597、392、266、527 bp大小的清晰条带。该方法具有较高灵敏度,低至4 ng/μL混合样品仍可检出。
本研究主要针对鳕鱼市场以次充好现状进行试验设计,具有较显著的现实意义和应用价值;万超建立的TaqMan荧光PCR方法可以快速检测太平洋鳕鱼源性成分,但该方法仅是针对一种鳕鱼的鉴定[21];林霖等研究设计了可用于细鳞壮鳕DNA成分检测的实时荧光PCR法[22];李富威等建立了鳕鱼成分的实时荧光PCR检测方法,该方法可作为鳕鱼成分鉴定的检测方法,但不能具体分析鳕鱼的种[23]。本研究中可针对四种鳕鱼进行成分鉴定,相比于中国出入境检验检疫标准《SN/T 3589.7-2013》并不能对不同鳕鱼成分进行鉴别[24],本研究具有多重成分检测、检测成本节省、检测通量较高等优点,更适合于对进出口鳕鱼中以次充好、低价鳕鱼冒充高价鳕鱼销售的鉴别筛选。
3 结论
考虑到鳕鱼以次充好销售,往往是以价格较为低廉的蓝鳕、青鳕冒充价格相对较高的真鳕,大西洋鳕和太平洋鳕出售,因此在同一多重PCR反应体系中针对多种鳕鱼同时鉴定方面,本研究重点考察了目标鳕鱼两两混合时的检测特异性。进一步的试验表明,本文建立的多重PCR技术对于同时鉴定目标鳕鱼中的3或4种也具备良好的效果,且具有显著特异性及较高灵敏度,低至4 ng/μL混合样品仍可检出。
