甜菜幼苗对盐胁迫的生理响应及其自噬现象
2021-09-02荆文旭邢旭明史树德
万 雪,荆文旭,魏 磊,邢旭明,史树德
(内蒙古农业大学 农学院,内蒙古 呼和浩特 010019)
盐胁迫是影响作物产量和品质的非生物胁迫因素之一[1]。耐盐作物在适应性进化过程中通过改变自身的外部形态结构与内部的生理代谢机制,如产生可溶性蛋白、脯氨酸等渗透调节物质以增加对逆境的抵抗力与适应性[2]。近年来有研究表明,植物细胞通过自噬作用可以提高对盐碱和干旱等胁迫的抗逆性或耐逆性[3-4],植物体内活性氧(Relieve oxygen species,ROS)参与了自噬的发生和调控[5]。
自噬是真核细胞内大分子物质或受损的细胞器由双层膜结构包裹运至液泡内降解并循环利用的过程[6]。近年来对于植物自噬现象的研究逐渐增多,目前已在水稻[7]、谷子[8]、蜀葵[9]、苹果[10]等多种植物体内发现了自噬现象,研究表明高盐、干旱、重金属等非生物胁迫可诱导植物细胞自噬现象的发生,自噬通过调控ROS代谢参与植物对非生物胁迫逆境的响应[11-12]。细胞自噬作为植物体内的一条蛋白降解途径,帮助植物清除体内受损的蛋白与细胞器,并且其降解效率远高于泛素/26s蛋白酶体途径,故在植物的生长发育、衰老及应对生物、非生物胁迫等多方面均发挥着重要作用[13]。甜菜作为我国北方主要糖料作物,具有较强的耐盐性,适合在轻度或中度盐碱地上种植[14],对当地种植结构调整和区域经济发展具有重要作用[15],但甜菜在盐胁迫条件下体内是否存在自噬现象,及其与甜菜耐盐性是否相关的研究鲜有报道,为此,本研究以耐盐性不同的甜菜品种为研究对象,在不同盐胁迫梯度下,探究了盐胁迫是否可诱导甜菜自噬现象的发生及其与ROS间的响应关系,以及耐盐生理特征差异,旨在为进一步丰富甜菜耐盐机理和筛选盐碱地区耐盐品种提供参考依据。
1 材料和方法
1.1 试验材料
选用甜菜耐盐品种LS2004和盐敏感品种KWS7125为试验材料进行相关试验。
1.2 试验设计及测定方法
1.2.1 甜菜幼苗培养及盐胁迫处理 采用盆栽试验,将盛有蛭石的培养钵(直径10 cm)浇透水后每盆播种9粒甜菜种子。当子叶出土后立即将幼苗放到光照强度为200 μmol/(m2·s)光照培养箱中培养,每天连续光照14 h,昼夜温度分别为25,18 ℃,相对湿度为60%~70%。当甜菜幼苗的第2对真叶完全展开时分别用含有NaCl浓度为100,200,300 mmol/L的Hoagland全营养液浇灌进行盐胁迫处理,以不加NaCl的Hoagland全营养液为空白对照,每个处理浇灌100 mL,3次重复,盐处理7 d后进行相关生理指标测定分析。
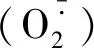
1.3 数据处理
采用Excel 2010进行数据处理及作图,采用SPSS 23.0进行差异显著性分析。
2 结果与分析
2.1 盐胁迫对甜菜自噬现象的诱导
按照盐胁迫处理后的2个材料根尖进行MDC染色处理后,置于激光共聚焦显微镜下观察,发现两甜菜品种的染色部位均通体呈蓝色,并遍布有不同密度与大小的蓝色荧光亮点,1个荧光亮点即为1个自噬体。
由图1,2可看出,随着盐浓度的增强,两品种细胞内荧光亮点增多,同时亮度也加强,表明甜菜有自噬现象的产生,自噬体数量也相应增多,且自噬活性300 mmol/L>200 mmol/L>100 mmol/L>0,即随着盐胁迫强度增大而增强。在各梯度处理下,LS2004的自噬体数分别为3,17,36,106个,且LS2004的自噬体数分别为KWS7125的1.50,1.42,1.57,1.22倍,通过比较可知,在相同处理下耐盐品种LS2004均比盐敏感品种KWS7125产生更多的自噬体;而在300 mmol/L处理下LS2004有大面积亮斑出现,说明虽然两甜菜品种所呈现出的自噬规律相同,但LS2004自噬现象对盐分胁迫所表现出的响应强度均强于KWS7125。综上可知,盐胁迫会诱导甜菜自噬现象的发生,且盐胁迫强度越强自噬活动越强烈;不同品种甜菜表现出不同的响应程度,且耐盐性品种响应程度较强。
2.2 ROS含量对盐胁迫的响应
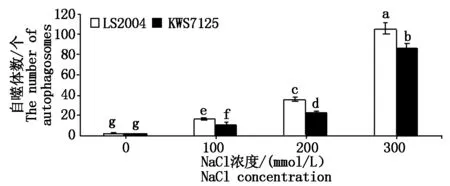
2.2.1 叶片H2O2含量变化 由图3可知,不同盐胁迫处理下,两甜菜品种H2O2含量的变化趋势一致,即随着盐浓度的升高呈现出先升高后降低的趋势。在100 mmol/L盐胁迫处理下,LS2004、KWS7125两甜菜品种H2O2含量分别4.67,4.43 μmol/g,分别较其对照增加了30.81%,36.31%;在200 mmol/L处理下其含量达到峰值,分别为5.00,4.60 μmol/g,分别较其对照增加了40.06%,41.54%;当盐浓度上升到300 mmol/L时,其含量分别为3.88,3.70 μmol/g,虽有所降低但仍高于其对照水平8.68%,13.85%。通过比较两品种差异,LS2004在各处理下H2O2的含量均高于KWS7125,但KWS7125在各处理下的上升幅度均高于LS2004。综合可知,盐胁迫可诱导甜菜叶片内H2O2的大量积累,并与对照达到差异显著水平(P<0.05),但在300 mmol/L处理下LS2004与其对照水平未见显著差异(P>0.05)。

箭头所示为自噬体(标尺=1 mm)。The arrow shows the autophagosome.
不同小写字母表示在0.05水平的差异显著。图3-8同。Different lowercase letters indicate significantdifference at the 0.05 level. The same as Fig.3-8.
图3 NaCl胁迫对甜菜叶片H2O2含量的影响Fig.3 Effects of NaCl stress on H2O2 content in sugar beet leaves
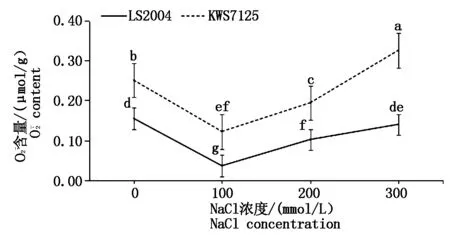
图4 NaCl胁迫对甜菜叶片含量的影响Fig.4 Effects of NaCl stress on content in sugar beet leaves
2.3 盐胁迫下甜菜叶片相对电导率的变化
由图5可知,两品种在不同盐胁迫处理下电导率的变化规律均随着盐胁迫强度增强而升高,除100 mmol/L盐处理下LS2004与其对照无显著差异外,其他各处理之间均表现出显著差异(P<0.05)。但在相同处理下,KWS7125的电导率总是高于LS2004,且LS2004在各NaCl处理下电导率分别为16.31%,21.15%,23.95%,较其对照分别提高了2.90,7.74,10.54百分点;KWS7125在各盐梯度下的电导率分别为21.32%,36.47%,44.97%,较其对照分别提高了7.80,22.95,31.45百分点,可见KWS7125在各处理下的电导率上升幅度均明显高于LS2004,其电导率对盐胁迫的响应敏感程度高于LS2004。
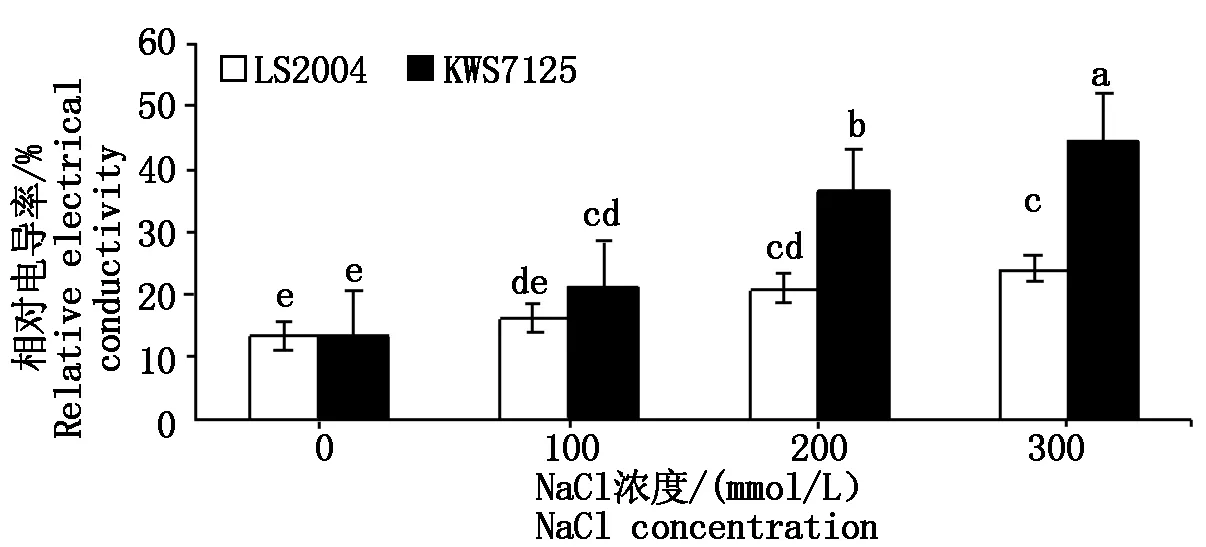
图5 NaCl胁迫对甜菜叶片相对电导率的影响Fig.5 Effects of NaCl stress on relative electrical conductivity in sugar beet leaves
2.4 盐胁迫下甜菜叶片渗透调节物质的变化
2.4.1 可溶性蛋白含量变化 由图6可知,随着盐胁迫强度的增强,叶片内可溶性蛋白含量呈现先升高后降低的趋势,但两甜菜品种出现的峰值位点不同,KWS7125的峰值出现在100 mmol/L NaCl处理下,为8.10 mg/g,较对照显著增加了29.39%(P<0.05);而LS2004峰值出现在200 mmol/L NaCl处理下,为8.90 mg/g,比对照显著增加了31.08%(P<0.05)。此外,当处于300 mmol/L NaCl高浓度盐分水平下,可溶性蛋白含量骤减,LS2004可溶性蛋白含量为6.22 mg/g较其对照减少了30.11%。当甜菜受到盐胁迫时,其体内可溶性蛋白含量会随着盐浓度的升高而逐步积累,但LS2004的可溶性蛋白积累速度高于KWS7125,说明 LS2004的可溶性蛋白在渗透调节方面的作用更强。
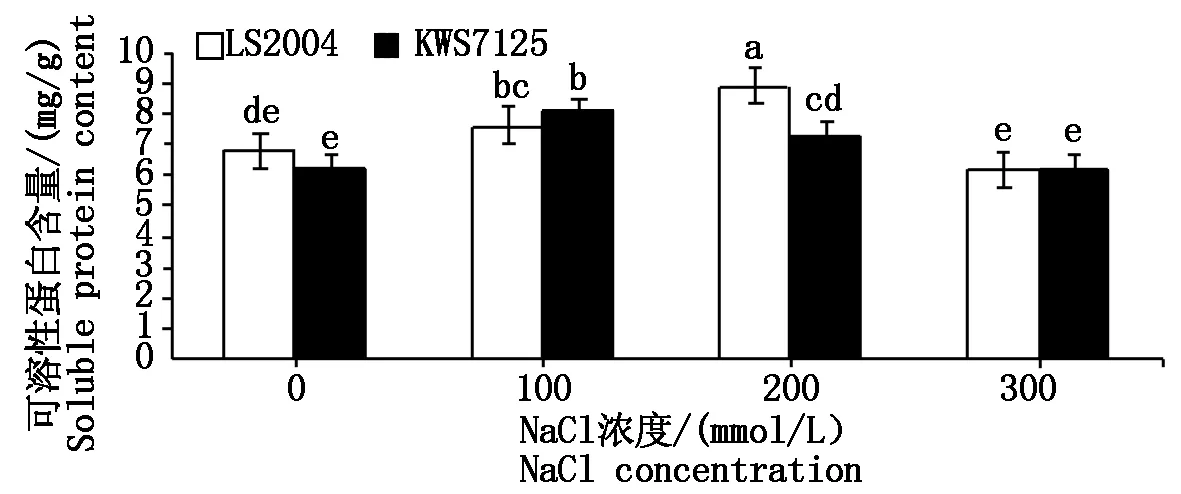
图6 NaCl胁迫对甜菜叶片可溶性蛋白含量的影响Fig.6 Effects of NaCl stress on soluble protein content in sugar beet leaves
2.4.2 脯氨酸含量的变化 由图7可知,随着盐浓度的升高,两品种表现出不同的变化规律。LS2004叶片内脯氨酸含量随着盐浓度的升高呈现先升高后降低的趋势,在100 mmol/L盐处理下脯氨酸含量最高,峰值为548.33 μg/g,显著高于对照水平(P<0.05),300 mmol/L盐处理下含量最低,仅为181.08 μg/g,且各处理之间差异显著(P<0.05);而KWS7125叶片内脯氨酸含量随着盐浓度的升高一直呈现降低趋势,与对照相比分别降低了45.00%,47.42%,54.94%。此外,各个处理下LS2004的脯氨酸含量均高于KWS7125。
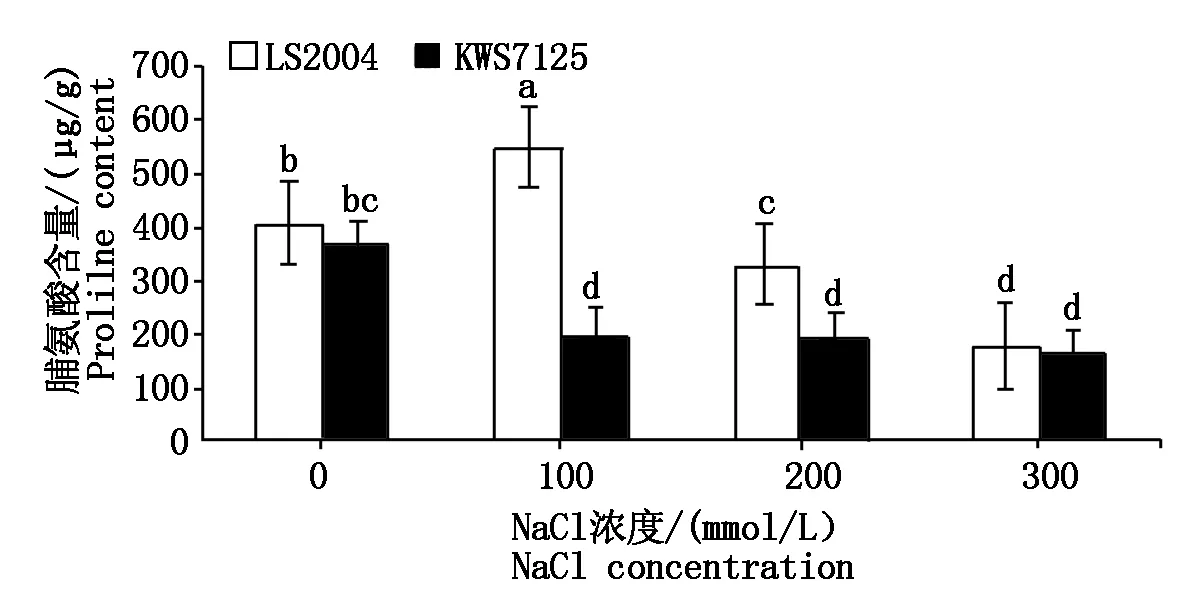
图7 NaCl胁迫对甜菜叶片脯氨酸含量的影响Fig.7 Effects of NaCl stress on proline content in sugar beet leaves
2.4.3 可溶性总糖含量的变化 由图8可知,在不同盐浓度胁迫下,品种间甜菜叶片内可溶性总糖含量呈现不同的变化规律,LS2004可溶性总糖含量随着盐浓度的升高呈现先增加后降低的趋势,最大值出现在200 mmol/L NaCl处理下,为13.68 mg/g;KWS7125可溶性总糖含量则随着盐浓度的升高呈现逐渐降低趋势,对照可溶性总糖含量显著高于其他处理(P<0.05)。各处理下LS2004的可溶性总糖含量均高于KWS7125,间接说明LS2004的耐盐性强于KWS7125。
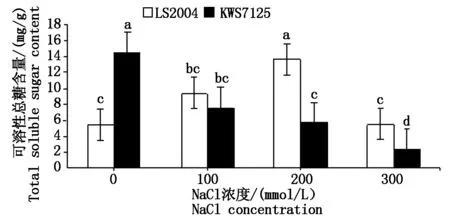
图8 NaCl胁迫对甜菜叶片可溶性总糖含量的影响Fig.8 Effects of NaCl stress on total soluble sugar content in sugar beet leaves
3 讨论与结论
盐胁迫是制约植株正常生长发育常见的非生物胁迫因素之一[21],而植物耐盐性与渗透调节、气孔运动、离子毒害和养分分配等诸多生理过程有着密切的联系[22]。低盐胁迫可通过自噬来缓解盐害损伤来减轻细胞受损程度,但在高盐胁迫下自噬过度发生,会引起自噬性细胞死亡,从而抑制甜菜生长。本试验研究结果表明,甜菜在受到盐胁迫后通过改变生理生化代谢,来抵抗与适应逆境,并且随着盐浓度的增加,整体表现为低促高抑的效果,但不同耐盐特性的品种出现的拐点浓度不同。
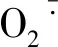
ROS还可能作为信号分子参与了渗透调节物质的积累[29-30],有研究表明ROS可抑制细胞内糖的利用,增加细胞内可溶性总糖含量,以帮助植株抵抗逆境的发生[31]。而本研究也表明,随着ROS的增多可溶性总糖等渗透调节物质含量随之增加,推测ROS与自噬间的作用也可能增加了可溶性蛋白、可溶性总糖等含量,协调应对盐胁迫环境。此外,高浓度盐胁迫下ROS积累到一定阈值后,启动膜脂过氧化反应,破坏膜结构的完整性与稳定性,细胞电解质外渗,相对电导率增强[32]。另一方面,随着根部自噬过程的增强,细胞渗透势的提高,植株对水盐吸收得到改善,进而提高植株整体耐盐能力,但品种间耐盐性存在遗传上的差异。
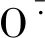
近年来,自噬逐渐成为植物科学领域研究的热点,并且在相关基因鉴定、分子标记与超微结构分析等多方面均取得了突破性的进展。本研究揭示了甜菜耐盐机制中存在自噬与ROS调控过程,但由于盐胁迫诱导甜菜细胞自噬的发生与调控机制及其与ROS的作用关系是植株体内多条代谢途径共同作用的结果,所以对于其耐盐机理还需进一步在分子水平上进行多组学方面的探索。
