玉米大斑病菌StRTG2基因结构、原核表达及表达模式分析
2021-09-02李默晓周启慧刘玉卫巩校东谷守芹韩建民
李默晓,卞 哲,周启慧,刘玉卫,巩校东,谷守芹,韩建民
(河北农业大学 生命科学学院,河北省植物生理与分子病理学重点实验室,河北 保定 071001)
玉米大斑病是由病原真菌引起的玉米叶部病害,受病菌侵染后植株叶片先出现水渍状斑点,之后沿叶脉向两端扩展形成典型梭状病斑,严重影响叶片光合作用[1-3]。其致病真菌为玉米大斑病菌(Setosphaeriaturcica),在高湿度及中等温度条件下发生,感病品种严重感染时可致作物减产达50%以上,甚至绝收[4]。由于玉米大斑病菌变异频繁,导致玉米大斑病的发病呈逐年上升的趋势。因此,从分子水平上解析玉米大斑病菌生长发育及致病的分子机理已经成为该病害综合防治的基础研究之一。
前人研究表明,酿酒酵母(Saccharomycescerevisiae)线粒体在细胞衰老过程中扮演重要角色,线粒体通过产生活性氧导致细胞衰老[5]。然而,线粒体在衰老过程中的作用远不止于此,在衰老过程中积累的线粒体功能障碍引发逆行反应,这种细胞内信号通路可激活弥补这种功能障碍的基因[6],而ScRtg2蛋白是线粒体逆行信号通路中的关键蛋白[7-8]。研究表明,酸胁迫通过Hog1激活触发对乙酸诱导的调节细胞死亡的抗性,这需要酵母中的ScRtg2蛋白,且这个过程是独立于依赖Rtg1/3的线粒体逆行信号通路的[9]。酵母中存在从线粒体到细胞核的通讯路径,这个途径需要2个酵母基因ScRTG1和ScRTG2[10-11]。迄今为止,关于玉米大斑病菌中RTG2同源基因功能的研究未见报道。
河北省植物生理及分子病理学重点实验室前期研究发现,在玉米大斑病菌中存在3条MAPK(Mitogen activated protein kinase)通路[12],其中HOG-MAPK途径与调控植物病原真菌应对高渗胁迫相关,而StHOG1基因是该途径的关键基因[13-14]。进一步的研究发现,该途径关键基因StHOG1通过StRTG1/3间接调控转录因子StMSN2。本研究拟在玉米大斑病菌数据库中搜索RTG2-like基因StRTG2的DNA基因组序列和cDNA序列,利用生物信息学分析其基因结构以及蛋白空间结构特征;构建该基因原核表达载体,在大肠杆菌BL21中进行StRTG2基因的原核表达;同时分析病菌5个重要发育时期(菌丝、分生孢子、芽管、附着胞和侵入钉)的RNA-Seq基因组数据库,明确该基因的表达模式。该研究可为进一步分析StRTG2基因的功能以及其与StHOG1的互作关系奠定基础。
1 材料和方法
1.1 试验材料及试剂
玉米大斑病菌野生型菌株01-23由河北省植物生理与分子病理学重点实验室保存。高保真PCR Mix(诺维赞2×Rapid Taq Master Mix)、克隆载体pMD-19T、小型质粒提取试剂盒(Plasmid Mini Kit Ⅰ,OMEGA bio-tek)T4-DNA Ligase、限制性内切酶(QuickCutKPNⅠ,EcoR Ⅰ,TaKaRa)、大肠杆菌感受态(DH5α)、大肠杆菌感受态(BL21)、琼脂糖凝胶回收试剂盒购自北京全式金生物科技公司;EasyPure Quick Gel Extraction Kit、A0120-便捷型植物RNA快速提取试剂盒购自天津华力科析科技有限公司;反转录试剂盒M5 Superpius qPCR RT with gDNA removor购自北京聚合美生物技术有限公司;Blue Plus V Protein Marker购自北京全式金生物技术有限公司;引物合成及测序均由生工生物工程(上海)股份有限公司完成。
1.2 玉米大斑病菌StRTG2的鉴定
利用酵母基因组数据库SGD(https://www.yeastgenome.org/)查找ScRtg2氨基酸序列;在玉米大斑病菌基因数据库JGI(https://mycocosm.jgi.doe.gov/)中进行BlastP,搜索其同源的氨基酸序列及其蛋白ID,在JGI中搜索蛋白ID获得DNA及cDNA序列。根据其序列设计两端引物(StRTG2-F:ATGGTTACGACAAACGAGTCACGACACC;StRGT2-R:TCACTCGGAGCCGTATGCCTCGCCATTCA)。分别以玉米大斑病菌01-23的全基因DNA以及cDNA为模板,利用高保真MIX进行PCR扩增,扩增体系为引物StRTG2-F、StRGT2-R各2 μL,2×Rapid Taq Master Mix 25 μL,cDNA/DNA 2 μL,ddH2O 19 μL。PCR反应条件为95 ℃预变性5 min;94 ℃ 30 s,58 ℃ 40 s,72 ℃ 2min,共35个循环;72 ℃ 10 min,16 ℃保存。扩增结束后进行琼脂糖凝胶电泳,在照胶仪下进行比对观察。
1.3 玉米大斑病菌StRTG2结构分析及系统发育分析
使用ProtParam(http://web.expasy.org/protparam)预测蛋白理化性质,利用Prab(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=/NPSA/npsa_hnn.html)预测蛋白的二级结构,利用SWISS-MODEL(https://swissmodel.expasy.org/interactive)预测蛋白的三级结构[15-16]。利用在线网站HMMER (https://www.ebi.ac.uk/Tools/hmmer/)分析StRtg2的功能结构域。利用MEGA 7.0建立不同物种中的RTG2的系统进化树[17]。
1.4 玉米大斑病菌不同发育时期材料的收集及RNA-Seq数据分析
选取玉米大斑病菌5个典型的发育时期(菌丝、分生孢子、芽管、附着胞、侵入钉),分别采用如下方法收集材料。菌丝时期:选取在PDA上25 ℃黑暗培养7 d左右的野生型菌株,用去尖蓝枪头倾斜刮取菌丝体。分生孢子时期:选取PDA上25 ℃黑暗培养15 d左右的玉米大斑病菌,用棉签刮去其气生菌丝,将剩余基生菌丝继续培养3 d,加入8 mL左右无菌水,小心晃动使ddH2O覆盖整个皿面后,收集分生孢子悬浮液,12 000 r/min离心,获得分生孢子。芽管、附着胞及侵入钉时期:在覆盖有玻璃纸的水琼脂培养基上加入分生孢子悬浮液后黑暗培养4 h后收集芽管,10 h后收集附着胞;16 h后收集侵入钉。以上试验样品需要设置3次重复。将以上材料送至北京诺禾致源生物信息科技有限公司进行RNA-Seq分析。利用本实验室获得的玉米大斑病菌RNA-Seq数据库,分析StRTG2在不同发育时期的表达模式。
1.5 玉米大斑病菌StRTG2在大肠杆菌BL21(DE3)中的原核表达
以玉米大斑病菌野生型01-23 cDNA序列为模板,设计引物进行PCR扩增(StRtg2-L:GGTACCATGGTTACGACAAACGAGTCACGACACCTGCA;StRtg2-R:GAATTCTCACTCGGAGCCGTATGCCTCGCCATTCACCGTCAC),下划线部分分别为限制性内切酶KPNⅠ和EcoRⅠ的内切酶识别部位。回收包含目的片段的琼脂糖凝胶进行胶回收后,将回收产物连接至pMD19-T转化入大肠杆菌感受态DH5α,利用氨苄抗性筛选后,挑取单克隆菌落进行菌液PCR,将条带正确的菌液送至生工进行测序。用两端限制性内切酶KPNⅠ和EcoRⅠ将测序正确的片段从pMD19-T酶切下来并用T4-连接酶连接至原核表达载体pET-30a上,将连接产物转化至大肠杆菌DH5α中,利用卡那霉素抗性进行筛选。利用PCR验证阳性菌落,将正确连接的质粒命名为pET30a-StRTG2,提取质粒对其进行酶切验证。
将质粒pET30a-StRTG2转化进入BL21感受态细胞中,加入LB培养基后37 ℃、220 r/min振荡培养2~3 h,将菌液均匀涂布于LB固体培养基上(100 μg/mL的卡那霉素),37 ℃过夜培养12 h,挑取阳性单克隆菌落,转接于30 mL液体LB培养基中,37 ℃、220 r/min 振荡培养12 h,作为种子液保存至4 ℃。取20 μL种子液于20 mL 2×YT培养基中,37 ℃、220 r/min 振荡培养至波长在600 nm的吸光度值为0.6左右,加入IPTG至终浓度为1 mol/L,37 ℃继续诱导培养6 h[18]。分别取1 mL诱导及未诱导的菌液于1.5 mL Ep管中,13 000 r/min离心10 min,保留沉淀。将沉淀用150 mL水重悬后吸取24 μL菌体于新Ep管,加入6 μL的5×上样Buffer。混匀后将样品沸水浴10 min,11 000 r/min离心10 min后,吸取上清,加入点样孔内,利用SDS-PAGE胶进行电泳检测。
2 结果与分析
2.1 玉米大斑病菌StRTG2基因的克隆
在酿酒酵母基因组数据库中搜索ScRtg2蛋白质序列,将其在玉米大斑病菌数据库(JGI)中进行BlastP,得到了1个ScRtg2的同源序列,其蛋白ID号为33837;进一步分析发现该基因位于病菌基因正链scaffold_5的1 994 979-1 996 673位置,将该基因命名为StRTG2。 分别以玉米大斑病菌的DNA、cDNA为模板进行PCR扩增,得到了长度约为1 700 bp的扩增片段(图1),结果符合预期。将两片段琼脂糖凝胶进行回收,送至公司进行测序,发现其DNA、cDNA全长均为1 695 bp,不含有内含子。

M.DNA Marker (100~5 000 bp);图A中泳道1、2、3均为StRTG2基因以玉米大斑病菌野生型01-23的DNA为模板进行扩增的产物;图B中泳道1、2、3均为StRTG2基因以玉米大斑病菌野生型01-23 cDNA序列为模板进行扩增的产物。
2.2 玉米大斑病菌StRtg2的理化性质、亚细胞定位及其高级结构分析
生物信息学分析表明,StRTG2基因所编码的蛋白由564个氨基酸组成,其相对分子质量为62.069 44 ku,理论等电点值(pI)是6.96。在编码的氨基酸中,丙氨酸(Ala)含量最高,所占比例是9.4%;其中带负电的残基数量为59,带正电的残基数量为58。结果还显示,该蛋白不稳定系数(Ⅱ)为37.15,由此推测其为稳定蛋白。该蛋白亲水系数为-0.205,说明该蛋白为亲水性蛋白。跨膜结构域预测表明,该蛋白1-564位氨基酸均位于细胞膜外,属于非跨膜蛋白。对其亚细胞定位预测,发现在27个最邻近成员中,细胞质、细胞核、线粒体、过氧化物酶体中均有分布,根据结果分析得到,该蛋白分布于细胞质中的可能性比较大。
对StRtg2的二级结构进行预测,发现该蛋白的237个氨基酸构成α螺旋结构,占比为45.02%;81个氨基酸构成延伸链,占比为14.36%;246个氨基酸构成无规则卷曲,占比为43.62%。对其结构域分析,发现StRtg2蛋白中的25-342位氨基酸构成Ppx-Gppa结构域,358-368位氨基酸和489-500位氨基酸形成低复杂区域。对StRtg2的功能结构域分析,结果显示,StRtg2具有典型的Ppx-Gppa保守结构域(即结构域),该家族由外切磷酸酶(Ppx)的N末端以及EC:3.6.1.11和鸟苷五磷酸磷酸水解酶(GppA)EC:3.6.1.40组成(图2)。

图2 StRtg2功能结构域分析Fig.2 Functional domain analysis of StRtg2
对StRtg2的三级结构进行分析,得到StRtg2的三维空间模型,结果显示,α螺旋与无规卷曲结构是三级结构中的主要组成部分,这与二级结构预测结果相符(图3)。
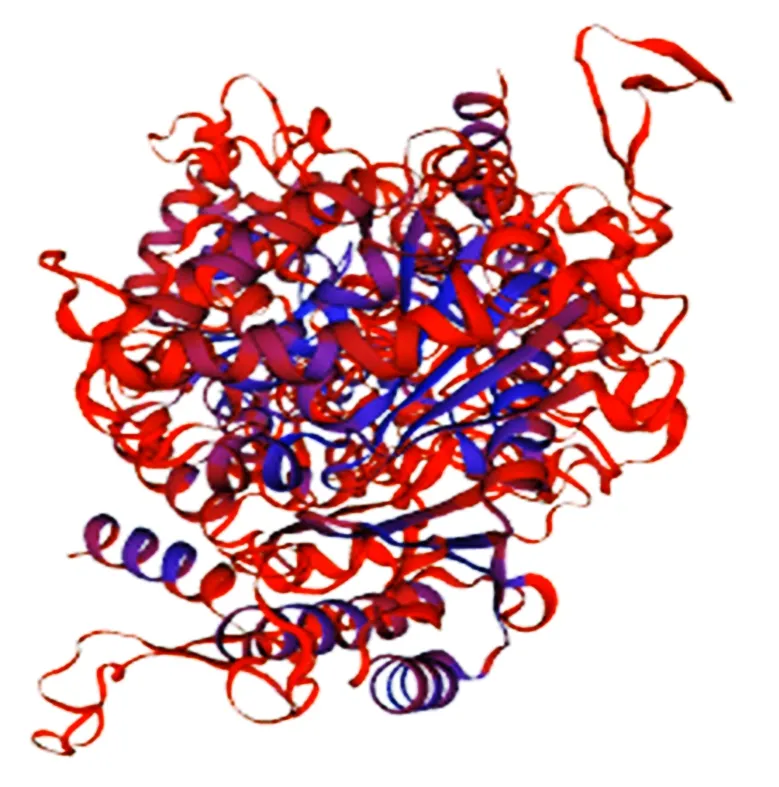
图3 StRtg2 三级结构预测Fig.3 Three dimensional structure prediction of StRtg2
2.3 玉米大斑病菌StRTG2基因进化关系分析
为进一步研究玉米大斑病菌与其他物种间的进化关系,对该基因蛋白序列进行BlastP,基于其他真菌物种中的氨基酸序列,利用MEGA 7.0邻近法进行系统发育树分析。分析结果表明,玉米大斑病菌与番茄匍柄霉菌(Stemphyliumlycopersici)的RTG2基因间的进化关系最近,其次是与酿酒酵母间的进化关系较近(图4)。

图4 RTG2系统进化分析Fig.4 Phylogenetic tree analysis of RTG2
2.4 玉米大斑病菌StRTG2在大肠杆菌BL21(DE3)中的原核表达
首先构建了StRTG2的原核表达载体,将目的基因连接终载后转入大肠杆菌DH5α感受态细胞,进行菌液PCR后,可以观测到清晰的长度为1 600 bp左右的条带,表明片段连接成功。将终载转入BL21中,转化后进行PCR检测,也可观察到1 600 bp左右的片段(图5-A),用限制性内切酶KPNⅠ/EcoRⅠ对载体进行酶切验证。进行琼脂糖凝胶电泳检测,检测到清晰的目的大小片段的条带(图5-B),说明原核表达载体构建成功。

A.pET30A-StRTG2载体转化至BL21菌液PCR验证;B.终载pET30a-StRTG2,KPN Ⅰ/EcoR Ⅰ酶切验证图。A. PCR diagram of pET30a-StRTG2 transferred into BL21;B. KPN Ⅰ/EcoR Ⅰ enzymatic verification of pET30A-StRTG2.
对诱导及未诱导菌液处理后进行SDS-PAGE电泳,结果显示,IPTG诱导的重组菌在70 ku左右的位置出现条带(图6),而生物信息学预测StRtg2蛋白约62 ku左右。说明StRTG2原核表达成功。
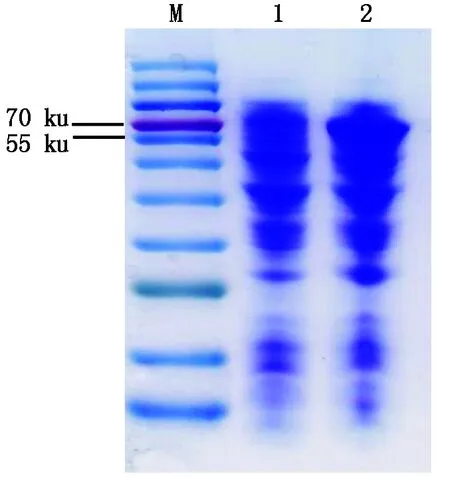
图6 StRTG2基因的原核表达Fig.6 Prokaryotic expression of StRTG2
2.5 玉米大斑病菌StRTG2不同发育时期的表达模式分析
基因表达模式的分析可对基因功能研究起重要作用,为进一步探索StRTG2的功能,利用RNA-Seq数据分析了该基因在菌丝、分生孢子、芽管、附着胞和侵入钉时期5个典型的发育时期的表达模式。结果发现,StRTG2在上述5个时期均有不同水平的表达。与菌丝时期相比,分生孢子、芽管、附着胞、侵入钉时期表达量分别为菌丝时期的1.02,0.51,1.05,0.73倍,结果说明,StRTG2在附着胞时期表达量最高,在芽管时期最低(图7),即该基因在玉米大斑病菌5个典型的发育阶段虽有差异,但均有表达。说明StRTG2基因参与病菌生长发育的调控过程。

图7 StRTG2在不同发育时期的表达模式分析Fig.7 Expression patterns analysis of StRTG2 in different developmental stages
3 讨论与结论
已有研究表明,ScRTG2基因参与酵母的线粒体逆行信号通路并且该基因表达水平影响细胞寿命[19];在烟曲霉相关研究中表明,给分生孢子提供含有营养的培养条件后,RTG2同源基因表达受抑制,表明该基因可能在调控病菌分生孢子休眠状态过程发挥作用[20];本研究首次扩增玉米大斑病菌中StRTG2基因并对StRtg2蛋白进行保守结构域及系统进化分析,结果表明,StRtg2蛋白与酿酒酵母ScRtg2蛋白亲缘关系较近,也含有保守的Ppx-Gppa结构域,推测该基因所编码的蛋白在玉米大斑病菌中也可能具有磷酸水解酶活性。
另有文献表明,酵母在抵抗由乙酸诱导的调节性细胞死亡的过程中RTG2与HOG1间可能有直接调控作用[8],本实验室前期研究结果显示,StHOG1对StRTG3具有调控作用,而RTG复合体又是线粒体逆行信号通路中的关键调控因子。因此,可以推测HOG通路间可能与RTG线粒体逆行信号通路间存在交叉调控[21]。
本研究利用生物信息学技术对StRtg2蛋白进行了结构分析及系统进化分析,诱导表达了StRtg2蛋白,但StRTG2的基因功能及其与HOG-MAPK途径间交叉调控的机制还有待研究。因此,在后续的研究中,应利用基因沉默及过表达技术进一步探究StHOG1基因与StRTG2基因间调控关系,并在蛋白水平验证两者是否互作。明确StRTG2的基因功能及其对病菌致病性的影响,为制备杀真菌药物制剂制备提供理论基础。
本研究通过扩增StRTG2基因序列,发现其全长为1 695 bp,不含有内含子;构建StRTG2的原核表达载体并诱导表达,显示其蛋白大小约70 ku;该基因编码的蛋白为稳定蛋白,含有保守的Ppx-Gppa结构域,定位于细胞质中的可能性较大;该基因在玉米大斑病菌附着胞时期表达水平最高,芽管时期最低,表明该基因可能对病菌附着胞发育过程具有一定调控作用。
