LncRNA FAM225A靶向miR-1-3p基因调控结直肠癌细胞增殖、迁移、侵袭和凋亡
2021-09-01陈文霞刘艳红肖兴国张磊王琳吴慧丽
陈文霞 刘艳红 肖兴国 张磊 王琳 吴慧丽
(郑州大学附属郑州中心医院消化内科,河南 郑州 450007)
结直肠癌(CRC)是消化道常见的恶性肿瘤之一,手术及放化疗虽改善了CRC患者总体存活率,但仍需寻找新的疗效更好的治疗手段,针对CRC发病特点的定点靶向治疗对CRC的治疗和预后具有重要意义〔1,2〕。研究发现LncRNA参与了CRC的发生发展,可为CRC诊断和治疗提供新手段〔3〕。有研究报道LncRNA FAM225A在慢性阻塞性肺疾病患者中表达上调〔4〕。FAM225A在胃癌细胞中也高表达,与胃癌的发生发展可能相关〔5〕。然而FAM225A在CRC中的表达及其对CRC细胞增殖、迁移、侵袭和凋亡的影响也尚未清楚。研究发现miRNA也与CRC进展有关〔6〕。有报道发现miR-1-3p在CRC中显著下调,且可能通过多种生物学方法抑制CRC〔7〕。上调miR-1-3p抑制膀胱癌细胞的增殖,迁移和侵袭〔8〕。过表达miR-1-3p靶向抑制脑源性神经营养因子(BDNF)的表达,抑制酪氨酸激酶B(TrkB)的磷酸化从而抑制人滋养细胞增殖和侵袭〔9〕。然而miR-1-3p对CRC细胞增殖、迁移、侵袭和凋亡的影响及FAM225A是否通过miR-1-3p影响CRC的生物学行为还尚未清楚。本研究旨在探讨FAM225A和miR-1-3p对CRC细胞增殖、迁移、侵袭和凋亡的影响及FAM225A是否通过miR-1-3p影响CRC的生物学行为。
1 材料与方法
1.1材料 正常人胚胎结肠细胞FHC和CRC细胞株SW480、HCT116购自美国菌种保藏中心(ATCC)。RPMI1640培养基购自美国Gibco公司;荧光定量试剂盒购自日本TaKaRa;四甲基偶氮唑蓝(MTT)比色法试剂盒、凋亡检测试剂盒购自日本同仁研究所;蛋白裂解液购自上海碧云天;兔抗人细胞周期蛋白(Cyclin)D1多克隆抗体、兔抗人裂解半胱氨酸天冬氨酸蛋白酶(caspase)-3多克隆抗体、兔抗人基质金属蛋白酶(MMP)-2多克隆抗体、兔抗人MMP-9多克隆抗体、兔抗人β-actin多克隆抗体和山羊抗兔IgG-辣根过氧化物酶(HRP)购自艾美捷科技有限公司;Transwell小室、基质胶购自美国BD公司;双荧光素酶报告基因检测试剂盒购自美国AAT Bioquest。si-NC、si-FAM225A、miR-NC、miR-1-3p、pcDNA-NC、pcDNA-FAM225A、anti-miR-NC、anti-miR-1-3p载体质粒购自北京普瑞金科技有限公司。
1.2方法
1.2.1细胞培养与分组 正常人胚胎结肠细胞FHC和CRC细胞SW480、HCT116用RPMI1640培养基常规培养;取对数生长期细胞SW480、HCT116,将FAM225A干扰表达载体及阴性对照、miR-1-3p模拟物及阴性对照分别转染至SW480、HCT116细胞中,记为si-FAM225A组、si-NC组、miR-1-3p组、miR-NC组;将FAM225A干扰表达载体分别与miR-1-3p抑制剂及阴性对照共转染至SW480、HCT116细胞中,记为si-FAM225A+anti-miR-1-3p组、si-FAM225A+anti-miR-NC组;正常培养的细胞作为空白对照(control)组。
1.2.2实时荧光定量聚合酶链反应(qRT-PCR)检测FAM225A和miR-1-3p表达水平 收集细胞,提取总RNA,合成cDNA后进行PCR,以β-actin和U6为内参,用2-△△Ct法计算相对表达量。FAM225A上游引物:5′-ATATAGTCCTGGGCCCCATC-3′,下游引物:5′-TTCGACACAGGCAGTTTCAC-3′;β-actin上游引物:5′-CTCCATCCTGGCCTCGCTGT-3′,下游引物:5′-GCTGTCACCTTCACCGTTCC-3′;miR-1-3p上游引物:5′-ACACTCCAGGTGGGTGGAATGT-3′;下游引物5′-CTCAACTGGTGTCGTGGAG-3′。U6上游引物:5′-CGCTTCGGCACATATAC-3′,下游引物:5′-TTCACGAATTTGCGTGTCAT-3′。
1.2.3MTT检测细胞存活率 各组细胞培养48 h,按试剂盒说明操作,最后检测490 nm处吸光度(OD)值。将control组存活率设为100%,计算其他各组细胞存活率。
1.2.4克隆形成实验检测细胞生长情况 各组细胞消化后接种于细胞培养板中,培养2 w,当培养皿中出现肉眼可见的克隆时,终止培养。弃去上清液,用4%多聚甲醛固定15 min,加适量Giemsa染色10~30 min,洗去染色液,干燥后在显微镜下计数。
1.2.5流式细胞术检测细胞凋亡 收集各组细胞,按试剂盒说明书操作,上流式细胞仪检测。
1.2.6Western印迹法检测CyclinD1、裂解caspase-3、MMP-2和MMP-9蛋白表达水平 收集各组细胞,提取总蛋白,制备电泳凝胶,进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)(电压80 V,样品进入分离胶后,电压调为150 V,继续电泳1 h),转膜(150 mA,2 h),置于封闭液中室温轻摇1 h;将膜置于含有一抗的杂交袋中,置于摇床上4℃轻摇过夜。膜漂洗3次后置于含二抗的杂交袋中,室温轻摇2 h,显影,漂洗、晾干后拍照,分析蛋白条带灰度值,以β-actin为内参计算蛋白相对表达水平。
1.2.7Transwell检测细胞迁移和侵袭 用无血清培养液重悬各组细胞,取100 μl接种于Transwell上室,下室加含血清培养液,培养48 h,弃去培养液,棉签擦去上层细胞,甲醛固定,加入结晶紫染色30 min,漂洗干燥,显微镜下观察并计数。侵袭:用基质胶包被Transwell上室,其余同迁移实验。
1.2.8荧光素酶报告基因检测实验检测FAM225A对miR-1-3p的靶向调控 将FAM225A野生型和突变型基因靶点荧光素酶表达载体分别与miR-NC和miR-1-3p共转染至SW480、HCT116细胞中。按照说明书进行检测。将si-NC、si-FAM225A、pcDNA-NC、pcDNA-FAM225A分别转染至SW480、HCT116细胞中,用qRT-PCR检测miR-1-3p表达水平。
1.2.9统计学方法 采用SPSS20.00软件进行t检验、单因素方差分析。
2 结 果
2.1CRC细胞和正常人胚胎结肠细胞中FAM225A和miR-1-3p的表达 与正常人胚胎结肠细胞FHC相比,CRC细胞SW480、HCT116中FAM225A表达水平显著升高,miR-1-3p表达水平显著降低(均P<0.05),见表1。可见,CRC细胞中,FAM225A高表达,miR-1-3p低表达。
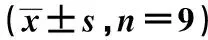
表1 qRT-PCR检测CRC细胞和正常人胚胎结肠细胞中FAM225A和miR-1-3p的表达水平比较
2.2低表达FAM225A基因抑制CRC细胞SW480、HCT116增殖、诱导凋亡 与si-NC组相比,si-FAM225A组CRC细胞SW480、HCT116中FAM225A表达水平显著降低,细胞存活率及CyclinD1表达水平显著降低,克隆形成细胞数目显著减少,细胞凋亡率及裂解caspase-3表达水平显著升高(均P<0.05),见图1、图2、表2、表3、图3。可见,低表达FAM225A抑制CRC细胞增殖、诱导细胞凋亡。
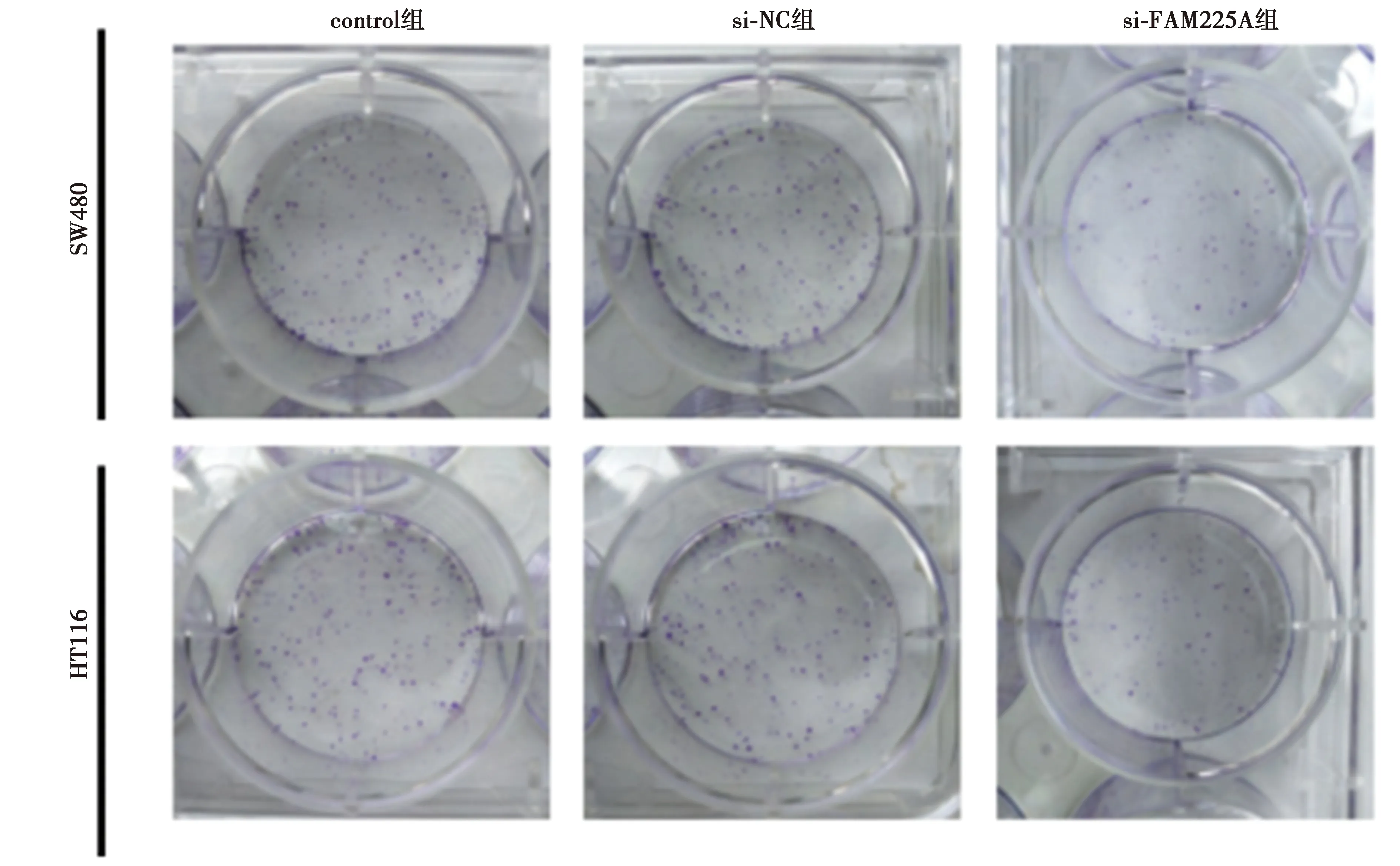
图1 低表达FAM225A后克隆形成实验
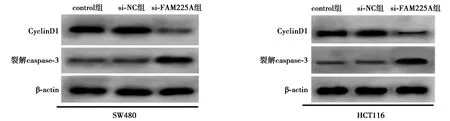
图2 低表达FAM225A后CyclinD1、裂解caspase-3的表达


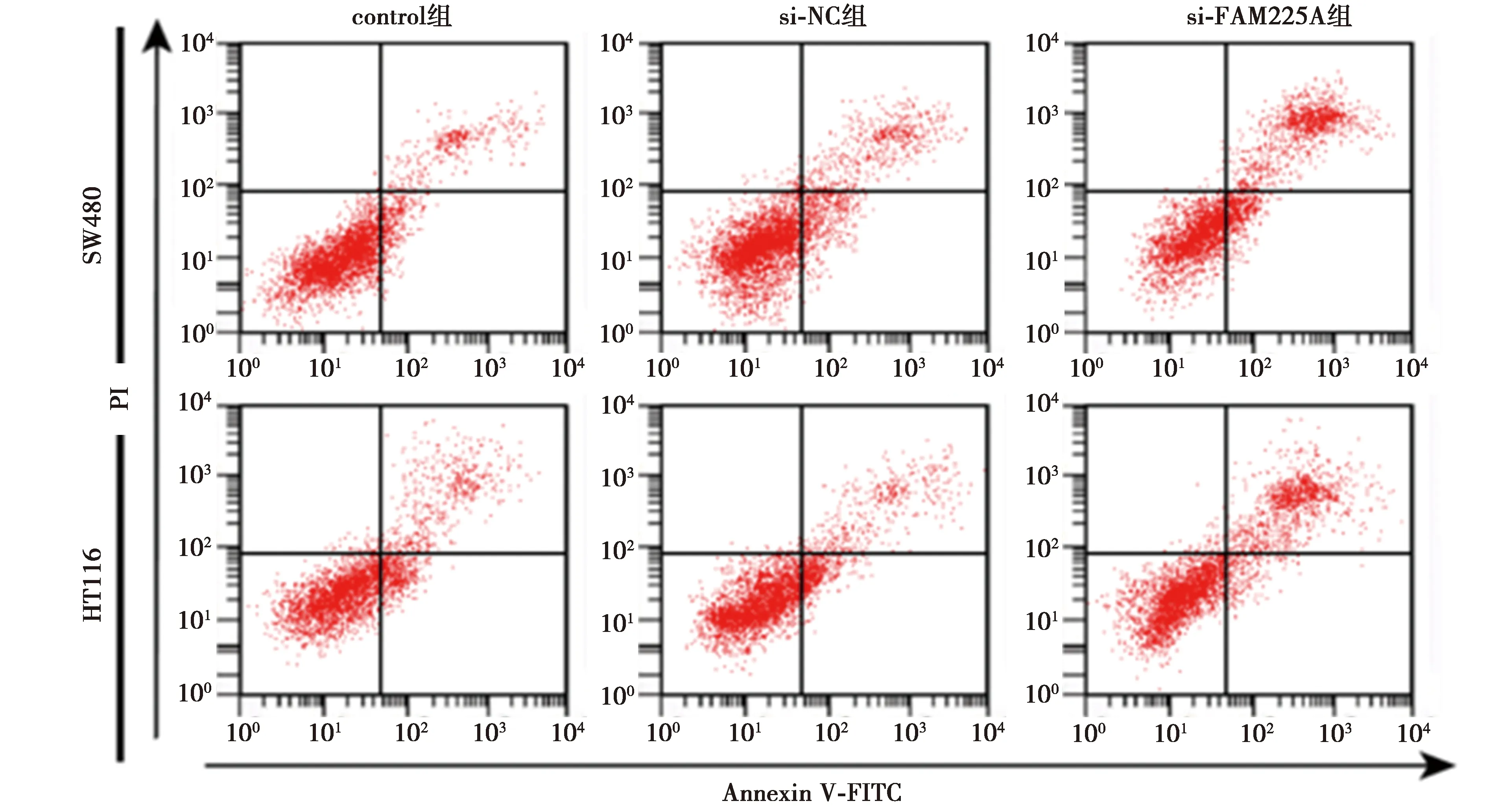
图3 流式细胞仪检测低表达FAM225A后细胞凋亡
2.3低表达FAM225A基因抑制CRC细胞SW480、HCT116迁移和侵袭 与si-NC组相比,si-FAM225A组CRC细胞SW480、HCT116迁移和侵袭数目显著减少,MMP-2、MMP-9表达水平显著降低(均P<0.05),见图4、图5、表4、表5。可见,低表达FAM225A抑制CRC细胞迁移和侵袭。
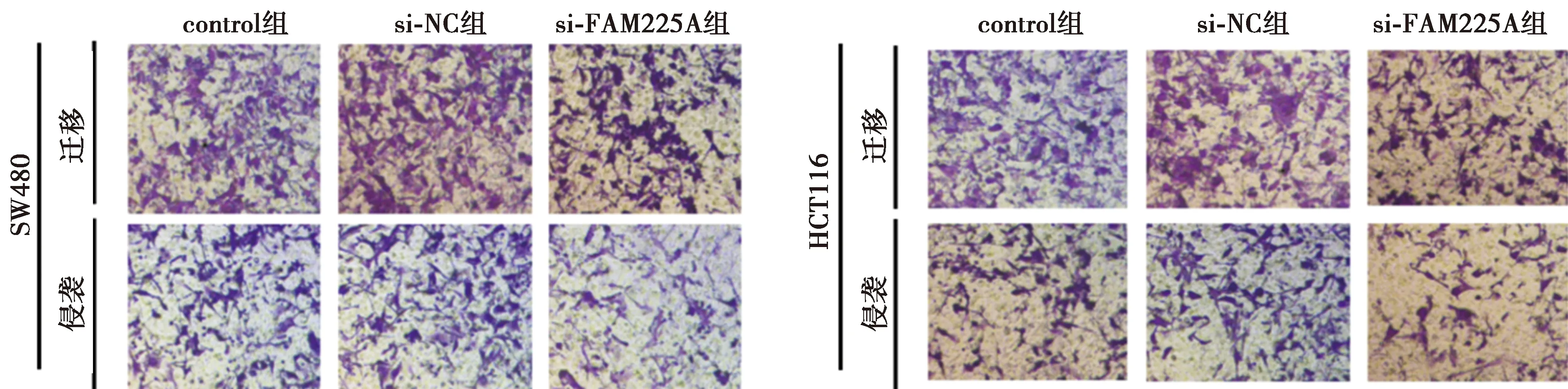
图4 Transwell检测CRC细胞的迁移和侵袭(结晶紫染色,×200)
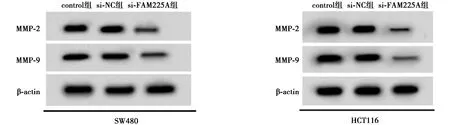
图5 Western印迹检测MMP-2和MMP-9蛋白表达量
表4 低表达FAM225A抑制CRC细胞SW480的迁移、侵袭
表5 低表达FAM225A抑制CRC细胞HCT116的迁移、侵袭
2.4miR-1-3p高表达抑制SW480、HCT116细胞增殖、迁移、侵袭和凋亡 与miR-NC组相比,miR-1-3p组miR-1-3p表达水平显著升高,细胞存活率及CyclinD1、MMP-2、MMP-9表达水平显著降低,克隆形成细胞数目及迁移和侵袭数目均显著减少,细胞凋亡率及裂解caspase-3表达水平显著升高(均P<0.05),见图6~9,表6、表7。可见,miR-1-3p高表达抑制SW480、HCT116细胞增殖、迁移、侵袭,诱导细胞凋亡。
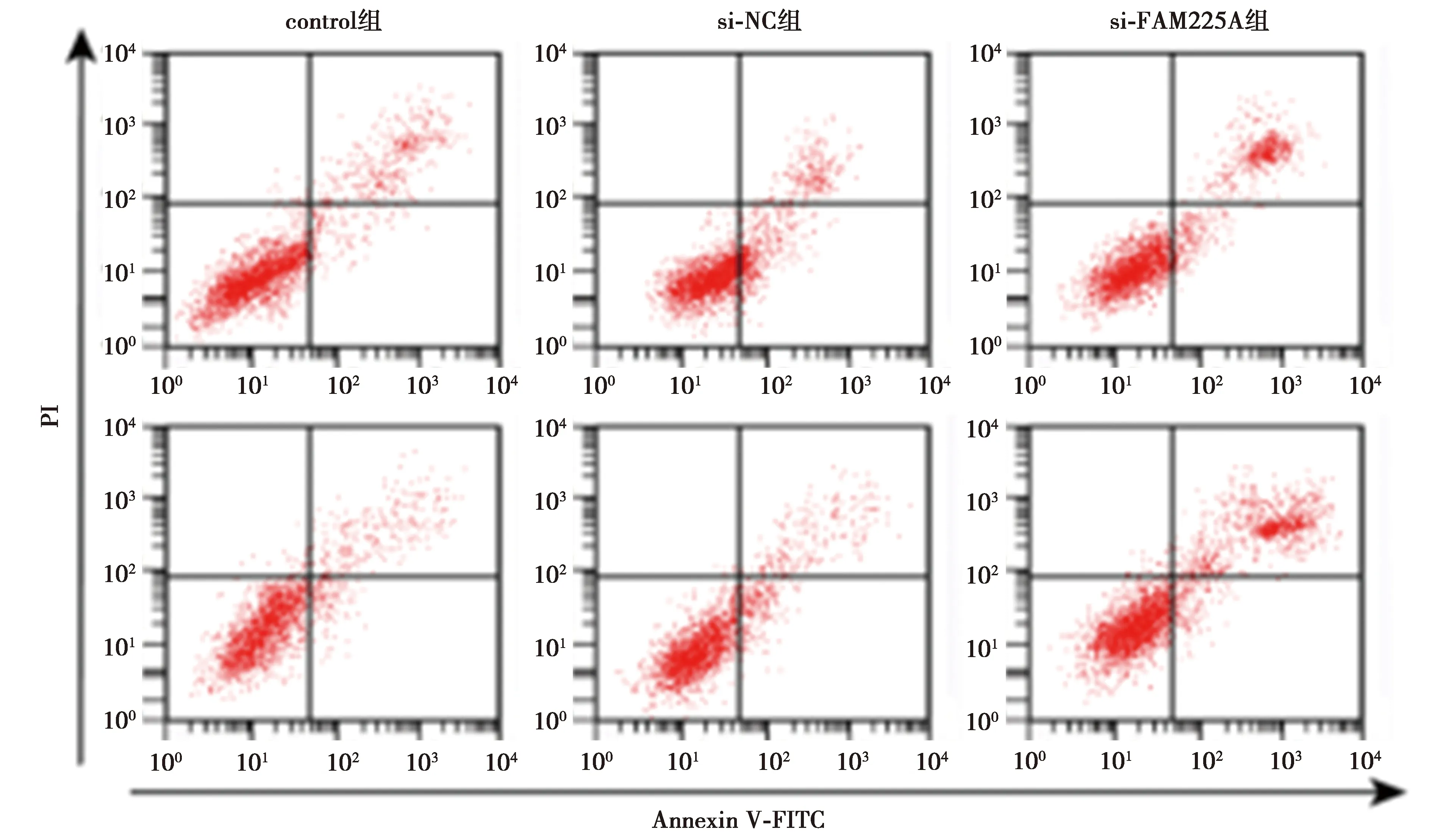
图7 miR-1-3p高表达促进细胞凋亡
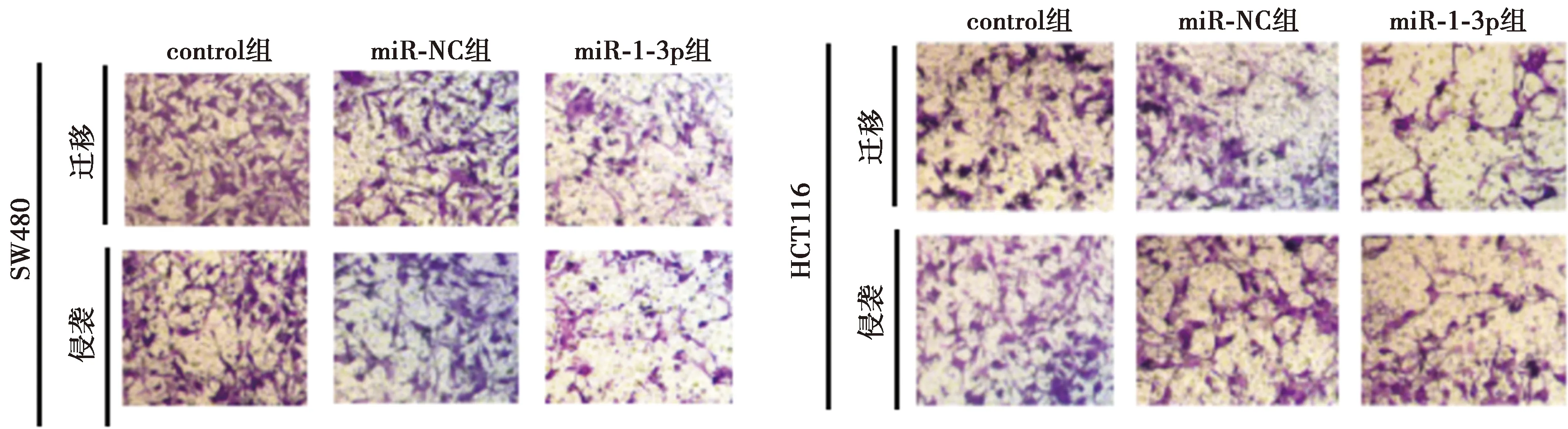
图8 miR-1-3p高表达抑制细胞迁移和侵袭(结晶紫染色,×200)
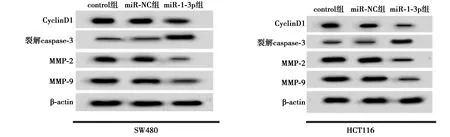
图9 miR-1-3p高表达对相关蛋白表达的影响


2.5LncRNA FAM225A靶向调控miR-1-3p的表达 starbase预测显示FAM225A与miR-1-3p有结合位点,图10。相较于miR-NC组,转染miR-1-3p与FAM225A野生型表达载体的细胞荧光素酶活性显著降低(P<0.05),见表8、表9。相比于si-NC组,si-LncRNA FAM225A组CRC细胞SW480、HCT116中miR-1-3p表达水平显著升高;相比于pcDNA-NC组,pcDNA-LncRNA FAM225A组CRC细胞SW480、HCT116中miR-1-3p表达水平显著降低(均P<0.05)。见表10。可见,FAM225A可靶向调控miR-1-3p的表达。
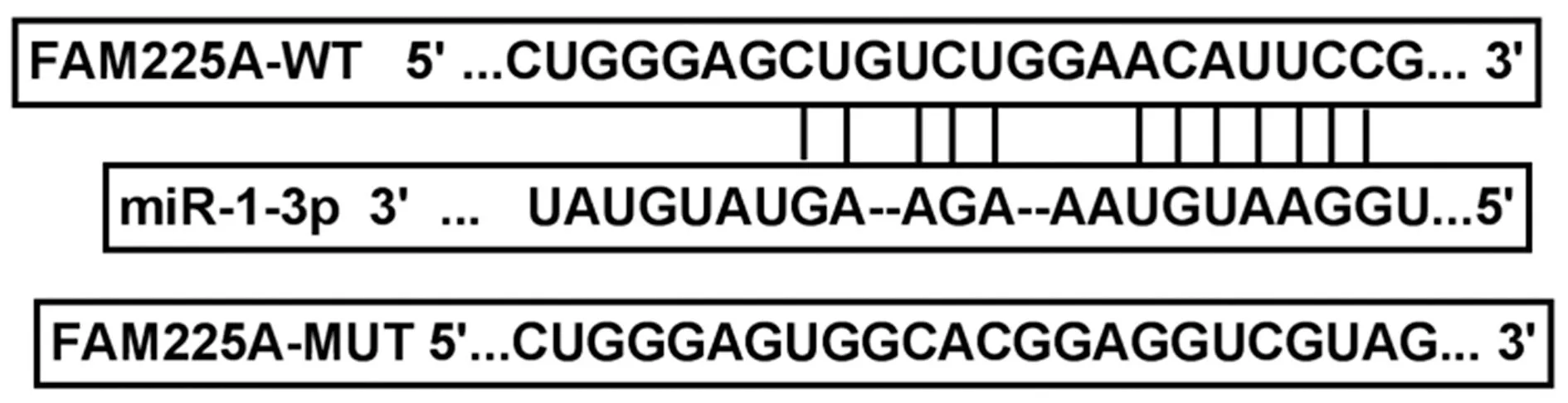
图10 生物信息软件预测miR-1-3p与LncRNA FAM225A靶向关系
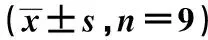
表8 miR-NC或miR-1-3p与LncRNA FAM225A -野生型及突变型报告质粒共转染SW480细胞后相对双荧光素酶活性检测
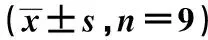
表9 miR-NC或miR-1-3p与LncRNA FAM225A -野生型及突变型报告质粒共转染HCT116细胞后相对双荧光素酶活性检测
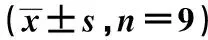
表10 qRT-PCR检测miR-1-3p水平
与si-NC组比较:1)P<0.05;与pcDNA-NC组比较:2)P<0.05
2.6miR-1-3p低表达可部分逆转FAM225A低表达对CRC细胞SW480、HCT116增殖、迁移、侵袭和凋亡的影响 与si-FAM225A+anti-miR-NC组相比,si-FAM225A+anti-miR-1-3p组细胞存活率及CyclinD1、MMP-2、MMP-9表达水平显著升高,克隆形成细胞数目及迁移和侵袭数目均显著增加,细胞凋亡率及裂解caspase-3表达水平显著降低(均P<0.05),见图11~14,表11、表12。可见,miR-1-3p低表达可部分逆转FAM225A低表达对CRC细胞SW480、HCT116增殖、迁移、侵袭和凋亡。
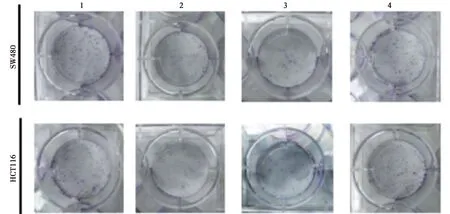
1~4:si-NC组、si-FAM225A组、si-FAM225A+anti-miR-NC组、si-FAM225A+anti-miR-1-3p组;下图同图11 低表达miR-1-3p和FAM225A后细胞克隆形成
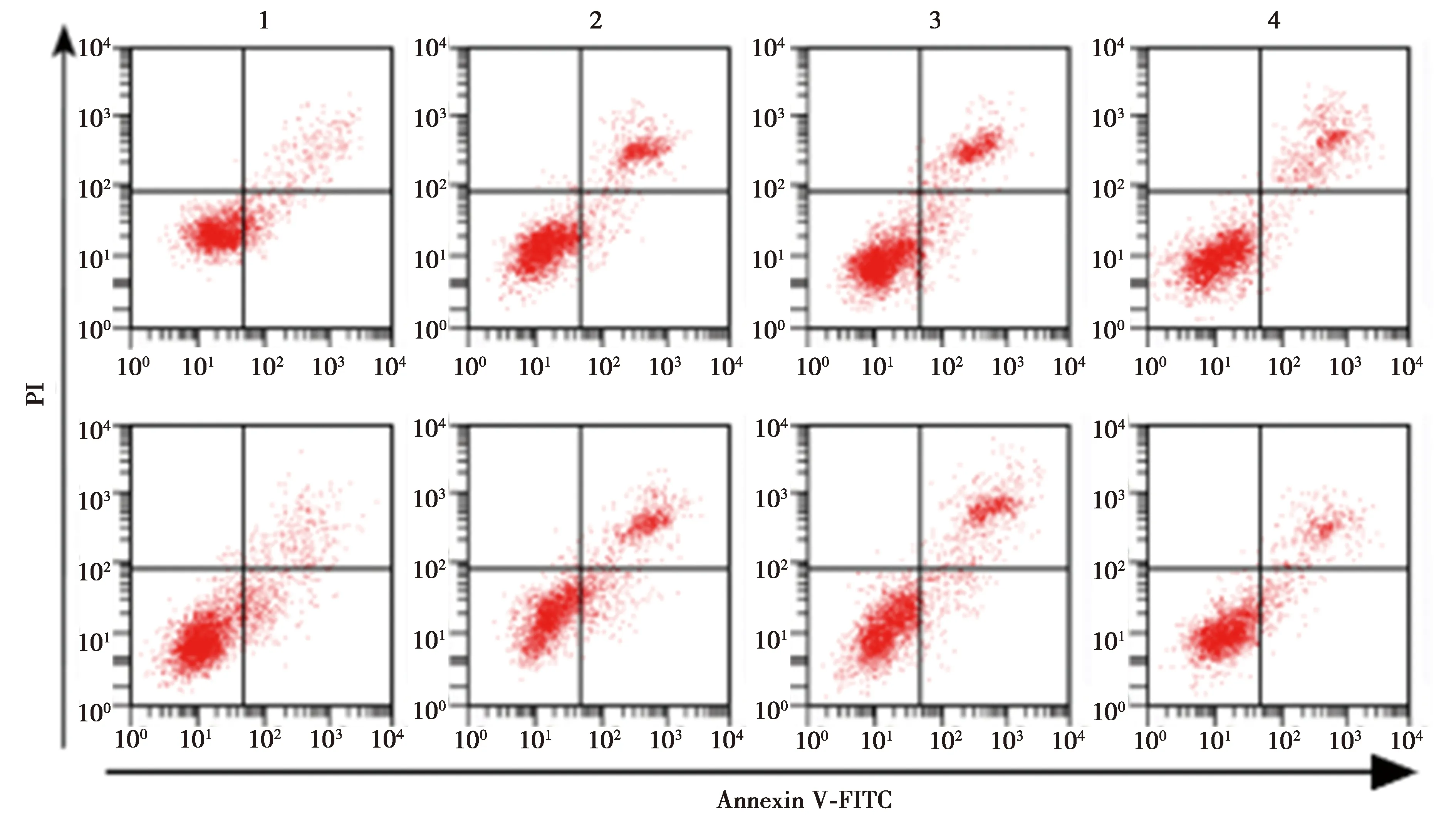
图12 低表达miR-1-3p和FAM225A后细胞凋亡
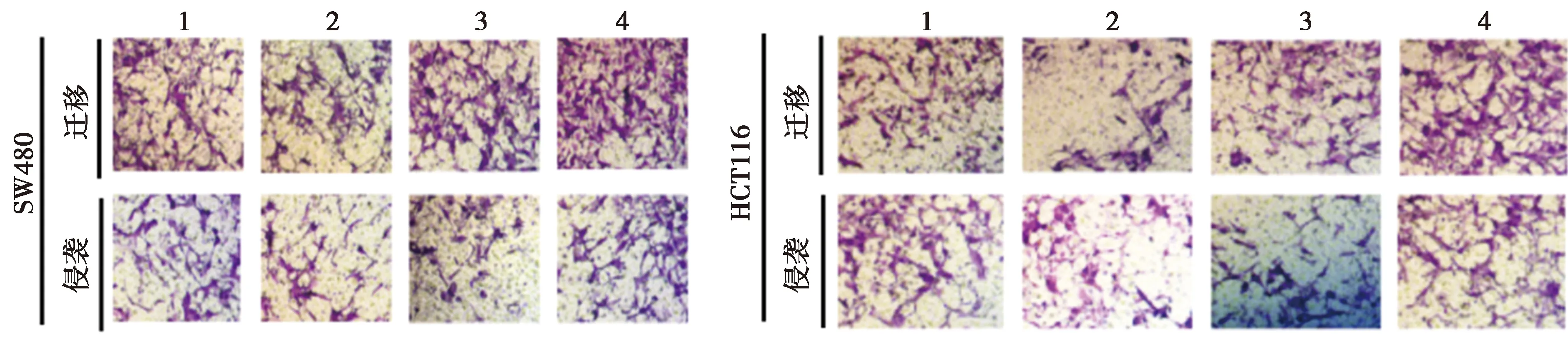
图13 低表达miR-1-3p和FAM225A后细胞迁移和侵袭数
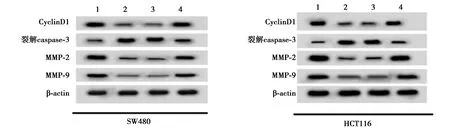
图14 低表达miR-1-3p和FAM225A后相关蛋白表达量
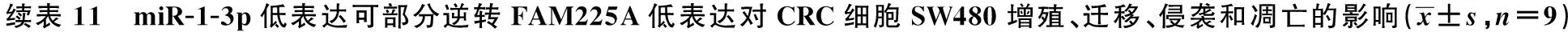
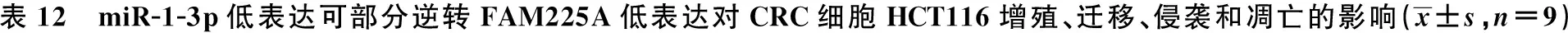
3 讨 论
早发现、早诊断、早治疗是有效防治CRC的关键,因此寻找CRC特异性肿瘤标志物和治疗靶点至关重要〔10,11〕。LncRNA和miRNA均属于非编码RNA,可通过多种分子机制参与肿瘤的发生和发展,也参与调控CRC的进展,可作为CRC诊断、治疗及预后靶标〔12,13〕。FAM225A是一种致癌LncRNA,研究报道FAM225A在鼻咽癌中上调表达,且与鼻咽癌的不良生存率显著相关;其高表达促进鼻咽癌细胞增殖、迁移、侵袭、肿瘤生长和转移;且FAM225A与miR-590-3p和miR-1275结合调节整合素β3(ITGB3)表达促进鼻咽癌肿瘤发生和转移〔14〕。本实验结果说明FAM225A低表达抑制CRC细胞增殖、迁移和侵袭,并促进细胞凋亡。CyclinD1是细胞周期关键调节蛋白,被认为是一种原癌基因,过表达促进细胞增殖〔15〕。MMP-2、MMP-9属于MMPs家族,影响细胞的迁移和侵袭,且有研究发现转移性CRC患者中MMP-2、MMP-9高表达〔16〕。裂解caspase-3是一种抑癌基因,可抑制细胞增殖,促进细胞凋亡〔17〕。因此,本实验结果进一步证明了FAM225A低表达可抑制CRC SW480、HCT116细胞的增殖、迁移和侵袭,并促进凋亡。
研究发现miR-1-3p可参与调控肿瘤细胞的进展,如过表达miR-1-3p可抑制膀胱癌细胞的增殖,侵袭和迁移能力〔18〕。在肝癌患者和口腔鳞状细胞癌中miR-1-3p表达水平降低,并与患者的预后相关;过表达miR-1-3p可抑制肝癌、口腔鳞状细胞癌细胞的恶性生物学行为〔19,20〕。本实验结果说明高表达miR-1-3p可抑制CRC SW480、HCT116细胞的恶性生物学行为。miR-1-3p在CRC、膀胱癌、肝癌和口腔鳞状细胞癌中可能均作为抑癌因子。还有研究报道分化拮抗非蛋白编码RNA(DANCE)可通过竞争性结合miR-1-3p激活磷脂酰肌醇3激酶(PI3K)/蛋白激酶B(PKB,又称Akt)/核因子(NF)-κB信号通路介导胶质瘤细胞对顺铂的耐药性〔21〕。综上,抑制FAM225A表达可能通过调控miR-1-3p抑制CRC细胞增殖、迁移和侵袭,促进细胞凋亡。
