血清肿瘤标志物CA125对非小细胞肺癌患者化疗效果的评估作用
2021-09-01李一鸣齐齐哈尔医学院附属第二医院同位素室黑龙江齐齐哈尔161000
李一鸣 (齐齐哈尔医学院附属第二医院同位素室,黑龙江 齐齐哈尔 161000)
肺癌是一种致死率较高的常见恶性肿瘤,其中,非小细胞肺癌(NSCLC)约占全部肺癌发病率的80%,严重影响患者的生命健康〔1,2〕。随着生活环境的改变及吸烟人数的不断增加,全球范围内肺癌的发病率与日俱增,死亡率也居高不下。目前,肺癌的临床治疗仍以手术干预为主,辅助放疗或化疗,但手术治疗对存在远处转移或较大范围转移患者的作用有限〔3〕。对于存在远隔转移或局部进展的中晚期患者来说,化疗能有效提高患者生存时间,早期消灭肿瘤远处转移灶,提高手术切除率,改进局部肿瘤控制情况〔4〕。2015 年中国原发性肺癌临床诊疗流程提出,检测相关血清肿瘤标志物是拟诊肺癌患者的推荐检查之一〔5〕。检测血液中肿瘤标志物具有创伤小、取材方便及较好的重复性等优点,因此血清肿瘤标志物的检测越来越受到人们的重视〔6,7〕。研究表明,血清肿瘤标志物在NSCLC的预后判断和疗效监测中也具有重要意义。 本研究拟通过比较NSCLC临床患者化疗干预前后血清糖类抗原(CA)125水平变化及动物模型中血清CA125水平变化对化疗疗效的影响,评价CA125在NSCLC化疗效果评估中的临床价值。
1 资料与方法
1.1一般资料
1.1.1临床病例 收集2019年10月至2020年9月于齐齐哈尔医学院附属第二医院NSCLC患者60例,经病理或细胞学检查确诊,均无手术指征或患者签署拒绝手术治疗。纳入标准:患者入院前均为初诊病例,且未行放疗、化疗、内分泌治疗等干预治疗,确诊后均接受至少1个疗程吉西他滨联合顺铂化疗治疗。排除标准:合并其他肿瘤患者;合并远处转移患者;合并脏器功能不全患者;合并急性感染患者;妊娠或哺乳患者;排除对受试药物过敏患者。平均年龄(55.12±5.20)岁,Ⅰ期1例,Ⅱ期4例,Ⅲ期35例,Ⅳ期20例;治疗前血清CA125水平正常18例,血清CA125阳性42例。本研究经医院伦理委员会批准,研究对象均知情并签署知情同意书。
1.1.2实验动物 6~8 w龄健康雄性SPF级(无特殊病原体动物)昆明种小鼠40只,体重(20±5)g,购于中国医科大学实验动物中心(长生公司)。所有实验动物均进行1 w适应性培养。饲养环境(23±2)℃,湿度40%~60%,12 h光照和黑暗交替饲养,通风良好,环境安静,实验动物自由饮食、饮水。饲料由动物实验中心提供。本研究关于实验小鼠的相关操作均符合医院动物伦理委员会要求。
1.2方法
1.2.1化疗方案 患者均接受吉西他滨联合顺铂化疗。注射用盐酸吉西他滨〔齐鲁制药(海南)有限公司,国药准字:H20113286〕+ 0.9% 氯化钠注射液(华仁药业股份有限公司,国药准字:H20023682)100 ml,分别于第1天及第8天按照 1 000 mg/m2静脉滴注 30 min,顺铂注射液(江苏豪森药业集团有限公司,国药准字:H20040813,规格6 ml∶30 mg)于第1~3天按照25 mg/m2静脉滴注,以21 d为1个疗程,对症给予止吐、水化等治疗干预。
1.2.2血清CA125检测 患者均于化疗前后抽取清晨空腹静脉血3 ml,3 500 r/min离心5 min,分离血清,采用化学发光仪检测血清CA125水平。正常指标:血清CA125<35 IU/ml。
1.2.3动物分组及模型制备 取出液氮中保存的NSCLC细胞A549,置于水浴锅中快速融化,生理盐水离心清洗3次,接种于2只实验小鼠腹腔,0.5 ml/只。于第9日抽取腹水进行腹腔传代,至第五代腹水细胞,稀释5×107个/ml,接种于剩余实验小鼠右后肢外侧北部近中线处,0.2 ml/只,共接种40只。根据实验小鼠接种后48 h血清CA125表达水平将其分为CA125正常组和CA125阳性组,两组均给予吉西他滨联合顺铂化疗干预,经尾静脉联合注射吉西他滨(150 mg/kg)及顺铂(10 mg/kg)。化疗后小鼠自由饮食,每组随机抽取3只,剪尾取血约0.05 ml后处死,剥离原位肿瘤,肿瘤称重,剩余小鼠用于生存记数。
1.3观察指标
1.3.1化疗疗效 采用实体瘤疗效评价标准(RECIST)〔8〕:以全部病灶消失,无新病灶出现,肿瘤标志物降至正常,并至少维持4 w为完全缓解(CR);以肿瘤最长径之和缩小≥30% 以上,并至少维持4 w为部分缓解(PR);以肿瘤最长径之和缩小未PR,或增大未达进展为稳定(SD);以最大径增大≥20%,或出现新病灶为进展(PD)。以CR+PR+SD为非进展。
1.3.2实验小鼠自主活动情况 自主活动情况采用组织活动测定仪检测,每间隔2 d观察两组实验小鼠自主活动次数并记录。
1.3.3肿瘤生长情况 裸鼠成瘤后,每7 d采用游标卡尺测量肿瘤长径(a)和短径(b),根据公式V=ab2/2计算移植瘤体积。根据公式瘤重抑瘤率=(1-实验组平均瘤重/对照组平均瘤重)× 100%计算各组抑瘤率。
1.4统计学方法 采用SPSS19.0 软件进行χ2检验、t检验、单因素方差分析。
2 结 果
2.1血清CA125水平与NSCLC患者临床病理特征的关系 NSCLC患者血清CA125水平与患者性别、年龄、TNM临床分期无明显关系(P>0.05)。见表1。
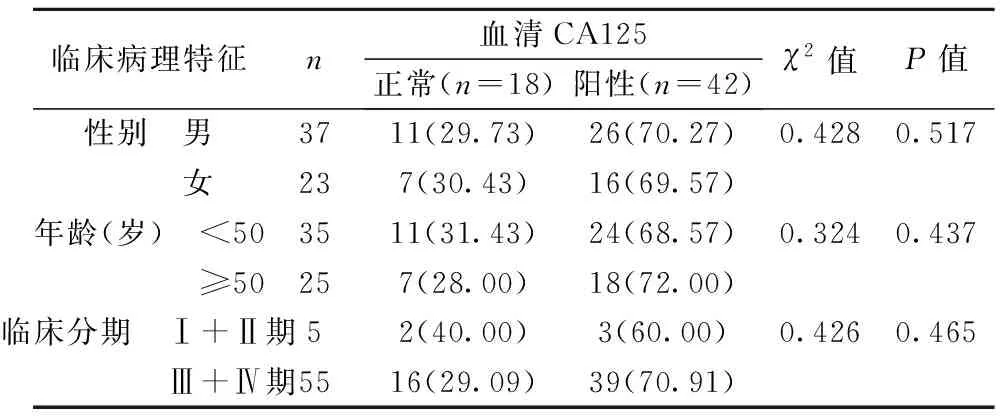
表1 血清CA125水平与NSCLC患者临床病理特征的关系〔n(%)〕
2.2NSCLC患者化疗前后血清CA125水平变化 进展组化疗后血清CA125水平明显增加(P<0.05),非进展组化疗后血清CA125水平则无明显改变(P>0.05),且化疗后进展组血清CA125水平明显高于非进展组(P<0.05),见表2。

表2 NSCLC患者化疗前后血清CA125水平
2.3血清CA125水平与NSCLC患者化疗疗效的关系 CA125正常NSCLC患者化疗后进展4例,非进展14例,化疗有效率为77.78%;CA125阳性NSCLC患者化疗后进展20例,非进展22例,化疗有效率为52.38%,明显低于CA125正常组(χ2=4.382,P=0.023)。
2.4两组小鼠化疗前后自主活动情况 CA125正常组化疗后自主活动次数有所增加,但差异无统计学意义(P>0.05),CA125阳性组化疗后自主活动次数则明显减少(P<0.05),且阳性组明显低于正常组(P<0.05)。见表3。
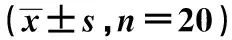
表3 两组小鼠化疗前后自主活动情况
2.5两组小鼠化疗后肿瘤转移情况 化疗干预后,CA125正常组未出现骨转移及脑转移,肝转移1例(5.00%),心包转移1例(5.00%);CA125阳性组骨转移1例(5.00%),脑转移2例(10.00%),肝转移2例(10.00%),心包转移3例(15.00%);与CA125正常组远处转移率(10.00%)比较,CA125阳性组远处转移率(40.00%)明显增高(P<0.05)。
2.6两组小鼠化疗后肿瘤体积变化 化疗干预后,CA125正常组肿瘤体积明显减小(P<0.05),CA125阳性组实体瘤体积明显增大(P<0.05),CA125阳性组实体瘤体积明显大于CA125正常组(P<0.05)。见表4。
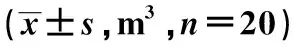
表4 两组小鼠化疗后肿瘤体积变化
2.7两组小鼠化疗后抑瘤率比较 化疗干预后,CA125正常组肿瘤明显小于CA125阳性组(P<0.05),CA125正常组抑瘤率明显优于CA125阳性组(P<0.05)。见表5。
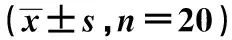
表5 两组小鼠化疗后抑瘤率比较
2.8两组小鼠化疗后生存时间 CA125阳性组最早出现死亡,且最早全部死亡,CA125正常组中位生存期为(48±5.24)个月,CA125阳性组中位生存期为(16±3.24)个月,CA125正常组生存期明显优于CA125阳性组(P<0.05)。
3 讨 论
据统计在中国每年约有60万人死于肺癌,从2008年开始肺癌取代肝癌成为恶性肿瘤导致死亡的首要病因以来,中国每年死于肺癌的人数仍在不断递增〔9~11〕。肺癌可分为小细胞肺癌和NSCLC〔12〕。尽管过去几十年里,肺癌的早期诊治手段进展良多,但肺癌患者5年生存率仍不及20%,严重威胁患者的生命安全〔13〕。传统治疗多以手术治疗和化学治疗为主,但大部分晚期患者不能实行手术治疗或拒绝手术治疗,因此,以化疗或内科治疗为主的综合治疗成为晚期NSCLC患者的主要治疗手段。
化疗是控制NSCLC局部病灶的有效手段之一,在NSCLC患者的临床治疗中得以广泛应用,在局部晚期NSCLC患者中更占有重要地位〔14〕。吉西他滨联合顺铂化疗是目前临床上常用的化疗方案之一,1998年美国食品药物管理局(FDA)首次批准吉西他滨联合顺铂化疗为治疗晚期NSCLC的一线方案以来,不断有临床研究证实,此方案可有效延长患者中位生存时间,提高生活质量〔15,16〕。目前临床上对于化疗疗效的监测主要依据影像学变化进行评估,但经化疗干预后,NSCLC肿瘤组织和细胞活性无法被影像学正确判断,部分早期NSCLC患者病灶在化疗干预后无法被完全评价,加上影像学检查对设备要求高,患者经济负担重,寻找简洁易行、经济高效的化疗疗效评估手段十分重要〔17〕。随着分子生物学和免疫学的不断发展,血清肿瘤标志物在肿瘤的普查、诊断、判断预后和转归、评价疗效和随诊等方面占有越来越重要的位置。血清肿瘤标志物主要指肿瘤发生、发展、浸润及转移的过程中由肿瘤细胞产生、肿瘤与宿主相互作用后产生的一类化学物质,或是宿主细胞因肿瘤细胞信号刺激过量产生的正常细胞组分,一般情况下仅在早期胚胎组织中存在,在正常人组织中几乎不存在或者含量极低,但在肿瘤组织中含量通常会异常增高,其含量的改变可在一定程度上反映了肿瘤的性质、肿瘤的发生、发展及转移,主要用于监测肿瘤对治疗的反应〔18,19〕。肿瘤标志物根据不同的化学特性可分为癌胚蛋白、糖类抗原、酶类标志物、激素类、癌基因等,临床上常用的肺癌肿瘤标志物包括癌胚抗原(CEA)、CA125、细胞角蛋白19片段(CYFRA21-1)、鳞状细胞癌相关抗原(SCC-Ag)等,在肺癌的临床诊断、个性化方案制定、评估疗效及预后判断中具有指导作用〔20~22〕。
CA125是一种糖蛋白,主要是作为卵巢癌的肿瘤标志物,在卵巢癌患者中明显升高,近来发现其在肺癌细胞也存在异常高表达,是目前应用最广泛的肿瘤标志物之一〔23,24〕。研究显示,NSCLC患者血清中CA125阳性率较高,敏感性可高达60%,特异性高达67%,在肺癌术后复发和转移的患者中,CEA 水平也有明显上升,并与 CYFRA21-1 的升高相一致,可作为NSCLC患者诊断和判断预后的指标〔25〕。目前临床上采用不同肿瘤标志物联合检测用于预测NSCLC患者的预后〔26,27〕。本研究结果提示血清CA125水平检测对于评估NSCLC患者的化疗效果具有积极意义,血清CA125阳性的NSCLC患者化疗预后一般较差。本结果提示血清CA125检测与化疗后NSCLC小鼠实体肿瘤体积改变、肿瘤远处转移及生存时间也具有一定关系。
综上,血清肿瘤标志物CA125检测可作为评估NSCLC化疗效果的敏感指标,其阳性表达与肿瘤化疗后的转移及患者生存时间明显相关。
