男性乳腺癌超声及临床病理学表现
2021-09-01张晓东陈卉品郑碧玉
张晓东,陈卉品,张 凤,郑碧玉
(1.厦门大学附属第一医院超声科,福建 厦门 361003;2.厦门大学附属中山医院超声科,福建 厦门 361004)
男性乳腺癌临床少见,在全部乳腺癌病例中占比<1%、男性癌症病例中占比<0.5%,但近年来发病率呈缓慢上升趋势[1]。目前临床针对男性乳腺癌的诊治方案主要参照女性乳腺癌标准和小样本回顾性研究结果[2]。本研究观察男性乳腺癌的超声及病理学表现,以提高对于男性乳腺癌的认识。
1 资料与方法
1.1 研究对象 回顾性分析2011年2月—2020年2月30例于厦门大学附属第一医院经手术病理证实的男性乳腺癌患者,年龄32~85岁,平均(62.2±13.1)岁;均为单侧发病,其中右侧18例,左侧12例;病程15天~10年;4例既往有恶性肿瘤病史,分别为肺上皮样血管肉瘤、肝平滑肌肉瘤、鼻咽癌及淋巴瘤。排除乳腺转移癌患者。检查前患者均签署知情同意书。
1.2 仪器与方法 采用Philips IU22/Philips EPIQ7/GE LOGIQ E9彩色多普勒超声诊断仪,线阵探头,频率5.0~15.0 MHz。嘱患者仰卧,充分暴露双侧乳腺及腋窝,由2名具有10年以上工作经验的超声科医师采用仪器预设乳腺检查条件进行双侧乳腺横切、纵切及以乳头为中心的放射状扫查,以后根据具体情况调整深度、增益、彩色量程等,以获取最佳图像,记录病灶数目、位置、大小、形态、边缘、内部回声及后方回声等;并参照文献[3]对肿物内部血流进行分级:未见血流信号为0级,少量血流信号为Ⅰ级,中量血流信号为Ⅱ级,大量血流信号为Ⅲ级;并扫查腋下、锁骨下及胸骨旁淋巴结;意见有分歧时经协商达成一致。
1.3 临床及病理资料 记录病史、临床表现、体征、病变位置及病理学检查结果等。根据有无淋巴结转移分为阳性组和阴性组。
1.4 统计学分析 采用SPSS 19.0统计分析软件。以±s表示计量资料,组间比较采用t检验;以频数表示计数资料,组间比较采用Fisher精确概率法。P<0.05为差异有统计学意义。
2 结果
2.1 临床表现 30例男性乳腺癌中,24例(24/30,80.00%)首诊表现为单侧乳腺无痛性肿物,2例(2/30,6.67%)发现腋下肿物,3例(3/30,10.00%)乳晕及周围皮肤红肿破溃,1例(1/30,3.33%)乳头溢液;19例(19/30,63.33%)伴不同程度男性乳腺发育;其中27例(27/30,90.00%)可于乳腺区触及肿物,2例[分别为副乳浸润性导管癌(invasive ductal carcinoma,IDC)和隐匿性乳腺癌,2/30,6.67%]仅腋窝触及肿物,1例导管原位癌(ductal carcinoma in situ,DCIS)(1/30,3.33%)未触及肿物。
2.2 超声表现 超声检出28例乳腺病灶(28/30,93.33%),其中27例(27/30,90.00%)位于乳头周围,1例(1/30,3.33%)副乳肿物位于腋窝;1例隐匿性乳腺癌(1/30,3.33%)仅于腋窝检出肿大淋巴结;1例DCIS(1/30,3.33%)未检出明确肿物。
28例乳腺病灶中,26例(26/28,92.86%)为单发、2例(2/28,7.14%)为多发;最大径10.0~105.0 mm,平均(30.76±23.85)mm;25例(25/28,89.29%)肿物形态不规则、3例(3/28,10.71%)形态规则;24例(24/28,85.71%)呈低回声,4例(4/28,14.29%)呈混合回声;22例(22/28,78.57%)边缘不光整,有毛刺或成角改变,6例(6/28,21.43%)边缘光整;22例(22/28,78.57%)内部回声不均,6例(6/28,21.43%)回声均匀;仅5例(5/28,17.86%)肿物内可见钙化,9例(9/28,32.14%)肿物后方回声增强,2例(2/28,7.14%)可见回声衰减;3例(3/28,10.71%)肿物内部血流为0级,5例(5/28,17.86%)为Ⅰ级,15例(15/28,53.57%)为Ⅱ级,5例(5/28,17.86%)为Ⅲ级;肿物周围均未见高回声晕环;12例(12/28,42.86%)累及周围皮肤或胸壁。见图1~3。

图1 患者男,65岁,IDC(阳性组) A.超声声像图示右乳头后内侧低回声肿物(箭),边缘光整,形态规则,内部回声欠均匀,后方无衰减;B.CDFI示肿物周边少许血流信号,血流分级Ⅰ级;C.CDFI示右侧腋窝淋巴结肿大,形态不规则,淋巴门部分消失,内部血流丰富,分布不规则
28例淋巴结超声资料完整患者中,16例(16/28,57.14%)腋窝或锁骨上、下淋巴结肿大,主要为皮质低回声带偏心性增厚和/或淋巴门结构消失;12例未见明确淋巴结肿大。
2.3 病理学表现 30例中,22例(22/30,73.33%)为IDC,其中1例为副乳IDC;4例(4/30,13.33%)为乳头状癌;2例混合性癌,其中1例为浸润性小叶癌和IDC,1例为IDC和黏液腺癌;1例为DCIS(微乳头型);1例为隐匿性乳腺癌。16例伴腋窝或锁骨上、下淋巴结肿大,均经手术病理证实为转移性淋巴结(阳性组);12例未见淋巴结转移(阴性组)。
30例中,23例接受雌激素受体(estrogen receptor,ER)和孕激素受体(progesterone receptor,PR)检测,阳性率均为95.65%(22/23);19例接受人表皮生长因子受体2(human epidermal growth factor receptor-2,HER2)和Ki-67检测,5.26%(1/19)HER2阳性,52.63%(10/19)Ki-67高表达。
2.4 组间比较 阳性组与阴性组之间,仅乳腺肿物最大径差异具有统计学意义(P<0.05),其余参数差异无显著统计学意义(P>0.05)。见表1。
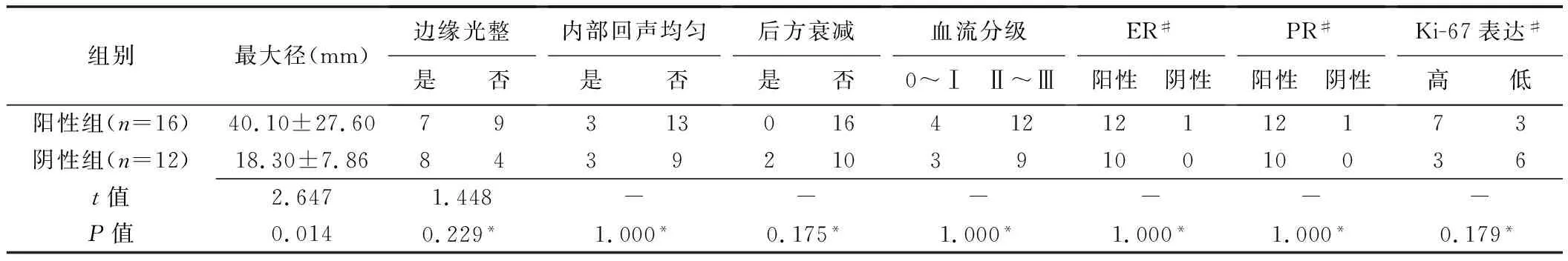
表1 男性乳腺癌超声及病理表现
3 讨论
男性乳腺癌发病率低,其机制尚不明确,目前认为相关危险因素包括高龄、黑人种族、乳腺癌家族史、乳腺癌易感基因(breast cancer susceptibility gene,BRCA)、精曲小管发育不全、雌雄激素失衡及睾丸异常等[4]。男性乳腺癌可发生在任何年龄段,我国平均发病年龄为50~60岁[5]。约15%~20%的男性乳腺癌患者有乳腺癌或卵巢癌家族史,但本组病例未采集到相关家族史。BRAC1和BRAC2是女性乳腺癌的易感基因,在男性乳腺癌患者中也可检测到其突变;SILVESTRI等[6]报道,BRAC1及BRAC2基因突变男性罹患乳腺癌的风险为1%~5%及5%~10%。
男性乳腺癌早期多无明显临床症状,发现时往往已出现周边或远处转移,故预后较女性乳腺癌为差[7]。本组80.00%(24/30)患者以乳晕下触及无痛性肿物为首发临床表现,肿物位置多较固定,可合并乳头溢液或溢血。由于男性乳房皮下脂肪较少,紧贴于胸壁,肿瘤易侵犯皮肤和胸肌层而出现乳头凹陷、皮肤增厚或溃疡、与胸肌粘连等继发表现,晚期皮肤可出现卫星结节;本组12例肿瘤累及皮肤或胸壁。本组63.33%(19/30)患者伴男性乳腺发育症。雌雄激素比例升高是男性乳腺发育症和男性乳腺癌的共同风险因素,但既往研究[8]证实男性乳腺发育症难以直接进展为乳腺癌。男性乳头乳晕下有丰富的淋巴管网,即使肿瘤体积较小,也易较早发生腋窝和锁骨上、下淋巴结转移;其远处转移部位与女性相似,主要见于骨、肺、胸膜及肝等。本组16例(16/28,57.14%)伴淋巴结转移,但阳性组与阴性组之间仅乳腺肿物最大径差异具有统计学意义(P<0.05),与王勇等[9]的结果相符,不同的是本组男性乳腺癌血流分级与淋巴结转移无明显相关,可能与样本量或病理类型有关。
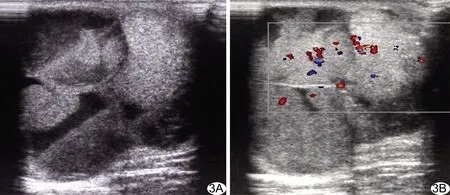
图3 患者男,51岁,IDC(阴性组) A.超声声像图示左乳头下方囊实性肿物,边缘不光整,形态不规则,内部以实性为主,后方回声增强;B.CDFI于肿物内部见较丰富的血流信号,血流分级Ⅱ级
本组男性乳腺癌声像图主要表现为形态不规则的低回声肿物,边缘多不光整,少见钙化和后方回声衰减,其内血流信号以Ⅱ级和Ⅲ级为主,与既往报道[10-11]相符。男性乳腺癌的声像图表现与女性乳腺癌有相似之处,又存在差异,可能与其病理学特征有关。由于缺乏雌激素和孕激素作用,男性乳腺始终停留在胎儿晚期发育状态,仅存在乳腺导管及周围纤维组织、脂肪组织,一般不形成乳腺小叶和腺泡,故IDC为男性乳腺癌最常见病理类型,本组73.33%(22/30)为IDC,其次为DCIS[5,11-12]。女性浸润性非特殊类型(not otherwise specified,NOS)乳腺癌多起源于腺体周边终末导管小叶单元,累及中央导管,而男性浸润性NOS乳腺癌多起源于乳晕下导管。男、女性乳腺癌最常见类型均为IDC,不同之处在于发生IDC的位置及合并DCIS时的累及范围。男性IDC中较少见DCIS成分,故少见导管扩张、分支状形态、钙化或微小分叶等DCIS征象[8]。另外,本组2例乳头状癌均表现为乳腺多发肿物,其间有无相关性尚需进一步观察。
既往研究[5]显示男性乳腺癌ER阳性率为80%~90%,PR阳性率为75%~81%,均与年龄无明显相关。女性乳腺癌HER-2阳性率为20%~30%,多提示预后较差;男性乳腺癌中HER-2阳性率则更低,本组为5.26%,其对预测男性乳腺癌患者预后的意义尚待观察[5]。
综上所述,男性乳腺癌多以单侧乳腺乳头周围的无痛性肿物为主要临床表现;超声多表现为形态不规则的低回声肿物,边缘多不光整,内部回声不均,血流多较丰富;病理类型以IDC为主,ER、PR阳性率高而HER-2阳性率甚低,过半呈Ki-67高表达。
