天然木脂素苷类成分eleutheroside E对膝骨性关节炎的治疗作用及其与MMPs相互作用方式的分析
2021-09-01闫兆威魏明刚刘江云
闫兆威,张 敏,魏明刚,姚 鑫,刘江云
1苏州大学附属第一医院,苏州 215006;2苏州大学药学院,苏州 215123
骨性关节炎(osteoarthritis,OA)是一种退行性疾病,主要表现为关节软骨代谢异常和关节骨结构破坏,严重时会导致关节功能丧失,已成为50岁以上人群丧失劳动力和致残的重要病因。其中膝骨性关节发生率最高,据世界卫生组织统计,目前全世界约有1.9亿骨性关节炎患者,随着老龄化社会的进程,OA患者逐年增多,给患者家庭带来了极大的经济负担和精神压力[1,2]。目前对OA的治疗是以一些非特异性药物减轻临床症状为主,通过口服非阿片类止痛药(对乙酰氨基酚、中枢镇痛药)及非甾体类抗炎药来缓解关节炎患者的症状,但并不能从根本上治愈OA,同时该类药物在心血管系统及胃肠道系统的不良反应较多,限制了其应用的范围[3,4]。因此,临床上亟待开发一种具有新作用机制、强效的OA治疗创新药物。Eleutheroside E(EE)是刺五加中特有的木脂素苷类成分(图1),课题组在前期研究发现EE具有较好的抗炎作用[5,6],但目前为止,国际尚未见有关EE在OA治疗应用的研究报道。故本研究基于前期工作基础,采用前交叉韧带切断法(ACLT)建立兔膝骨关节炎模型,首次选用EE作为治疗药物,通过关节腔注射的方式给药进行治疗干预,从动物整体水平对EE在实验性兔膝骨性关节炎的治疗及保护作用进行评价。并进一步运用分子对接技术和分子动力学模拟手段对EE与MMPs相互作用的位点及结合方式进行分析,明确EE与MMPs复合物结合的模式,从而为研发一种天然来源新型的骨性关节炎候选治疗药物奠定基础。

图1 Eleutheroside E的化学结构式Fig.1 The chemical structure of eleutheroside E
1 材料与方法
1.1 药品和试剂
Eleutheroside E(EE,含量≥ 98%,批号:20130811)购于成都瑞芬思生物科技有限公司,塞来昔布(celecoxib,含量≥ 98%,批号:20131019)购于Sigma-Aldrich公司,放于4 ℃冰箱保存,现用现配。MMP-3(批号:20140212),MMP-9(批号:20140417)和IL-1β(批号:20140130)的ELISA试剂盒购于TSZ Scientific LLC公司;PGE2(批号:20140625)的ELISA试剂盒购于R&D Systems公司。
1.2 仪器
EL104型电子天平(上海越平科学仪器有限公司);3K15型台式高速冷冻离心机(德国Sigma公司);Sunrise型酶标仪(瑞士Tecan公司);BX41型光学显微镜(日本OLYMPUS 公司)。
1.3 实验动物
新西兰大白兔,30只,雄性,体重3.0~3.5 kg,清洁级,由上海斯莱克实验动物有限公司提供,实验动物生产许可证号(SCXK(沪)2012-0002)。试验期间饲养室温度20~24 ℃,相对湿度为65~75%,自由摄食和饮水,实验动物处理遵守实验动物伦理原则。
1.4 实验方法
1.4.1 OA动物模型建立及药物处理
取30只雄性的健康新西兰大白兔,体重3.0~3.5 kg,清洁级,随机分为5组,每组6只,分为假手术组(sham operation,SO)、模型组(model)、EE低剂量(20 mg/kg,EE-20)、EE高剂量(60 mg/kg,EE-60)治疗药物组、阳性对照药celecoxib(15 mg/kg,Cel-15)组。所有动物造模前一天右膝备皮,术前称重,用10%水合氯醛按300 mg/kg经腹腔注射麻醉,将动物仰卧位固定于手术台上,消毒铺单。假手术组仅做皮肤切口,不切断前交叉韧带。模型组和各治疗组的动物均采用文献报道的前交叉韧带切断法(ACLT)建立骨性关节炎动物模型[7]。具体操作步骤如下,取髌骨内侧切口,显露关节腔,切断前交叉韧带,并切除断端1~2 mm,防止术后粘连,术中注意保护关节软骨,逐层缝合切口,术后3天肌肉注射青霉素,40万U/d。各组实验动物四周后观察切口愈合良好后,再进行关节腔注射给药,每次注射药物体积为0.5 mL,每周给药1次,连续进行5周。治疗药物EE组,关节腔注射给予EE-20和EE-60两种剂量;阳性药物组,关节腔注射给予Cel-15;模型组仅注射给予空白溶媒生理盐水0.5 mL;药物在注射前用生理盐水溶解,现用现配,假手术组不予任何处理正常饲养。
1.4.2 大体观察
处死动物取材时,观察右膝关节的关节面是否光泽,有无软化灶、糜烂、溃疡和缺损,有无软骨剥脱,软骨下骨质暴露,关节局部有无骨赘形成。并用大体评分规则进行评估[8]:0分:关节面光滑,色泽正常;1分:关节面粗糙,有小的裂隙,色泽灰暗;2分:关节面糜烂,软骨缺损达软骨表层或中层;3分:关节面溃疡形成,缺损达软骨深层;4分:软骨剥脱,软骨下骨质暴露。
1.4.3 组织病理学观察
采用空气栓塞法处死各组实验动物后,矢状位切取右膝关节,股骨内侧骼负重部分标木,厚约0.5 cm,包括关节软骨和软骨下骨,置于10%中性甲醛溶液中固定24 h,10% EDTA脱钙,酒精脱水,透明、浸蜡,5 μm层厚连续切片,烤片1 h,脱蜡、水化,HE染色,脱水、透明,中性塑胶封片。光学显微镜下观察关节软骨结构是否清晰,软骨细胞排列是否整齐,有无软骨细胞增生、缺失,有无软骨裂隙、溃疡及缺损、软骨层纤维成分是否增多等病理改变情况。观察滑膜组织有无肥厚及增生,有无血管侵入,有无炎细胞浸润等情况[9]。根据骨关节病组织分类方法中关节软骨与滑膜的病变计分标准[10],对各组动物膝关节标本的病变程度进行计分和组间比较。
1.4.4 关节液中IL-1β、PGE2、MMP-3和MMP-9的水平测定
实验结束后,处死兔子取关节液,测定关节液中IL-1β、PGE2、MMP-3和MMP-9的水平,所有检测实验均按照ELISA试剂盒的使用说明书进行操作。
1.4.5 分子对接实验
采用Chemdraw 15.0绘制小分子EE的2D结构,保存为cdx格式。载入Chem3D 15.0,用MM2力场进行能量最小化,保存为pdb格式。载入Autodocktool 1.5.6程序,添加电荷,分配原子类型,所有可旋转键均设置为柔性,保存为pdbqt格式,用于分子对接。以MMP-3(PDB ID:1B8Y)和MMP-9(PDB ID:1GKC)晶体结构作为蛋白受体,进行分子对接。在Pymol 1.7程序中删除晶体结构中的结晶水和其他小分子,添加氢原子后保存。载入Autodocktool 1.5.6程序,添加电荷,分配原子类型,保存为pdbqt格式,作为分子对接受体。采用Vina 1.1.2软件进行分子对接,获取配体-受体复合物初始坐标,选取affinity最佳构象作为分子对接结果。
1.4.6 分子动力学模拟
采用Amber 18软件包对蛋白-小分子复合物进行分子动力学模拟。蛋白使用ff14SB力场参数,小分子配体则使用gaff通用力场参数,并使用ANTECHAMBER 模块计算其AM1-BCC原子电荷。将蛋白-小分子复合物载入tleap模块,自动添加氢原子和拮抗离子以中和电荷。选择TIP3P显性水模型,设置周期性边界条件。分子动力学模拟工作流程共包括能量最小化、加热、平衡、生产动力学模拟等4步。首先,约束蛋白(和小分子)重原子,对水分子进行10 000步(含5 000步最速下降法和5 000步共轭梯度法)能量最小化;随后,在50 ps时间内,将体系缓慢加热至300 K;加热完成后,在npt系综下对体系进行50 ps的平衡。最后,将体系在npt系综下进行50 ns的分子动力学模拟。每隔10 ps保存一次轨迹数据,并用CPPTRAJ模块进行相关分析。配体和蛋白的结合自由能计算则采用MMPBSA.py模块进行。
1.4.7 数据分析
采用SPSS 16.0统计软件处理系统,实验数据以平均值±标准误差表示,统计分析采用Mann-Whitney U 检验,P<0.05有统计学意义。
2 结果与分析
2.1 EE对兔子大体观察的影响
假手术组显示:软骨面完整光滑,色泽正常,无关节积液及滑膜增生。模型组显示:软骨剥脱,软骨下骨暴露,股骨外髁有明显骨赘及溃疡生成。EE-20、EE-60和Cel-15治疗组中显示:关节软骨表面欠光滑,有散在溃疡点,软骨边缘无骨赘形成,未见裂纹及软化灶,大体破坏程度明显降低,其中EE-60和Cel-15治疗组与模型组比较,治疗效果明显(P<0.001)。EE治疗后代表性股骨外髁图及各组的大体评分见图2所示。
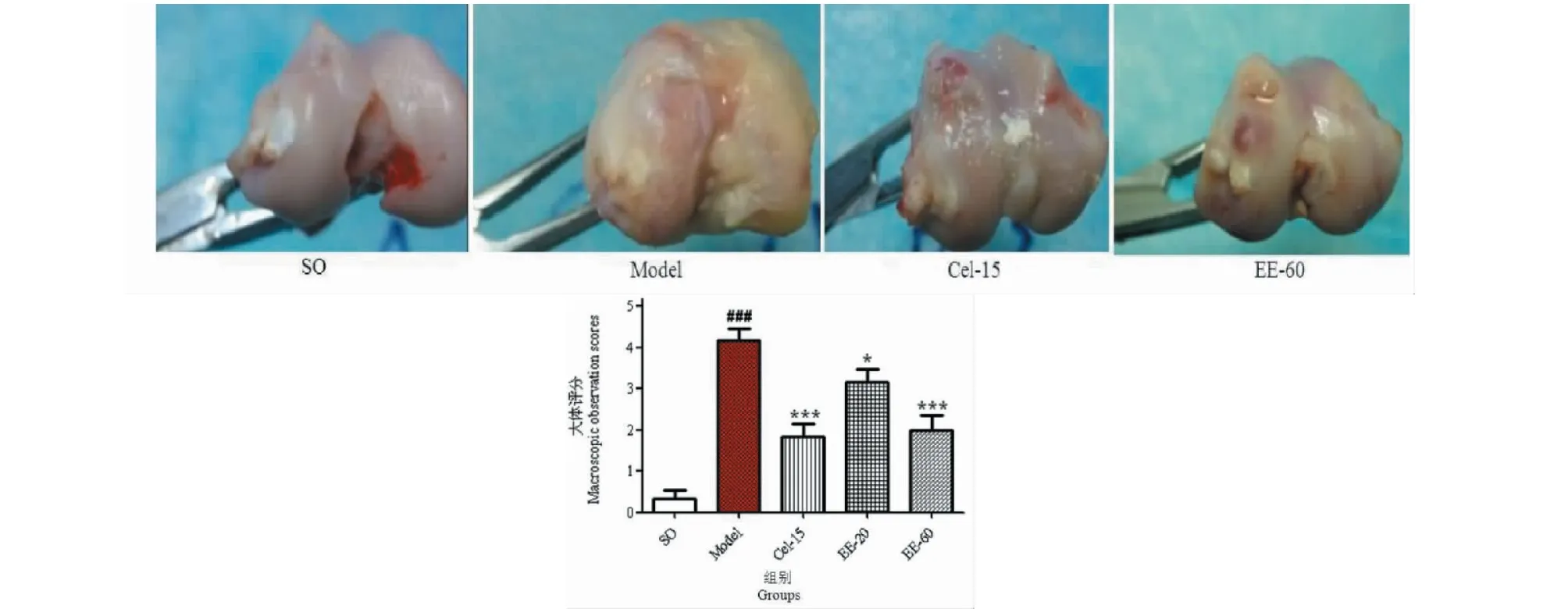
图2 EE对兔子大体观察的影响Fig.2 Effect of EE on macroscopic observations of rabbits注:与假手术组比较,### P < 0.001;与模型组比较,* P<0.05,*** P<0.001。Note:### P<0.001 vs SO group;*P<0.05,*** P<0.001 vs model group.
2.2 EE对兔子膝关节病理观察的影响
关节软骨HE染色结果:假手术组中显示:动物软骨表层完整,软骨结构清晰可辨,细胞排列整齐,潮线结构完整;模型组中显示:软骨表层剥脱,细胞明显增生,排列严重紊乱,潮线结构破坏。Cel-15治疗组显示:软骨病变程度较轻,表面光滑,但仍可见软骨表层细胞的染色加深及细胞排列紊乱;EE-20和EE-60治疗组显示:软骨表层轻微破损,可见一定程度的表层细胞增生,部分细胞的染色加深等软骨病变,但与模型组比较有明显的改善。EE治疗后代表性关节软骨病理图片及各组关节软骨的病理评分见图3所示。
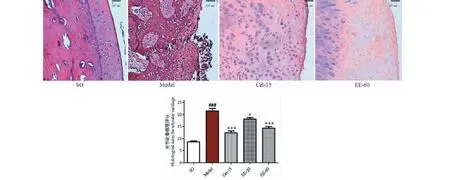
图3 EE对兔子关节软骨组织病理学的影响(HE,×100)Fig.3 Effect of EE on histopathology of articular cartilage of rabbits(HE,×100)注:与假手术组比较,###P<0.001;与模型组比较,*P<0.05,***P<0.001。Note:###P<0.001 vs SO group;*P<0.05,***P<0.001 vs model group.
滑膜HE染色结果:假手术组中显示:滑膜织无肥厚及增生,无血管侵入,无炎细胞浸润;模型组中显示:滑膜内衬细胞增生,排列杂乱,毛细血管及纤维组织增生,大量炎症细胞浸润。EE-20和EE-60治疗组中显示:滑膜细胞数量较模型组减少,轻度纤维组织增生,少量炎证细胞浸润。EE和Cel-15治疗组与模型组比较,治疗效果明显(P<0.001)。EE治疗后代表性滑膜组织病理图片及各组滑膜的病理评分见图4所示。

图4 EE对兔子滑膜组织病理学的影响(HE,×100)Fig.4 Effect of EE on histopathology of synovial membrane of rabbits(HE,×100)注:与假手术组比较,###P<0.001;与模型组比较,***P<0.001。Note:###P<0.001 vs SO group;***P<0.001 vs model group.
2.3 ELISA法测定EE对关节液中IL-1β、PGE2、MMP-3和MMP-9水平的影响
取兔子的关节液,采用ELISA检测方法,对关节液中IL-1β、PGE2、MMP-3和MMP-9的水平进行测定。检测结果分析显示:模型组动物关节液中IL-1β、PGE2、MMP-3和MMP-9的含量水平明显高于假手术组(P<0.001);EE-20、EE-60 mg/kg和Cel-15治疗组与模型组比较,均能明显降低关节液中IL-1β、PGE2、MMP-3和MMP-9的水平,其中EE-60和Cel-15治疗组与模型组比较,抑制作用显著(P<0.001),见图5A~D。
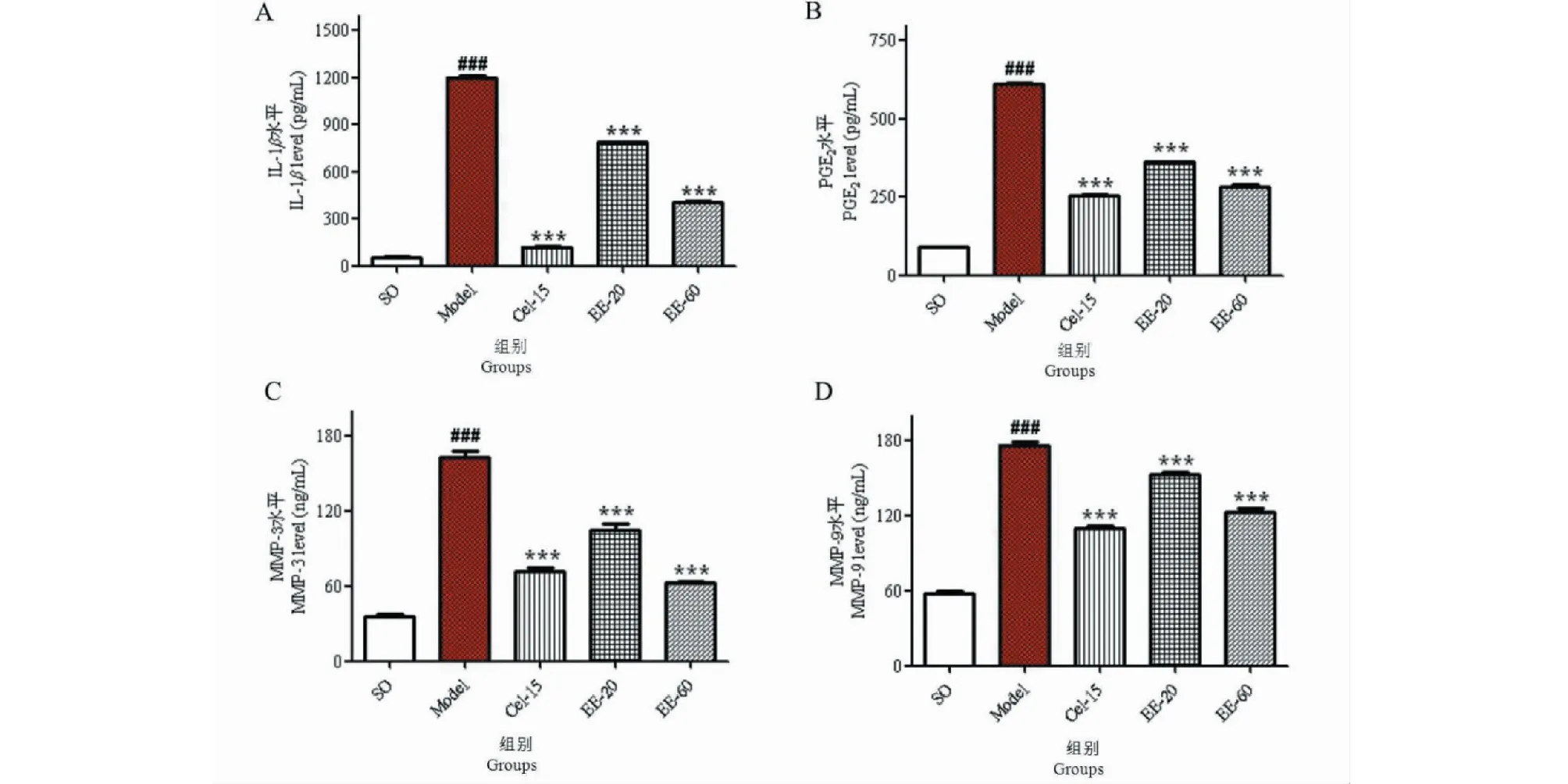
图5 EE对关节液中IL-1β(A)、PGE2(B)、MMP-3(C)和MMP-9(D)水平的影响Fig.5 Effect of EE on the levels of IL-1β (A)、PGE2 (B)、MMP-3 (C) and MMP-9 (D) in synovial fluid 注:与假手术组比较,###P<0.001;与模型组比较,***P<0.001。Note:###P<0.001 vs SO group;***P < 0.001 vs model group.
2.4 分子对接结果分析
分子对接实验显示,EE配体可结合于MMPs催化位点的凹槽中,并获得了对接的最佳构象,其中EE与MMP-3对接的最低自由能值为-8.2 kcal/mol;EE与MMP-9对接的最低自由能值为-7.5 kcal/mol,见图6所示(中心位置显示的紫色圆球为催化必须的Zn离子)。
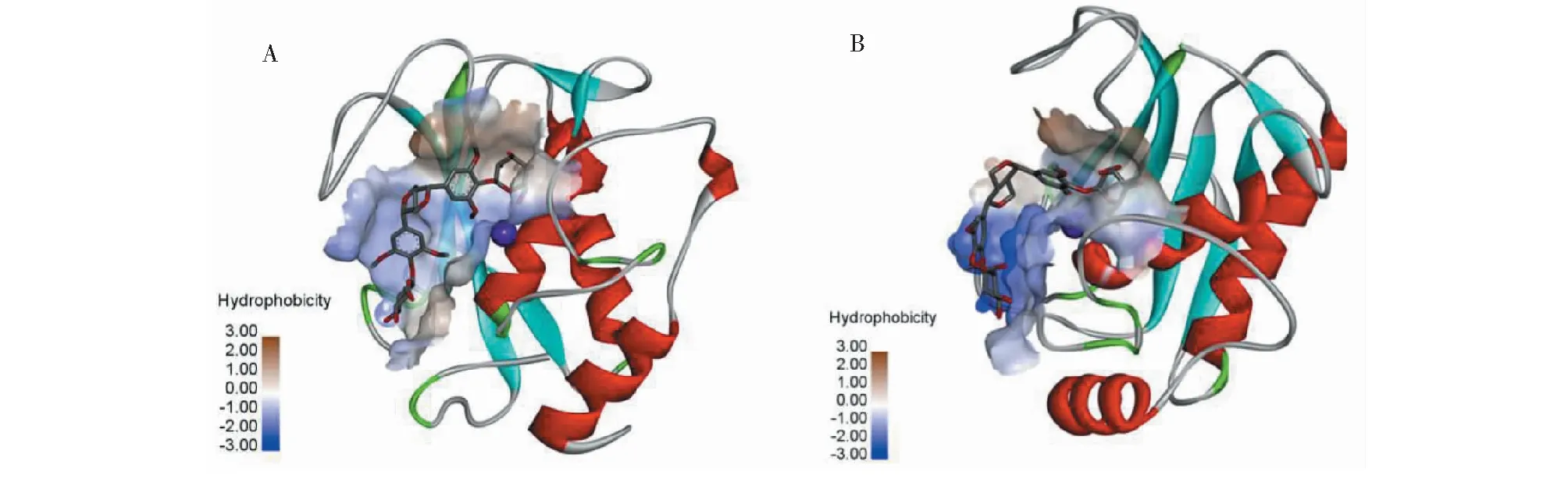
图6 分子对接最佳构象示意图Fig.6 Optimal conformation of molecular docking注:Zn离子由紫色圆球表示。A.EE与MMP-3对接的最佳构象;B.EE与MMP-9对接的最佳构象。Note:Zn ions are represented by purple spheres.A.Optimal conformation of molecular docking between EE with MMP-3;B.Optimal conformation of molecular docking between EE with MMP-9.
同时,EE配体糖环上的多个羟基可与MMP-3和MMP-9受体中的多个氨基酸(如His201侧链N、Ala189骨架N、Ser412骨架O、His411骨架O等)形成氢键,这些氢键对于配体的结合起到重要作用。此外,EE配体苯环可与MMP-3中(Tyr155、Phe86、Tyr168、Phe210、Val163)和MMP-9中(Leu188、Val398、Tyr423、Tyr420、Leu187)等疏水残基形成疏水堆积作用,亦可稳定其结合,见图7所示。
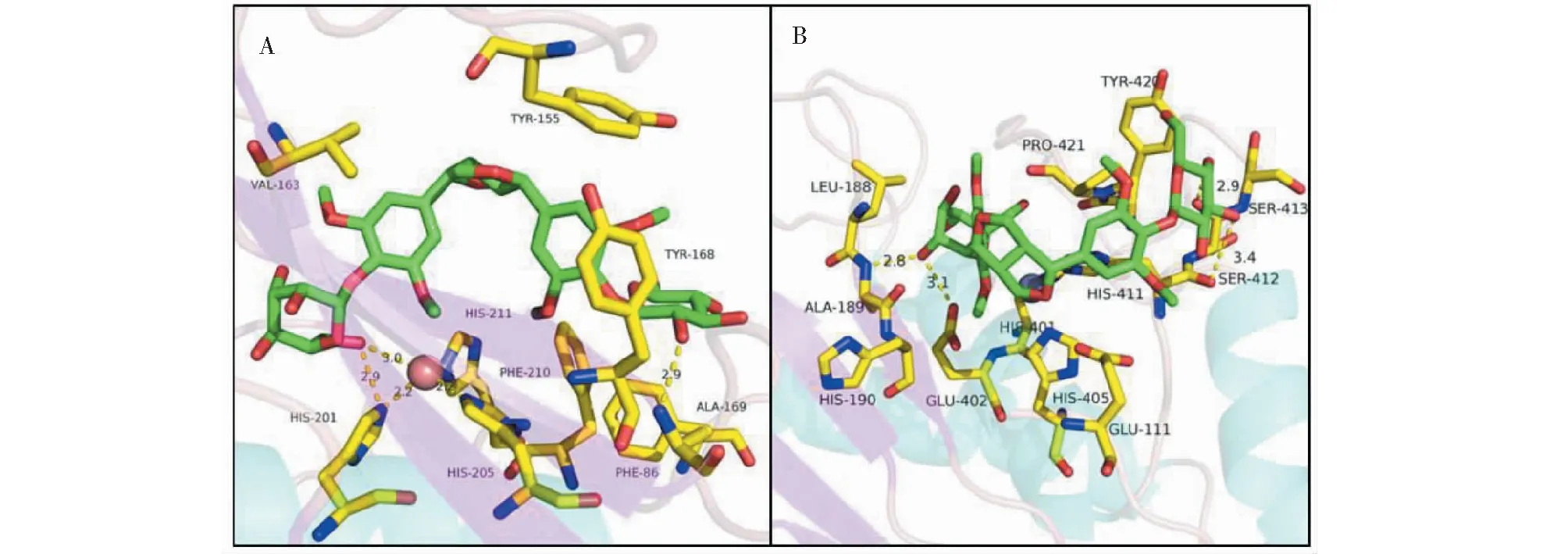
图7 EE与MMP-3(A)和MMP-9(B)残基间的相互作用图Fig.7 Interaction of EE with the active site residue of MMP-3 (A) and MMP-9 (B)
2.5 分子动力学模拟结果分析
进一步应用AmberTools 18.0软件进行分子动力学模拟实验,采取rmsd平衡之后的轨迹,基于MMGBSA方程计算配体EE与MMP-3和MMP-9的结合自由能。实验结果显示(见表1):EE与MMP-3的总结合自由能为-19.8 kcal/mol,EE与MMP-9的结总合自由能为-15.2 kcal/mol,相比较而言,EE与MMP-3的总结合能更低,表明EE与MMP-3结合能力更强,此结果与上述ELISA检测实验结果趋势基本一致。其中,在EE与MMP-3和MMP-9复合物结合的过程中,主要的贡献来源于范德华势能和静电作用,且两个体系具有相似的结合模式。此外,在整个分子动力学过程中,蛋白回旋半径曲线均较为平稳,稳定在15Å附近,蛋白整体结构紧凑,不存在松散、去折叠等情况。

表1 EE与MMP-3和MMP-9结合自由能分析Table 1 Binding free energy analysis of EE binding to MMP-3 and MMP-9
3 讨论与结论
关节软骨的基本组成成分为软骨基质、软骨细胞和水。软骨基质主要由蛋白多糖和胶原组成,软骨细胞是软骨基质分解代谢反应的主要来源,在正常的生理条件下,软骨成分的降解与合成之间保持动态平衡。骨性关节炎(OA)病变的发生主要是由于一些相关介质或因子引起了关节组织的骨、软骨、甚至关节内韧带和肌腱的细胞外基质(extracellular matrix,ECM)进行性破坏,导致关节软骨局部软化、磨损及结构损坏[11]。近年来有学者发现基质金属蛋白酶(matrix metalloproteinases,MMPs)与OA患者的骨关节损伤及病情活动密切相关,在关节软骨基质及软骨细胞破坏的病理过程中起着非常关键的作用[12]。MMPs是一种能够降解细胞外基质(ECM)的锌蛋白水解酶,几乎能降解ECM的所有成分,在骨性关节炎发生过程中,软骨细胞及滑膜细胞分泌过量的基质金属蛋白酶(MMP-3和MMP-9)[13],打破了基质金属蛋白酶-基质金属蛋白酶组织抑制因子(MMP-TIMP)的平衡,使ECM发生了不可逆的降解,导致关节软骨的肿胀、抗外力作用下降、关节内炎症反应加重,最终致使关节功能的丧失[14]。
MMPs过量表达导致的软骨破坏已经成为研究OA发病机理的热点之一,因此通过寻找MMPs抑制剂成为治疗OA药物研发的新策略。
中药是祖国医药宝库中的重要组成部分,由于其来源广泛、化学成分丰富、不良反应少,开发成新药易于人体接受的特点,越来越受到国内外研究学者的关注,目前尝试从中药筛选发掘针对疾病靶标的新型小分子治疗药物已经成为研究热点[15,16]。刺五加Acanthopanaxsenticosus(Rupr.et Maxim.) Harms又名五加参、刺拐棒,是一种名贵的药用植物,主产于中国的黑龙江、吉林、辽宁、河北、俄罗斯远东地区及日本北海道等地,在我国有着悠久的药用历史[17]。课题组前期研究发现eleutheroside E(EE)是刺五加中主要活性成分之一[18],目前关于EE的药理作用报道不多,主要为降低血糖、改善绝经后骨质疏松、抗中枢疲劳及记忆缺损、降低脑缺血再灌注损伤等方面[19-22]。我们前期研究发现EE可以明显抑制炎症因子和关节软骨破坏的情况,经文献检索调研,截至目前国际尚未见有关EE在OA治疗应用的研究报道。
因此,本文首次对EE治疗骨性关节炎作用进行了研究,从动物整体水平对EE在实验性兔膝骨性关节炎的治疗及保护作用进行评价,从而为EE防治骨性关节炎提供实验依据。本研究采用经典的前交叉韧带切断法(ACLT)建造兔膝骨性关节炎模型,通过关节腔注射的方法注射给予EE-20和EE-60进行治疗干预,每周给药1次,连续给药5周,研究其对兔膝骨关节炎模型的炎症细胞因子等指标以及关节病理学改变的影响,观察EE对兔膝骨关节炎动物模型的防治作用。实验结果显示EE能明显改善骨关节炎部位炎细胞浸润、纤维组织增生及软骨表层破坏等情况。有研究表明:MMP-3和MMP-9可以加快OA关节软骨结构中细胞外基质的损害,促进软骨破坏的速度,从而推进OA的进展过程。此外,IL-1β也是导致OA产生的关键因素,IL-1β可诱导滑膜细胞一氧化氮(NO)、环氧化酶(COX)的产生,而环氧化酶2又能够促进一氧化氮、前列腺素E2(PGE2)的分泌,而PGE2是一种多效性炎症介质,它能够增加MMPs和其他分解代谢物质的产生从而影响关节组织结构和功能,进而加速关节结构的破坏[23,24]。因此,我们进一步采用ELISA检测方法,对EE干预后OA模型动物关节液中炎症介质(IL-1β和PGE2)以及基质金属蛋白酶MMP-3和MMP-9的水平进行分析测定。结果显示:EE治疗干预后可以明显降低关节液中炎症介质(IL-1β和PGE2)以及基质金属蛋白酶MMP-3和MMP-9的水平(P< 0.001),表明EE具有明显抗骨性关节炎的作用。
目前,分子对接技术和分子动力学模拟已成为探索蛋白与受体结合方式的重要工具,在新药研究领域中具有的重要应用价值[25]。本研究进一步运用分子对接技术及分子动力学模拟手段,对EE与MMPs相互作用位点和结合方式进行了分析和探讨。研究结合于MMP-3和MMP-9催化位点的凹槽中,EE糖环上的羟基可与MMP-3和MMP-9受体中的氨基酸形成氢键,这些氢键对于配体的结合起到了重要作用。此外,EE配体苯环亦可与MMP-3和MMP-9中的疏水残基形成疏水堆积作用,亦可稳定其结合。分子动力学模拟实验表明,EE与MMP-3和MMP-9复合物结合过程中,主要贡献来源于范德华势能和静电作用,且两个体系具有相似的结合模式。其中,EE与MMP-3的总结合能更低,相比较而言,EE与MMP-3结合能力更强,此结果与上述ELISA检测实验结果的趋势基本一致。以上数据为今后研究EE抗MMPs的分子作用机制以及开发木脂素苷类母核结构新型MMPs抑制剂提供了关键的理论依据。
综上所述,关节腔注射EE可以明显改善骨关节炎部位炎细胞浸润、纤维组织增生及软骨表层破坏等情况,并降低关节液中炎症介质(IL-1β和PGE2)以及基质金属蛋白酶MMP-3和MMP-9的含量水平,表明EE具有明显抗骨性关节炎的作用。此外,进一步的分子对接技术和分子动力学实验发现,EE配体可结合于MMP-3和MMP-9催化位点的凹槽中,EE配体糖环上的多个羟基可与MMP-3和MMP-9受体中的多个氨基酸形成氢键,这些氢键对于配体的结合起到重要作用。本研究结果将为研发一种天然来源新型的骨性关节炎候选治疗药物奠定了基础。
