五环三萜类化合物微生物转化研究进展
2021-09-01赵子璇李春峰杨洪旺刘桂艳
赵子璇,李春峰,杨洪旺,刘桂艳
北京理工大学生命学院分子医学与生物治疗重点实验室,北京 100081
生物转化(bioconversion或biotransformation)是指在生物自身的作用或者体内活性酶的催化作用下,外源化合物发生了一定的生物化学反应,导致其结构发生变化,从而产生有价值的化合物的过程,又被称为生物催化(biocatalysis)。1864年,巴斯德发现醋酸杆菌能使乙醇转化为乙酸,从此拉开了人类开创微生物转化技术的序幕。20世纪50年代,研究人员利用黑曲霉(Rhizopusnigrican)将黄体酮转化为11α-羟基黄体酮,是生物转化史上的重要里程碑[1]。
生物转化相对于化学转化,具有绿色环保、高效的催化效率、温和的反应条件、简单的后续处理等优点,往往可以实现糖基化反应等化学转化中不易实现的转化,达到增强生物活性、降低毒性、提高生物利用度等目的。特别是生物转化具有较高的区域选择性和立体选择性,也有较多的反应类型,如氧化反应、还原反应、水解反应、缩合反应、羟基化反应、胺化反应、环化反应、酰化反应、脱羧化、甲基化与去甲基化反应和脱氢反应等等,更易得到结构新颖的化合物,为新药开发提供更有价值的先导化合物。然而,在种类繁多的微生物中筛选有效转化的菌株就目前而言仍然是一个巨大的挑战。
五环三萜类化合物主要存在于陆地高等植物中,分为3种结构类型,即乌苏烷型、齐墩果烷型和羽扇豆烷型。研究报道该类化合物具有抗癌、抗糖尿病、抗病毒、抗菌和抗氧化等多种生物活性[2]。虽然很多药材中含有五环三萜类化合物,但往往存在含量偏低、活性低或者毒性大的局限。通过生物转化,可以把五环三萜类化合物转化为高活性低毒性的更有价值的有效成分或者结构新颖的先导化合物,为进一步结构改造和新药开发奠定基础。
1 五环三萜类化合物生物转化
1.1 齐墩果烷型
1.1.1 齐墩果酸
齐墩果酸(oleanolic acid,OA,1),又被称为土当归酸,其化学名为3β-hydroxy-olean-12-en-28-oic acid,其化学分子式为C30H48O3,分子量为456.70。齐墩果酸不仅具有三萜酸常见的抗肿瘤、抗糖尿病和抗炎等药理活性,还可以抗口腔病原菌、调血脂、抗肥胖[3]、保护血管[4]、保护神经、抗肝脂肪病变和纤维化[5]等。
齐墩果酸在亚麻刺盘孢霉(ColletotrichumliniAS3.448,a)[6]作用下C15位发生了羟基化反应,生成15α-hydroxyl-oleanolic acid(2),相同的反应类型在粉红单端孢霉(Trichotheciumroseum,g)[7]和蝇卷霉(CircinellamuscaeAS 3.2695,i)[8]也有报道。在长柄链格孢菌(Alternarialongipes,b)[9]中发生了C2位和C19位的羟基化反应,C3位和C28位的糖基化反应,同时,母核骨架齐墩果烷变为熊果烷,C19位增添了甲基,共生成了6种化合物:2α,3α,19α-trihydroxy-ursolic acid-28-O-β-D-glucopyranoside(3)、2α,3β,19α-trihydroxy-ursolic acid-28-O-β-D-glucopyranoside(4)、oleanolic acid 28-O-β-D-glucopyranosyl ester(5)、oleanolic acid-3-O-β-D-glucopyranoside(6)、3-O-(β-D-glucopyranosyl)-oleanolic acid-28-O-β-D-glucopyranoside(7)和2α,3β,19α-trihydroxy-oleanolic acid-28-O-β-D-glucopyranoside(8)。化合物5在赭曲霉(AspergillusochraceusCICC 40330,h)[10]中也有发现。在阿达青霉(Penicilliumadametzi,c)[9]中,发生了C7和C21位羟基化反应和C28位的糖基化反应,生成21β-hydroxyl oleanolic acid(9)、7α,21β-dihydroxyl oleanolic acid(10)和21β-hydroxyl oleanolic acid-28-O-β-D-glucopyranoside(11)。化合物6、9、10和11对宫颈癌细胞(Hela)的杀伤活性强于齐墩果酸。在鲁氏毛霉(MucorrouxiiNRRL 1894,d)[11]中,齐墩果酸也发生了C7和C21位羟基化反应,转化生成3β,7β,21β-trihydroxyolean-12-en-28-oic acid(12),C3位发生羰基化反应生成7β-hydroxy-3-oxo-olean-12-en-28-oic acid(13)、21β-hydroxy-3-oxo-olean-12-en-28-oic acid(14)和7β,21β-dihydroxy-3-oxo-olean-12-en-28-oic acid(15)。其中,化合物14可以抑制牙龈卟啉单胞菌的活性。Zhu等[10]发现在灰色链霉菌(StreptomycesgriseusATCC 13273,e)中,齐墩果酸的C29位的甲基被氧化成羧基,生成3β-dihydroxy-olean-12-en-28,29-dioic acid(16),同时C24位发生羟基化生成3β,24-dihydroxy-olean-12-en-28,29-dioic acid(17)。Martinez等[12]发现在米黑根毛霉(RhizomucormieheiCECT 2749,f)中齐墩果酸主要发生羟基化反应,集中在C1、C7和C30位上,生成3β,30-dihydroxyolean-12-en-28-oic acid(18)、3β,7β,30-trihydroxyolean-12-en-28-oic acid(19)和1β,3β,30-trihydroxyolean-12-en-28-oic acid(20)。在粉红单端孢霉(g)[7]中发生了C7位、C15位羟基化和C3位羰基化,生成15α-hydroxy-3-oxo-olean-12-en-28-oic acid(21)和7β,15α-dihydroxy-3-oxo-olean-12-en-28-oic acid(22)。在蝇卷霉(i)[8]中齐墩果酸C7、C15和C21位上发生羟基化,C3位发生羰基化和C28位发生糖基化生成已有化合物5、10、11、12和13以及新化合物7β,15α-dihydroxy-3-oxo-olean-12-en-28-oic acid(23)、3β,7β,15α-trihydroxyolean-12-en-28-oic acid(24)和3β,7β,15α-trihydroxyolean-12-en-28-oic acid-28-O-β-D-glucopyranosyl ester(25),生成的9种化合物均能抑制NO产生,其中化合物23、24和25对NO的抑制作用大于阳性对照。由此可见,C7位羟基化和C28位糖基化得到的化合物的抗炎活性强于在C21位羟基化。Xu等[13]研究了串联全细胞生物转化技术,先在华根霉(RhizopuschinensisCICC 40335,j)中转化齐墩果酸生成化合物12,接着通过枯草芽孢杆菌(BacillussubtilisATCC 6633,k)在化合物12的C3位增加了糖基,生成3-O-β-D-glucopyranosyl-7β,21β-dihydroxyloleanolic acid(26)。化合物12在灰色链霉菌(e)中C29位发生了羟基化和羧酸化,生成新化合物3β,7β,21β,29-tetrahydroxy-olean-12-en-28-oic acid(27)和3β,7β,21β-trihydroxy-olean-12-en-28,29-dioic acid(28),其中,化合物28具有显著神经保护作用[13]。齐墩果酸生物转化途径及其衍生物化学结构见图1。
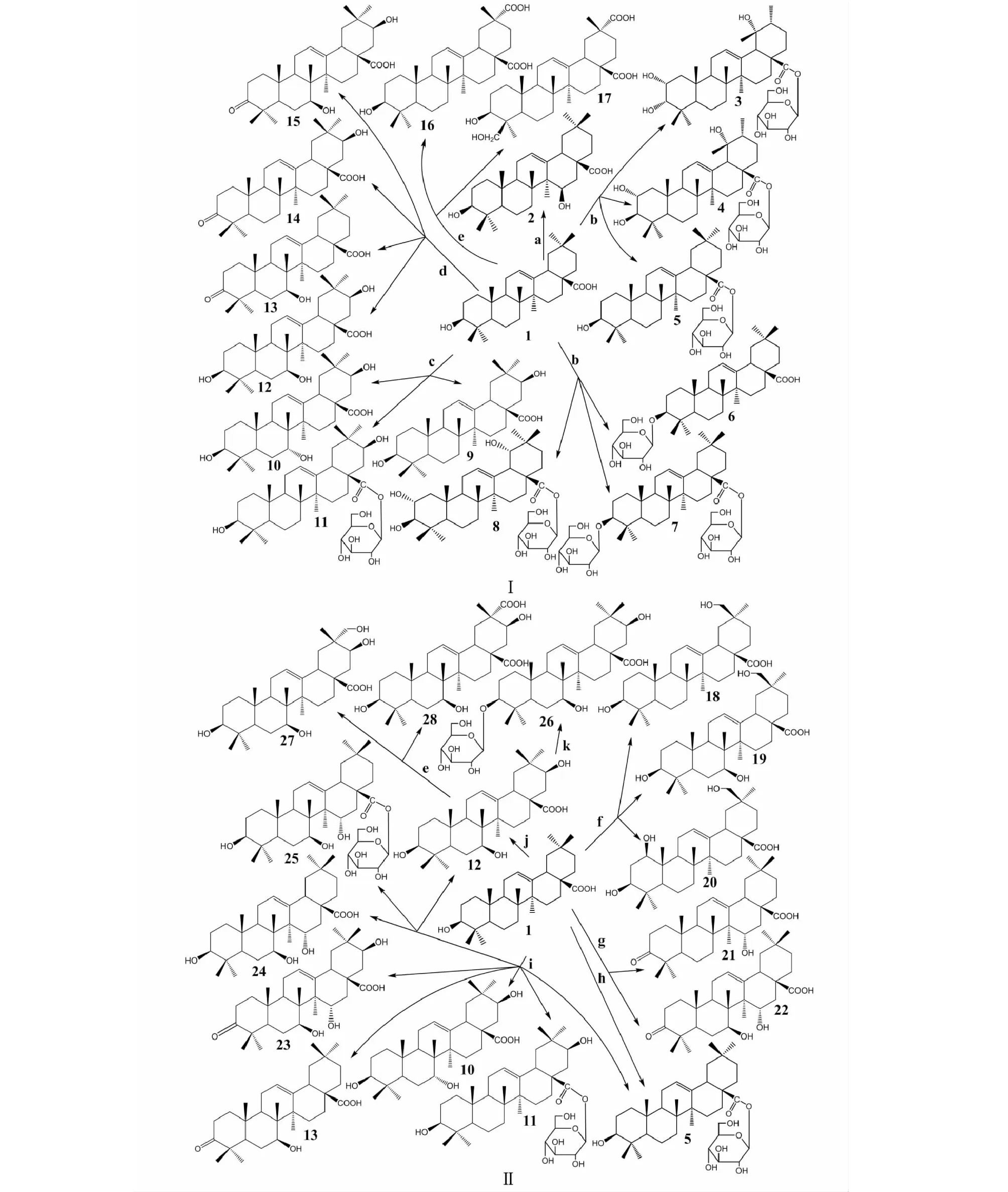
图1 齐墩果酸的生物转化途径及其衍生物化学结构Fig.1 Biotransformation pathway of oleanolic acid and chemical structure of oleanolic acid derivatives
1.1.2 甘草酸
甘草酸(glycyrrhizic acid,GL,29),又被称为甘草甜素,其化学名为3β-glcA1-2glcA-11-oxo-urs-12-en-30-oic acid,化学分子式为C42H62O16,分子量822.93。甘草酸不仅是一种天然的食品甜味剂,还具有多种药效活性,如:抗炎、抗过敏、抗病毒、抗哮喘以及增强免疫功能等,在临床上用于治疗肝炎、气管炎、胃溃疡和皮肤病等疾病[14],尤其可以作为一种辅助治疗手段,减轻新型冠状病毒(COVID-19)重症患者的炎症反应[15]。甘草酸带有两分子葡萄糖醛酸,极性大,不易被透膜吸收,生物利用度低,可以通过水解掉葡萄糖醛酸来提高生物利用度。然而化学方法转化对两个糖苷键水解选择性不强[16],但在生物转化领域上,通过β-D-葡萄糖醛酸苷酶作用于糖苷键,可以水解掉一个或两个葡萄糖醛酸,生成单葡萄糖醛酸甘草次酸(3-O-mono-β-D-glucuronide,GAMG,30)或甘草次酸(glycyrrhetic acid,GA,31)。
笔者所在课题组[17]发现甘草酸在土曲霉(AspergillusterreusLi-20,w)中既可以转化生成单葡萄糖醛酸甘草次酸也可以生成甘草次酸;在焦曲霉(AspergillusustusLi-62,p)中只转化生成甘草次酸;在产紫青霉(PenicilliumpurpurogenumLi-3,l)中只转化生成单葡萄糖醛酸甘草次酸;在最近的研究中发现,我们发现褐红篮状菌(TalaromycespinophilusLi-93,v)[18]能够转化甘草酸生成单葡萄糖醛酸甘草次酸,并分离其中的β-D-葡萄糖醛酸苷酶,将其编号为TpGUS79A。也有学者研究报道在黑曲霉(Aspergillussp:CPCC480386,m)[19]、球毛壳菌(Chaetomiumglobosum,n)[20]、蓝状菌(Talaromycessp.02,o)[21]中转化甘草酸只生成单葡萄糖醛酸基甘草次酸,其中最高转化产率达98.68%。在大肠杆菌(EscherichiacoliMTCC 1652,q)[22]、米曲霉(Aspergillusoryzae,r)[23]、鼠乳杆菌(Lactobacillusmurinus,s)、嗜酸乳杆菌(Lactobacillusacidophilus,t)和鼠李糖乳杆菌(Lactobacillusrhamnosus,u)[24]转化甘草酸只生成甘草次酸,最高转化产率达到76.7 %。由此看来,不同微生物来源的β-D-葡萄糖醛酸苷酶的对糖苷键具有选择性水解作用,但导致选择性水解的原因还有待进一步研究。甘草酸的生物转化途径及其衍生物化学结构见图2。
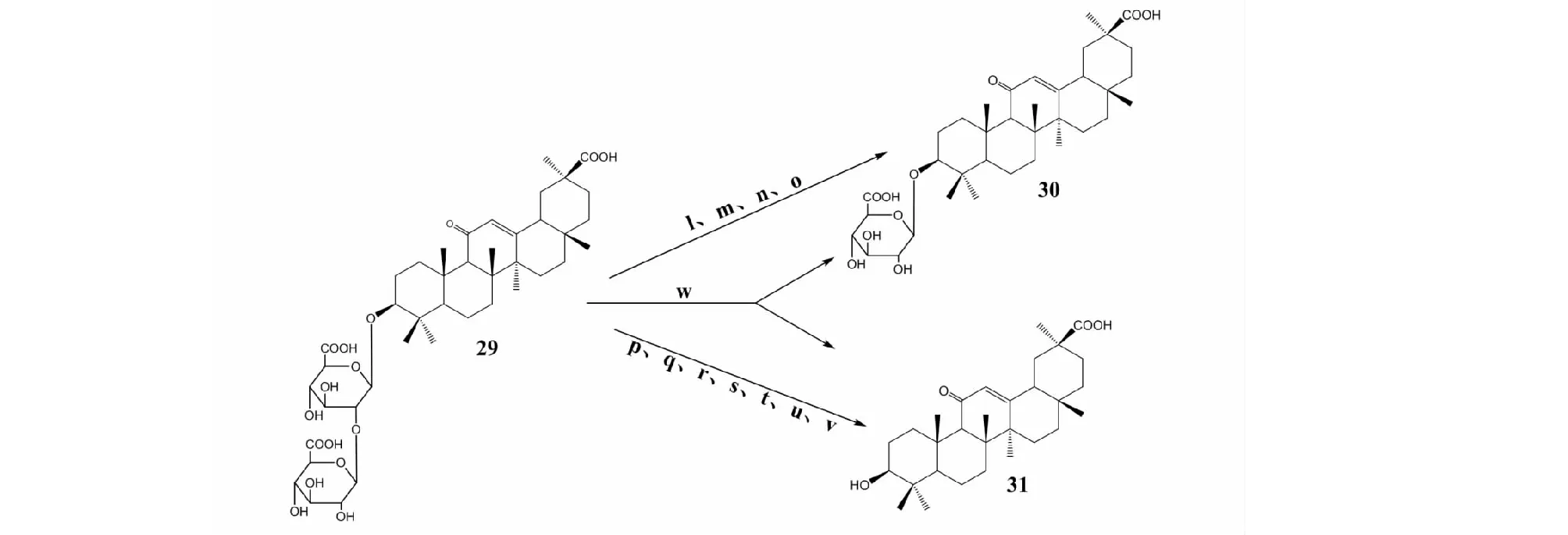
图2 甘草酸的生物转化途径及其衍生物结构Fig.2 Biotransformation pathway of glycyrrhizic acid and chemical structure of glycyrrhizic acid derivatives
1.1.3 甘草次酸
C7位羟基化是甘草次酸生物转化中最常见的反应类型,在新月弯孢霉(CurvariacrescentKA-91,x)[25]、华根霉(RhizopuschinensisCICC 40335,j)[13]、短刺小克银汉霉(CunninghamellablakesleeanaCGMCC 3.970,y)[26]、刺孢小克银汉霉(CunninghamellaechinulataATCC 8688a,z)[27]、无根根霉(RhizopusarrhizusAS 3.2893,A)[28]和蝇卷霉(i)[28]中均有7β-hydroxyl-18β-glycyrrhetinic acid(32)生成。在无根根霉(A)[28]和多型孢毛霉(Mucorpolymorphosporus,B)[29]中可以生成异构体7α-hydroxy-18β-glycyrrhetinic acid(33)。另外,在多型孢毛霉(B)[29]中,甘草次酸的C3位发生羰基化反应,C6、C7、C24和C27位发生羟基化反应生成6β,7β-dihydroxyglycyrrhentic acid(34)、27-hydroxyglycyrrhentic-acid(35)、24-hydroxyglycyrrhentic acid(36)和3-oxo-7β-hydroxyglycyrrhentic acid(37)。在刺孢小克银汉霉(z)[27]中,甘草次酸的C1和C15位发生羟基化反应,C7和C27位酯化成环,生成15α-hydroxy-18β-glycyrrhetinic(38)、15α-hydroxy-18α-glycyrrhetinic acid(39)、13β-hydroxy-7α,27-oxy-12-dihydro-18β-glycyrrhetinic acid(40)和1α-hydroxy-18β-glycyrrhetinic acid(41)。在假柱孢梨头霉(AbsidiapseudocylinderosporaATCC 24169,C)[27]中,C7和C15位发生羟基化反应生成7β,15α-dihydroxy-18β-glycyrrhetinic acid(42)。在绿色粘帚霉(GliocladiumvirideATCC 10097,D)[27]中,C3位发生羰基化反应生成3-oxo-18β-glycyrrhetinic acid(43)。在短刺小克银汉霉(y)[26,30]中甘草次酸的C3位羰基化,C7和C15位羟基化生成3-oxo-15α-hydroxy-18β-glycyrrhetinic acid(44)、3-oxo-15β- hydroxy-18β-glycyrrhetinic acid(45)、3-oxo-7β,15α-dihydroxy-18β-glycyrrhetinic acid(46)、化合物37、38和42。后又发现在短刺小克银汉霉(y)[31]中,C24位也能发生羟基化反应生成15α,24-dihydroxyglycyrrhetinic acid(47)、3-oxo-15α,24-dihydroxyglycyrrhetinic acid(48)、3-oxo-7β,24-dihydroxyglycyrrhetinic acid(49)、3-oxo-7β,15α,24-trihydroxy-glycyrrhetinic acid(50)和3-oxo-7α,24-dihydroxyglycyrrhetinic acid(51)。Fan等[28]在无根根霉(A)中转化甘草次酸的C7位羰基化和C15位羟基化生成7-oxo-18β-glycyrrhetinic acid(52)和7-oxo-15α-hydroxy-18β-glycyrrhetinic acid(53)。在蝇卷霉(i)[28]中,C7和C15位发生羟基化反应,C3和C30位发生糖基化反应,生成7β-hydroxyl-18β-glycyrrhetinic acid-3-O-β-D-glucoside(54)、7β-hydroxyl-18β-glycyrrhetinic acid-30-O-β-D-glucoside(55)和15α-hydroxyl-18β-glycyrrhetinic acid-3-O-β-D-glucoside(56)。另外,C3位连接的葡萄糖羟基还可以发生乙酰化反应生成7β-hydroxyl-18β-glycyrrhetinic acid-3-O-β-D-6′-O-acetyl-glucoside(57)和15α-hydroxyl-18β-glycyrrhetinic acid-3-O-β-D-6′-O-acetyl-glucoside(58)。枯草芽孢杆菌(k)[13,32]可转化甘草次酸的C3和C30位发生糖基化反应,生成30-O-β-D-glucopyranosyl glycyrrhetinic acid(59)和3-O-(β-D-glucopyranosyl)glycyrrhetinic acid-30-O-β-D-glucopyranoside(60)。笔者所在课题组[33]进一步将枯草芽孢杆菌中UGT酶在大肠杆菌(Escherichiacoli,E)中重组表达,生成GA-3-O-β-D-glucoside(61)和GA-30-O-β-D-glucoside(59),并证明对乳腺癌细胞(MCF-7)和人肝癌细胞(HepG2)的细胞毒活性比GA和GL高,化合物61对金黄色葡萄球菌和枯草芽孢杆菌的抗菌活性比GA高。甘草次酸的生物转化途径及其衍生物化学结构见图3。
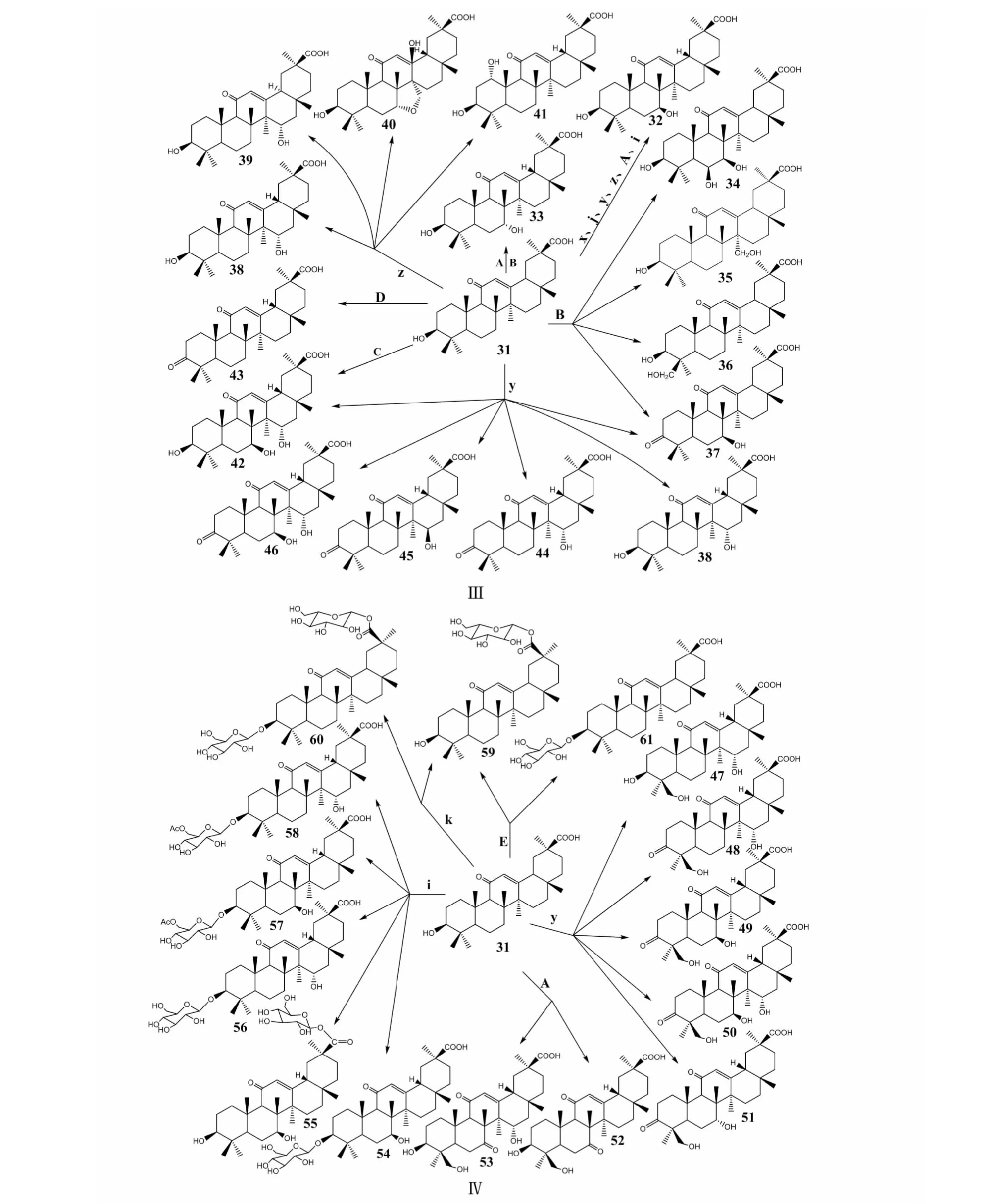
图3 甘草次酸的生物转化途径及其衍生物结构Fig.3 Biotransformation pathway of glycyrrhetic acid and chemical structure of glycyrrhetic acid derivatives
1.2 乌苏烷型
熊果酸(ursolic acid,UA,62),又名乌索酸、乌苏酸[34],其化学名3β-hydroxy-urs-12-en-28-oic acid,化学分子式为C30H48O3,分子量为456.71。熊果酸在抗癌、抗糖尿病中均起重要作用,被誉为抗癌治疗中最有希望的药物[35]。熊果酸衍生物的开发不仅可以弥补熊果酸低溶解性、低渗透性的不足,还可以提高口服利用度[36]。
在深黄伞形霉(Umbelopsisisabelline,F)[37]中,熊果酸的C1位和C7位发生羟基化反应,C11位和C12位发生脱氢氧化反应,C13位和C28位发生酯化反应生成3种化合物:3β-hydroxy-urs-11-en-28,13-lactone(63)、3β,7β-dihydroxy-urs-11-en-28,13-lactone(64)和1β,3β-dihydroxy-urs-11-en-28,13-lactone(65);在小孢拟盘多毛孢(Pestalotiopsismicrospora,G)[38]中,熊果酸的C4位、C15位和C30位发生羟基化反应,C3位发生羰基化反应生成3-oxo-15α,30-dihydroxy-urs-12-en-28-oic acid(66)、3β,15α-dihydroxy-urs-12-en-28-oic acid(67)和3β,15α,30-trihydroxy-urs-12-en-28-oic acid(68),C3位也会发生羧化反应生成3,4-seco-ursan-4,30-dihydroxy-12-en-3,28-dioic acid(69)4种化合物。Huang等[39]在此基础上发现在总状共头霉(SyncephalastrumracemosumAS 3.264,H)中C21位也可以发生羟基化和羰基化反应,C11位、C26位发生环氧化反应,共生成5种化合物:3β,21β-dihydroxy-urs-11-en-28-oic acid-13-lactone(70)、3β,7β,21β-trihydroxy-urs-11-en-28-oic acid-13-lactone(71)、1β,3β-dihydroxy-urs-12-en-21-one-28-oic acid(72)、1β,3β,21β-trihydroxy-urs-12-en-28-oic acid(73)和11,26-epoxy-3β,21β-dihydroxyurs-12-en-28-oic acid(74),其中,化合物72对蛋白酪氨酸磷酸酶(PTP1B)有抑制活性。付少彬等[40]在总状共头霉(SyncephalastrumracemosumCGMCC 3.2500,I)发现生成了新化合物3β,7β,21β-trihydroxy-urs-12-en-28-oic acid(75)。研究表明,在链格孢菌(AlternariaalternataAS 3.577,J)[41]、梅林青霉(PenicilliummeliniiAS3.4474,K)[42]和巨大芽孢杆菌(BacillusmegateriumCGMCC 1.1741,L)[43]中改变了C3位结构,发生羰基化反应生成3-oxo-urs-12-en-28-oic acid(76),在梅林青霉(K)[42]中还发生了C3位和C28位糖基化得到3-O-β-D-吡喃葡萄糖熊果酸酯(77)和28-O-β-D-吡喃葡萄糖熊果酸酯(78),在巨大芽孢杆菌(L)[43]中,C1位、C11位发生羟化反应,C13位、C28位发生酯化反应,C28发生糖基化反应,得到1β,11α-dihydroxy-3-oxo-urs-12-en-28-oic acid(79)、1β,3β,11α-trihydroxyurs-12-en-28oic acid(80)、1β,11α-dihydroxy-3-oxo-urs-12-en-28-O-β-D-glucopyranoside(81)和1β-hydroxy-3-oxo-urs-12-en-28,13-lactoe(82),这些衍生物对一氧化氮的抑制作用强于UA[43]。在长柄链格孢菌(AlternarialongipesAS3.2875,M)[44]中,C28位糖基基化得到化合物78,后续Zhang等[45]在同一菌株种发现C3位糖基化和羰基化,C2位和C21位羟基化,得到了化合物77、3-carbonyl-ursolic acid 28-O-β-D-glucopyranosyl ester(83)、2α,3β-dihydroxy ursolic acid 28-O-β-D-glucopyranosyl ester(84)、3β,21β-dihydroxy ursolic acid 28-O-β-D-glucopyranosyl ester(85)和3-O-(β-D-glucopyranosyl)-ursolic acid 28-O-(β-D-glucopyranosyl) ester(86)。在灰色链霉菌(Streptomycesgriseussubsp.griseus 4.18,N)[46]和链格孢菌(AlternariaalternataATCC 34509,O)[47]中C2位发生羟基化生成科罗索酸(87)。另外在链格孢菌(O)中,C23位、C24位也会发生羟基化,C28位羧酸被还原成羟甲基,生成urs-12-en-2α,3β,28-triol(88)、3β,23-dihydroxyurs-12-en-28-oic acid(89)、2α,3β,23-trihydroxyurs-12-en-28-oic acid(90)、2α,3β,23,24-tetrahydroxyurs-12-en-28-oic acid(91)、3β,28-dihydroxy-12-ursene(92)、urs-12-en-3β-ol(93)和urs-12-en-2α,3β-diol(94),其中化合物87、90和91对乳腺癌(MCF-7、MDA-MB-231)、结肠癌(Caco-2)和肝癌(HepG2)细胞抗增殖活性增强[47]。粉红粘帚霉(GliocladiumroseumCGMCC 3.3657,P)[48]催化熊果酸C21位羟基化和羰基化,C3位和C28位酯化和羧酸化,C4和C23脱氢氧化,生成21-oxo,A-homo-3α-oxa-urs-12-en-3-one-28-oic acid(95)、21-oxo-3,4-seco-ursan-4(23),12-dien-3,28-dioic acid(96)、21β-hydroxyl-A-homo-3α-oxa-urs-12-en-3-one-28-oic acid(97)、21β-hydroxyl-3,4-seco-ursan-4(23),12-dien-3,28-dioic acid(98),并证明C21的酮基可能有助于阻止丙型肝炎病毒的入侵。Zhang等[49]利用刺囊毛霉(MucorspinosusAS 3.3450,Q)使C7位和C21位羟基化,C28位羧酸的羟基被甲基化,C3位糖基化得到化合物75、3β,7β-dihydroxy-ursolic acid-28-etha-none(99)和3β,21β-dihydroxy-ursolic acid-3-O-β-D-glucopyranoside(100)。与UA相比,化合物99对Hela细胞、K562细胞和KB细胞株具有更强的细胞毒活性。熊果酸的生物转化途径及其衍生物结构见图4。
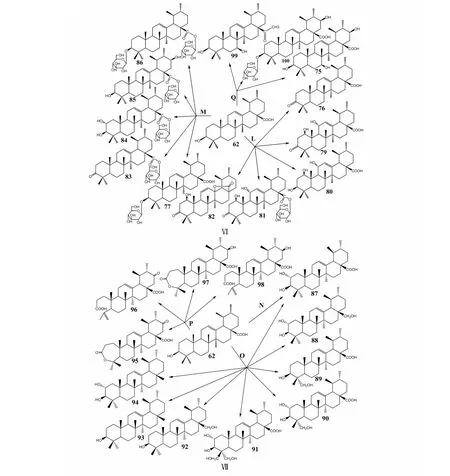
图4 熊果酸的生物转化途径及其衍生物结构Fig.4 Biotransformation pathway of ursolic acid and chemical structure of ursolic acid derivatives
1.3 羽扇豆烷型
白桦脂酸(betulinic acid,BA,101),也叫桦木酸,其化学名为3β-hydroxy-lup-20(29)-en-28-oic acid,其化学分子式为C30H48O3,分子量为456.7。白桦脂酸也具有抗癌、抗炎和抗氧化等方面的活性。与其他五环三萜类化合物相比,白桦脂酸在抑制黑色素瘤和抗艾滋病毒方面上发挥着举足轻重的作用。白桦脂酸衍生物的抗HIV临床实验也已经进行到Ⅱ期阶段,美国癌症研究所NCI已将其列入快速研发规划项目(RAID)[50]。白桦脂酸已成为研发新药方面最具潜力的先导化合物之一。
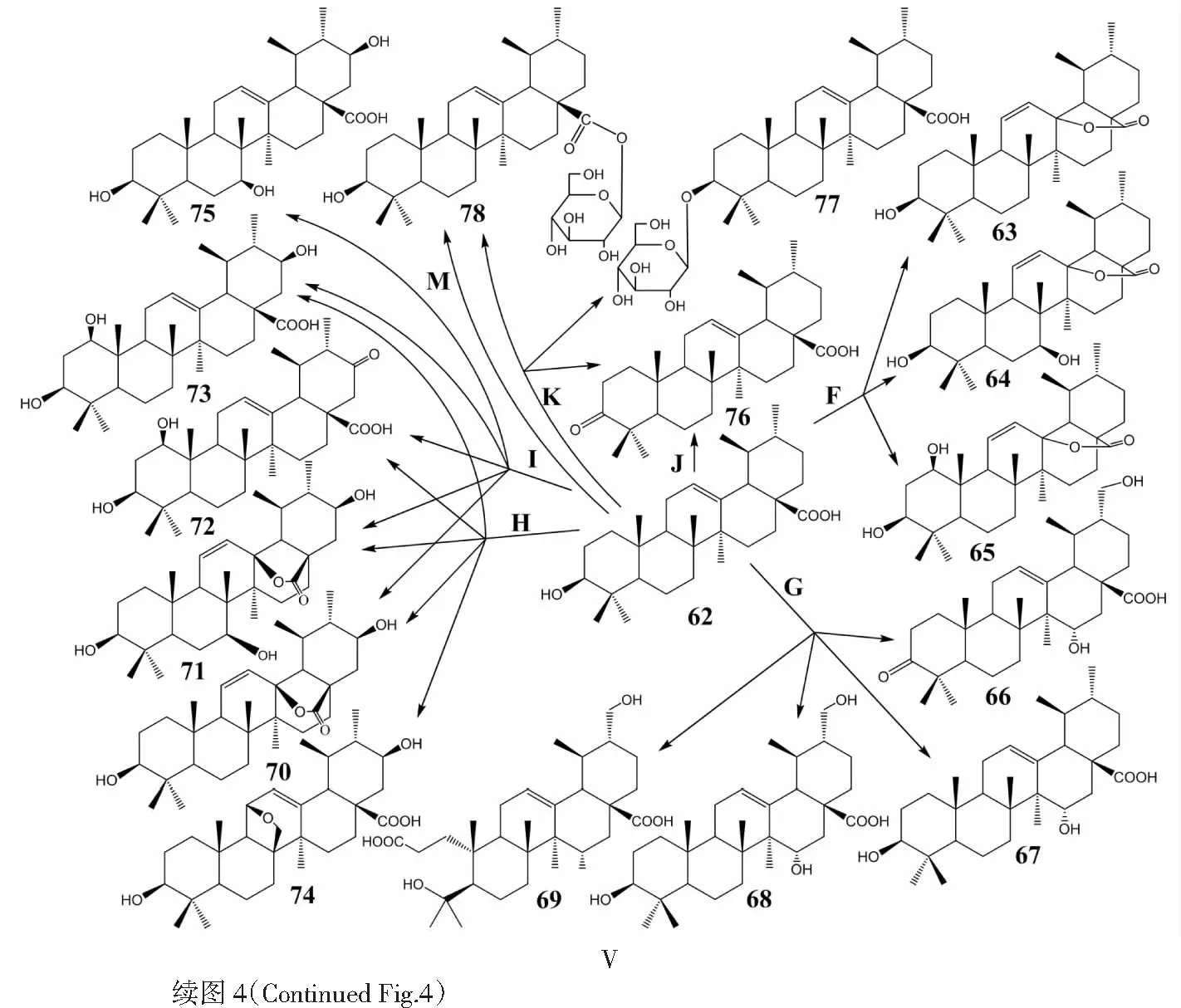
Goswami等[51]发现白桦脂酸在巨大芽孢杆菌(BacillusmegateriumSC16644,R;BacillusmegateriumSC6394,S)、脆弱链霉菌(StreptomycesfragilisSC16401,T)、雅致小克银汉霉(CunninghamellaelegansSC16025,U)、土曲霉(AspergillusterreusSC16513,V)改变了原有结构。在芽孢杆菌(R)[51]中,C7、C15、C23位发生羟基化,C3发生羰基化,生成3种衍生物:3β,7β,15α-trihydroxy-lup-20(29)en-28-oic acid(102)、3β,7β,15α,23-tetrahydroxy-lup-20(29)en-28-oic acid(103)和7β,15α-dihydroxy-3-oxo-lup-20(29)en-28-oic acid(104)。在芽孢杆菌(S)[51]中,C15、C23位未发生变化,C30位结构既会发生羟基化反应,也会发生羰基化反应,生成3,30-dioxo-lup-20(29)en-28-oic acid(105)、7β-hydroxy-3,7-dioxo-lup-20(29)en-28-oic acid(106)和3-oxo-30-hydroxy-lup-20(29)en-28-oic acid(107)。在脆弱链霉菌(T)[51]中,C2位结构改变,转化生成2α,3β,7β-trihydroxy-lup-20(29)en-28-oic acid(108)、2-oxo-3β,7β-dihydroxy-lup-20(29)en-28-oic acid(109)和3-oxo-7β-hydroxy-lup-20(29)en-28-oic acid(110)。在雅致小克银汉霉(U)[51]中,C25位发生羟基化反应,生成3β,25-dihydroxy-lup-20(29)en-28-oic acid(111)。在土曲霉(V)[51]中,白桦脂酸A环发生裂解,C3位发生羧酸化,C4位发生羟基化和脱氢反应,生成4-hydroxy-3,4-seco-lup-20(29)-en-3,28-dioic acid(112)和3,4-seco-lup-20(29),4(23)-dien-3,28-dioic acid(113)。Wang等[52]也研究了枯草芽孢杆菌(k)中白桦脂酸的生物转化反应,在C3、C28位连接了糖基,同时C23位也发生了羟基化反应,生成28-O-β-D-glucopyranosyl betulinic acid(114)、3-O-(β-D-Glucopyranosyl)-betulinic acid-28-O-β-D-glucopyranoside(115)、23-hydroxy-betulinic acid(116)和23-hydroxy-28-O-β-D-glucopyranosyl betulinic acid(117),化合物117抑制促凝活性强于BA。在解淀粉芽孢杆菌(BacillusamyloliquefaciensFJ18,W)[53]中,白桦脂酸C28位发生糖基化反应,生成3β-hydroxy-lup-20(29)-en-28-oic acid 28-O-(4-oxy-4-oxobutanoic acid-4-O-β-D-glucopyranosyl)ester(118)和28-O-β-D-glucopyranosyl-3β-hydroxy-lup-20(29)-en-28-oate(119),C28位引入糖基对A375 、Hela 、U251 、SH-SY5Y 和MCF-7的细胞毒活性均强于BA,但4-oxy-4-oxobutanoic acid的引入却稍微降低了细胞毒活性。在蝇卷霉(i)[54]中,C7、C15、C21位发生羟基化反应,C3和C21 位发生羰基化反应,生成化合物102、104和3β,7β,15α,21β-tetrahydroxy-lup-20(29)-en-28-oic acid(120)、3β,7β,21β-trihydroxy-lup-20(29)-en-28-oic acid(121)、3β,7β-dihydroxy-21-oxo-lup-20(29)-en-28-oic acid(122)、7β,21β-dihydroxy-3-oxo-lup-20(29)-en-28-oic acid(123)和3β,7β-dihydroxy-lup-20(29)- en-28-oic acid(124)。在刺孢小克银汉霉(y)[54]中,C1、C7、C21和C26位发生羟基化反应,生成化合物121、化合物124、1β,3β,26-trihydroxy-lup-20(29)-en- 28-oic acid(125)、1β,3β-dihydroxy-lup-20(29)-en-28-oic acid(126),另外C1位同时发生了乙酰化反应,生成3β,7β-dihydroxy-1-O-acetyl-lup-20(29)-en-28-oic acid(127)。化合物102、120、121、122、124、125、126和127均对NO有抗炎活性,且化合物120、121和126对NO的抗炎活性强于BA。白桦脂酸的生物转化途径及其衍生物结构见图5。
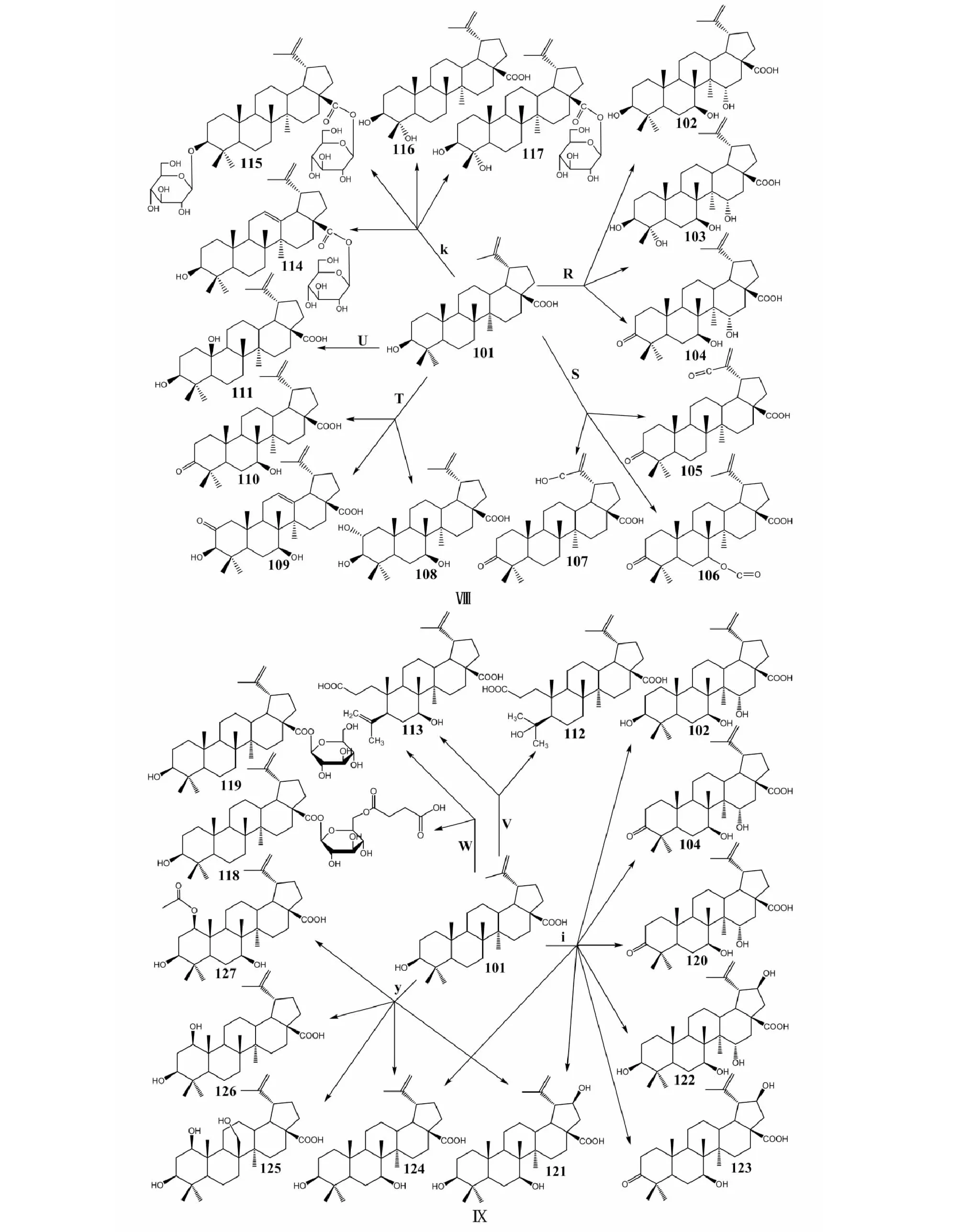
图5 白桦脂酸的生物转化途径及其衍生物结构Fig.5 Biotransformation pathway of betulinic acid and chemical structure of betulinic acid derivatives
2 总结及展望
从上述研究中不难看出,微生物转化可以将天然有机化合物转化成多种多样的衍生物,能够为生物活性筛选提供更多结构新颖的化合物,进而开发新药。能够进行生物转化的微生物种类繁多,其中真菌用于五环三萜类化合物生物转化研究最多,尤其是霉菌,反应类型包括羟基化、羰基化、水解、羧酸化、糖基化、还原、脱氢氧化和乙酰化等多种类型。在真菌中,羟基化反应最常发生在C7、C15和C21位上,在C1、C2、C23、C24和C30位上也有较多转化,少数转化发生在C4、C5、C6、C13、C19、C25、C26和C29位上。羰基化反应最常发生在C3和C21位上,少数发生在C2和 C24位上。酯化反应在C13和C28位最常发生,在C7和C27位也有发现。脱氢反应最常见于C11位,在C4、C5和C23位上偶有发生。羧酸化在C3、C29和C30位上也非常常见。C3、C28和C30位是连接葡萄糖的常见位点,最易发生水解反应和糖基化反应。利用细菌转化五环三萜类化合物的研究报道略少于真菌,研究报道最多的是杆菌,主要有羟基化、羰基化、糖基化、水解和酯化反应等反应类型,能实现C2、C1、C7、C15、C23和C30位羟基化和C3位羰基化,以及真菌中未能实现的C11位羟基化和C7、C30位的羰基化。除此之外,C11和C26位发生环氧化,A环C2和C3位发生裂解,C1位发生乙酰化,C28位羧酸被还原成羟甲基等反应类型也不断被报道发现。
生物转化的目的是能够将底物转化成活性更强的化合物。有些转化反应增强了对肿瘤细胞细胞毒活性,如在C2、C7和C21位羟基化[47],C28位甲基化[49],C3糖基化[9],C28位单糖基化[53],这些转化生成的产物为抗肿瘤药物活性筛选和研究提供了物质基础。另外,在C28位单糖基化可降低血液促凝作用,为心血管疾病提供先导化合物[52]。有些转化反应可以增强抗炎活性[55],如在C3位羰基化[43],C1位乙酰化,C1、C7、C15、C21和C24位羟基化[31,54]和C3、C28和C30位糖基化[8,28]。有些转化反应增强了抗菌活性,如在C28位和C3位糖基化[45],C3位羰基化和C21位羟基化[11],其生成的衍生物具有开发抗菌药物的潜能。C29位羧酸化有神经保护的潜力[13]。随着五环三萜类化合物生物转化技术的研究,大量活性物质被发现,这些新的转化产物不断在为临床应用提供新的先导化合物或药效物质。微生物种类众多,如何通过筛选生物转化活性菌株,使五环三萜类化合物创造新的活性价值还需要进一步深入研究。
近年来酶工程、细胞和酶的固定化、基因工程、发酵工程、代谢组学、蛋白质组学等的飞速发展,有望把多种基因整合于同一工程菌种同时完成多部 转化反应,使微生物转化在药物合成上具有更美好的前景。
