油茶籽油甾醇存在形态及其在精炼和贮藏过程中动态变化分析
2021-08-31贾文聪方恩华吴易峰徐敦明王晓琴
贾文聪,方恩华,吴易峰,徐敦明,王晓琴,*
(1.华侨大学化工学院,福建 厦门 361021;2.华侨大学 油脂及天然产物研究所,福建 厦门 361021;3.厦门海关技术中心,福建 厦门 361013)
植物甾醇是一种结构类似环状醇的天然活性物质,是构成细胞膜及细胞器的重要组成成分[1-2]。其来源于植物果实(种子)油脂以及松科树木的树油[3-5],具有抗炎、抗肿瘤、免疫调节、降低胆固醇、延缓动脉粥样硬化及预防心脑血管疾病等功能[6-10]。植物甾醇以游离和结合态2 种形式存在,其中结合态甾醇包括甾醇脂肪酸酯、甾醇酚酸酯、甾基糖苷以及酰化甾基糖苷[11-12]。通过酯化结合态甾醇改善其乳化性[13],可通过减少胆固醇的吸收降低低密度脂蛋白胆固醇(减少7%~10%)[14-15],降低血液总胆固醇效果比游离甾醇更佳[16]。
植物油作为人类摄取甾醇的主要来源,目前分析工作通常先将油脂进行皂化或酸/碱水解,然后再分离检测,测得游离态和甾醇酯的含量之和[17-20],未能区分游离和结合态甾醇。研究者已经开始注意到这个问题,开展了植物油甾醇存在形态分析,例如,芝麻油、橄榄油、棉籽油中游离甾醇占54%~85%,而菜籽油、玉米油、花生油游离甾醇仅占32%~44%[21]。大豆油中游离甾醇总含量为3 500.20 mg/kg,包括菜籽甾醇、芸薹甾醇等14 种游离甾醇[22]。莲子油甾醇主要以结合态存在,含量为10.76~11.72 g/100 g[23]。可见,不同植物油甾醇游离和结合态分布存在明显差异,存在形态分析不可忽略,分析测定不同存在形态甾醇的组成含量对于准确评价油脂品质十分必要。
油茶籽油,又名茶籽油、山茶油,是由山茶属(CamelliaL.)油茶组(sect.oleifera)和红山茶组(sect.camellia)植物种子制备而成的油脂[24]。油茶籽油是我国大力发展的木本食用油,也是联合国粮农组织推荐的健康食用油[25]。甾醇作为油茶籽油中重要的功能物质,已成为国际食品法典委员会食用植物油标准[26]重要内容。油茶籽油甾醇分析工作已有报道,如检测到麦角甾醇和香叶基芳樟醇[27];Δ7-豆甾烯醇和Δ7-燕麦甾烯醇[28]也被检出,但均未进行绝对定量分析。本课题组已对油茶籽油11 种甾醇开展了定性定量工作,测得总甾醇含量为4 979.06~6 266.15 mg/kg,主要甾醇化合物包括羊毛甾醇、β-香树脂醇、环阿屯醇等[29]。然而,油茶籽油甾醇分析工作较为有限,存在形态等进一步深入研究工作目前鲜见报道。
因此,本实验采用气相色谱-质谱联用技术对国内主要油茶籽油产品甾醇存在形态进行分析,并研究精炼工艺和贮藏过程对油茶籽油不同存在形态甾醇的影响,结合主成分分析(principal component analysis,PCA),揭示油茶籽油甾醇组成及存在形态特征及其影响因素,旨在为建立油茶籽油甾醇数据库和完善油茶籽油相关质量标准提供基础数据,同时为指导生产加工提供理论依据。
1 材料与方法
1.1 材料与试剂
国内主要油茶籽油产品为厂家直购;所用毛油为福建宁德地区采籽低温压榨;精炼实验模拟常规生产工艺,包括脱酸油、脱水油、脱蜡油、脱臭油;胆甾烷醇(纯度>99%,色谱级) 北京索莱宝生物科技有限公司;正己烷(色谱级),正己烷、乙醇、乙醚、氢氧化钾、无水硫酸钠(均为分析纯) 国药集团化学试剂有限公司。
1.2 仪器与设备
中性氧化铝柱(1.5 cm×25 cm)、SPE固相萃取柱(500 mg/6 mL Pro Elut Silica) 北京迪马科技有限公司;BS 2202S电子天平 北京赛多利斯仪器系统有限公司;R215旋转蒸发仪、B491恒温水浴锅、V70真空泵瑞士BUCHI公司;QP2010气相色谱-质谱联用仪(配有NIST14S.LIB谱库) 日本岛津公司。
1.3 方法
1.3.1 结合态甾醇的提取分离
参考ISO 12228∶1999[30]及Xu Baocheng等[31]的方法,并进行如下改进。取250 mg油样于50 mL烧瓶中,用25 mL正己烷溶液溶解,加入600 μL胆甾烷醇(1 mg/mL)内标,混匀备用。称取1.0 g无水硫酸钠加到SPE柱的上方,然后用10 mL正己烷溶液活化,流速1.5 mL/min,弃流出液;将前述样品液注入到SPE柱中,流速1.2 mL/min,弃流出液;再用50 mL正己烷-乙醚(95∶5,V/V)进行淋洗,流速控制为1.1 mL/min,收集洗脱液。向洗脱液中加入1 mg/mL胆甾烷醇标准溶液600 μL,再加入50 mL浓度为1 mol/L的KOH-CH3CH2OH溶液并混匀。将混合液置于100 ℃水浴下回流皂化50 min;取出并冷却至室温后,吸取上述溶液加于活化好的氧化铝柱中,先用5 mL乙醇淋洗,再用50 mL正己烷溶液洗提,流速2 mL/min,收集洗脱液。将洗脱液旋蒸至干后,用1 mL正己烷(色谱级)重溶,过0.22 μm有机滤膜于样品瓶中,置于-20 ℃保存待测。
1.3.2 游离态甾醇的提取分离
参考徐宝成等[22]的方法并进行改进。用50 mL正己烷-乙醚(80∶20,V/V)溶液继续淋洗1.3.1节中洗提过结合态甾醇的SPE柱,流速控制为1.5 mL/min,收集洗脱液于干燥的烧瓶中。将洗脱液旋蒸至干后,用1 mL正己烷(色谱级)溶解样品,过0.22 μm有机滤膜于样品瓶中,置于-20 ℃保存待测。
1.3.3 甾醇的定性定量分析
采用气相色谱-质谱联用仪进行油茶籽油中甾醇类化合物分析测定。
1.3.3.1 色谱条件
色谱柱:Rxi-5Sil MS(30 m×0.25 mm,0.25 μm);载气:氦气;载气流量1.0 mL/min;进样口温度300 ℃;检测器温度270 ℃;进样口分流比20∶1;进样量1 μL;升温程序:柱温初始温度180 ℃,然后以14 ℃/min升温至250 ℃,最后以2 ℃/min升温至265 ℃,保持22 min。
1.3.3.2 质谱条件
电子电离源;接口温度300 ℃;溶剂延迟5 min;离子源温度300 ℃;电子能量70 eV;扫描时间0.5 s;质量扫描范围m/z40~600。
1.3.3.3 定量分析
甾醇化合物的定量采用内标法进行分析,根据被测化合物与内标物的色谱峰面积之比计算组分的含量。计算公式如下:
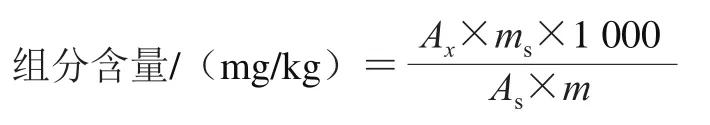
式中:Ax为被测组分的色谱峰面积;As为内标化合物胆甾烷醇的色谱峰面积;ms为内标化合物胆甾烷醇的质量/mg;m为油脂的质量/g。
1.3.4 PCA
采用SPSS 25.0对国内主要油茶籽油产品及精炼、贮藏过程中油茶籽油结合态甾醇和游离态甾醇数据进行PCA,并绘制PCA载荷图,P<0.05,差异显著。
2 结果与分析
2.1 我国主要油茶籽油产品不同形态甾醇分析
2.1.1 结合态甾醇分析
如表1、图1所示,共检测到9 种结合态甾醇,不同油茶籽油产品结合态甾醇组分类似,结合态甾醇总含量在2 975.46~5 613.15 mg/kg之间,主要包括羊毛甾醇、β-香树脂醇、环阿屯醇等。结合态甾醇中,羊毛甾醇含量最高,平均含量为980.91 mg/kg,占总结合态甾醇含量的24.4%;海棠果醇含量最低,平均含量为140.54 mg/kg,占总含量的3.5%。
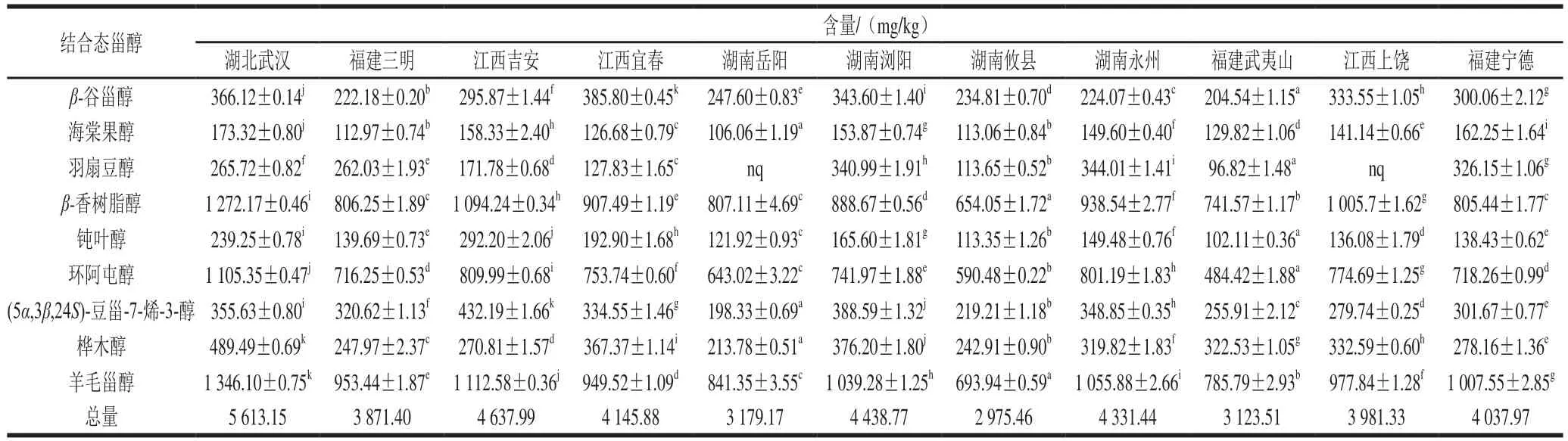
表1 国内主要油茶籽油产品的结合态甾醇组成(n=3)Table 1 Bound phytosterol composition of camellia seed oil from major producing areas (n = 3)
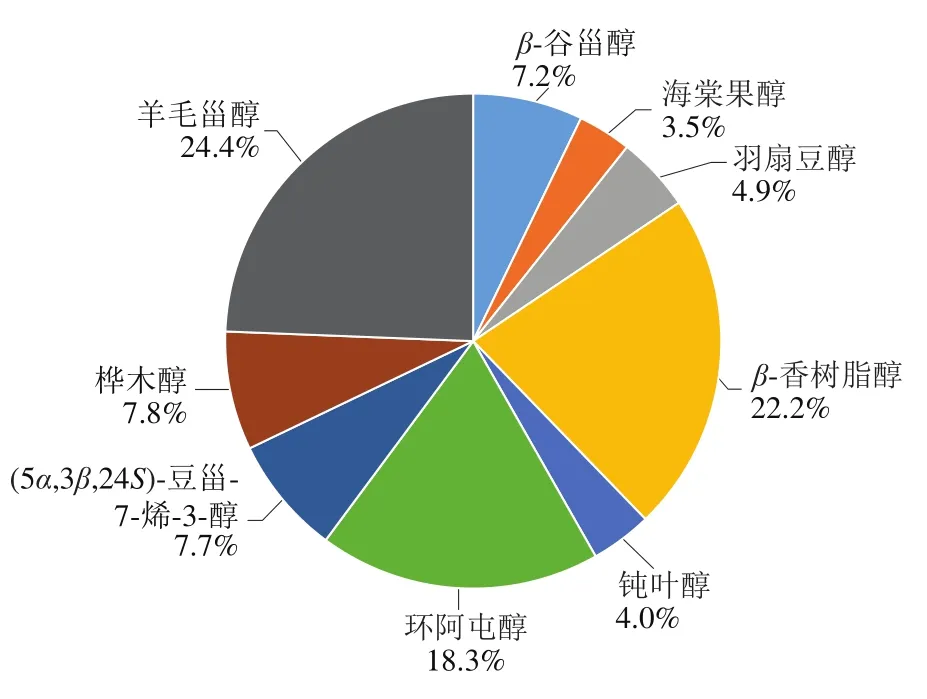
图1 结合态甾醇在油茶籽油中的分布Fig. 1 Distribution of bound sterols in camellia seed oil
2.1.2 游离态甾醇分析
如表2所示,我国主要油茶籽油产品中共检测到9 种游离态甾醇,总含量为24.97~100.33 mg/kg。由表2及图2可知,各游离态甾醇的相对占比与其结合态不同。游离β-谷甾醇为国内主要油茶籽油产品的共有游离甾醇,且平均含量最高,为17.90 mg/kg,占总游离态甾醇含量的40.0%;游离态环阿屯醇平均含量最低,为0.61 mg/kg,占总游离态甾醇含量的1.4%。除游离态β-谷甾醇含量较高外,油茶籽油其他甾醇几乎均主要以结合态形式存在。
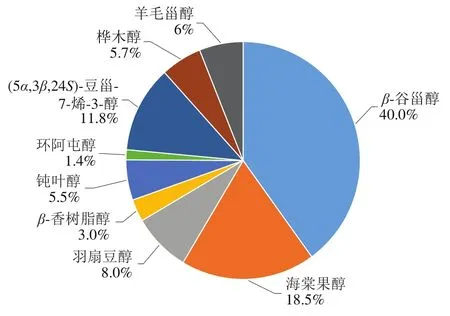
图2 游离态甾醇在油茶籽油中的分布Fig. 2 Distribution of free sterols in camellia seed oil
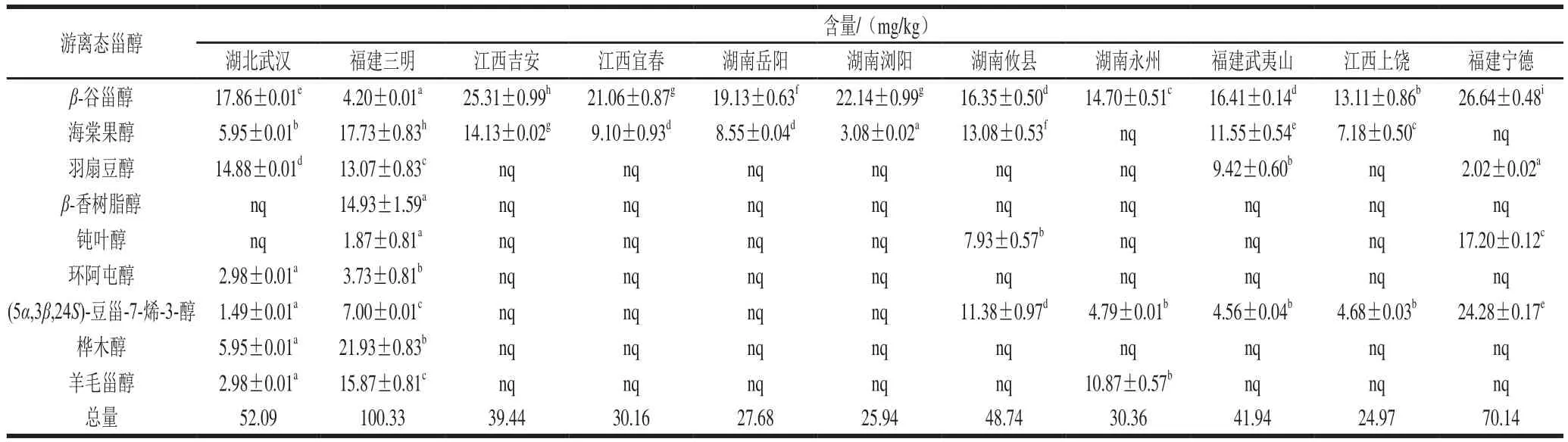
表2 国内主要油茶籽油产品的游离态甾醇组成(n=3)Table 2 Free phytosterol composition of camellia seed oil from major producing areas (n = 3)
可见,我国主要油茶籽油产品共检测到9 种甾醇,均以结合和游离形态存在,并以结合态为主,总含量为3 072.87~5 713.48 mg/kg,结合态甾醇占总含量的97.4%~99.4%,游离态占0.6%~2.6%,结合态甾醇生理活性优势如前言所述,这在一定程度上表明油茶籽油可能具有更好的降低胆固醇、预防心血管疾病的作用,与民间生活经验相符。
2.2 精炼过程中油茶籽油不同形态甾醇组成变化分析
2.2.1 结合态甾醇
从表3可以看出,油茶籽油毛油在精炼过程中,结合态甾醇种类未发生变化,但含量下降了25.1%。其中,脱酸工艺对油茶籽油结合态甾醇含量影响最大,损失率达22.0%。在各结合态甾醇中,钝叶醇含量变化最为明显,下降了59.4%,这可能和其侧链双键及位置有关[32];β-谷甾醇含量受精炼影响最小,含量下降3.6%。由图3可知,结合态甾醇含量在脱酸过程大幅下降后,在后续脱水、脱蜡、脱臭工序中,含量变化幅度较小。
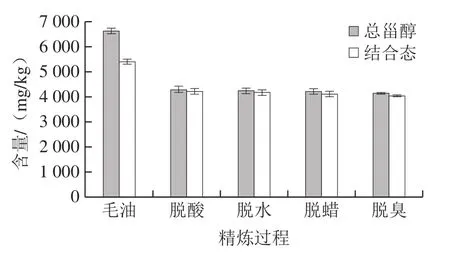
图3 精炼过程中油茶籽油不同形态甾醇的含量变化Fig. 3 Changes in contents of free and bound sterols in camellia seed oil during refining
2.2.2 游离态甾醇
由表3可知,油茶籽油游离态甾醇在精炼过程中含量逐渐降低,下降至72.24 mg/kg,降低了94.1%,尤其在脱酸工序中损失最多,游离态甾醇含量在此下降了92.9%。游离态羽扇豆醇含量降低最多,损失率达99.2%,游离态(5α,3β,24S)-豆甾-7-烯-3-醇含量变化最小,下降了89.8%,这可能与甾醇自身结构和含量有关。经后续精炼工序处理后,游离态甾醇含量下降趋势减小(图3),这与结合态甾醇的含量变化趋势一致。

表3 精炼过程中油茶籽油不同形态甾醇组成(n=3)Table 3 Free and bound phytosterol compositions of camellia seed oil at different stages of refining (n = 3)mg/kg
可见,在精炼过程中游离态甾醇较结合态甾醇含量损失更大,几乎全部损耗,尤其是脱酸工艺。脱酸过程向油茶籽油中加入碱和热水,由于碱与游离脂肪酸中和生成了钠皂,游离甾醇与皂水会形成胶团并被转移到皂脚中[32]。同时,钠皂作为表面活性剂,带亲水性羟基的甾醇可能在此过程中会被吸附除去[33],从而使甾醇含量大幅降低。由于甾醇在物理性质上主要表现为疏水性[4],因此脱水对甾醇的含量影响并不明显。脱臭过程中,高温使游离甾醇从中性油中蒸馏出来;但即使在270 ℃和1 Pa条件下,结合态甾醇也很难被蒸馏出来[34]。此外,脱蜡、脱臭时游离甾醇和脂肪酸发生促酯化反应形成结合态甾醇,都导致游离甾醇在精炼工艺中含量损失更大。
2.3 贮藏过程中油茶籽油不同形态甾醇组成变化分析
2.3.1 结合态甾醇
如表4所示,油茶籽油结合态甾醇含量随贮藏时间的延长而逐渐下降,总含量下降了12.0%。其中,结合态海棠果醇含量下降百分比最大,达28.4%,结合态羊毛甾醇含量下降最少,降低了7.8%。从图4可以看出,整个贮藏过程中,结合态甾醇的含量变化趋势较为平缓,表明结合态甾醇在自然氧化过程中较为稳定,这可能与其酯化相连的脂肪酸能抑制甾醇的自由基链式反应,减少氧化物羟基甾醇的生成有关[35]。

表4 贮藏过程中油茶籽油结合态甾醇组成(n=3)Table 4 Bound phytosterol composition of camellia seed oil during storage (n = 3)mg/kg
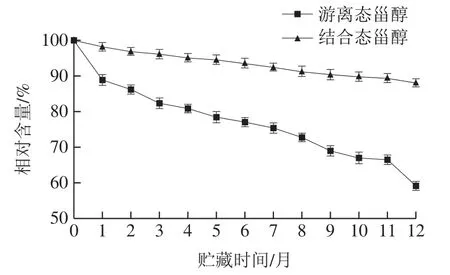
图4 贮藏过程中油茶籽油不同形态甾醇的含量变化Fig. 4 Changes in contents of free and bound sterols in camellia seed oil during storage
2.3.2 游离态甾醇
游离态甾醇含量在贮藏过程中呈不断下降趋势,游离态甾醇总含量下降了40.9%(表5)。游离态羽扇豆醇含量下降最大,降低了46.4%;游离态β-谷甾醇含量变化最小,为35.1%,可能与其侧链长度和结构中双键个数有关[36]。由图4可知,游离甾醇含量变化较大,下降幅度大于结合态甾醇。在贮藏期间,游离态甾醇含量下降速率呈现变化,这可能是温度和光照强度变化导致游离甾醇氧化速率不同。
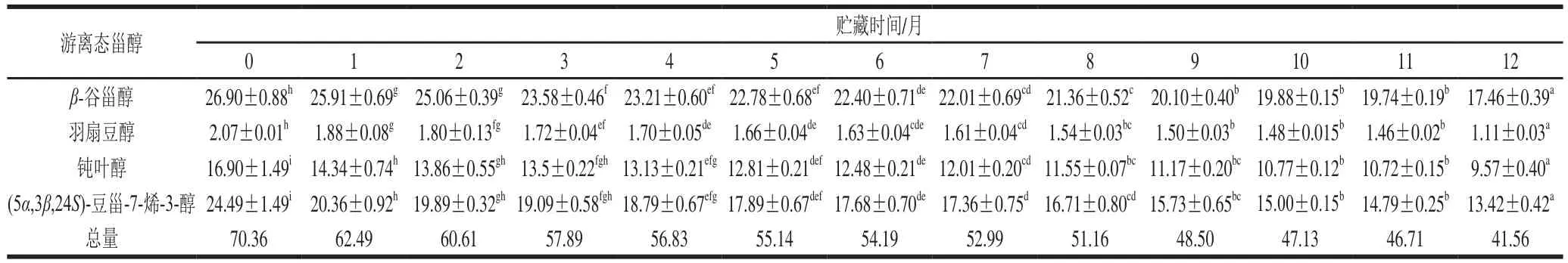
表5 贮藏过程中油茶籽油游离态甾醇组成(n=3)Table 5 Free phytosterol composition of camellia seed oil during storage (n = 3)mg/kg
在贮藏过程中,油茶籽油结合态甾醇含量下降了12.0%,相对于游离态甾醇的含量损失(40.9%),结合态甾醇表现出更强的氧化稳定性。结合态甾醇比游离态甾醇更加稳定,这可能是因为结合态甾醇连接了与其酯化的不饱和脂肪酸。在自然氧化初期,这些不饱和脂肪酸会先于甾醇劣变,其不饱和键对甾醇氧化的C5、C6环氧路径和C7羟/酮路径产生抑制作用,从而延缓甾醇氧化[36]。因此,在贮藏过程中结合态甾醇比游离态氧化缓慢,具有更强的氧化稳定性,这一结果与文献报道一致[37-38]。
2.4 油茶籽油不同形态甾醇PCA
在对我国主要油茶籽油产品、精炼过程中油茶籽油以及贮藏过程中的油茶籽油结合态和游离态甾醇进行测定后,以各甾醇为原始变量,应用PCA法对油茶籽油甾醇主体化合物进行可视化表征,结果如图5所示。
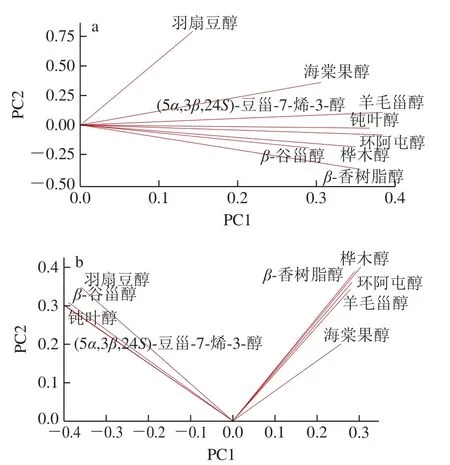
图5 油茶籽油结合态甾醇(a)与游离态甾醇(b)PCA荷载图Fig. 5 PCA loading plots of bound sterols (a) and free sterols (b) in camellia seed oil
2.4.1 结合态甾醇PCA
PCA法常采用方差累计贡献率确定PC数目。结合态甾醇特征值大于1的PC数量为2,PC1的特征值为5.84,方差贡献率为64.9%,PC2的特征值为1.28,方差贡献率为14.2%,前2 个PC累计方差贡献率为79.1%,即2 个PC解释了总变异的79.1%,可提取前2 个PC。
选取前2 个PC绘制PCA荷载图(图5a),可以看出,羊毛甾醇和环阿屯醇在PC1上得分较高,羽扇豆醇在PC2上得分较高,总方差70.0%以上的贡献来自PC1、PC2,可见,结合态羊毛甾醇、结合态环阿屯醇和结合态羽扇豆醇对油茶籽油结合态甾醇组成影响较大,是油茶籽油中表现稳定的特征甾醇,这与其在不同来源、精炼和贮藏过程中的变异分析结果相符(表1、3、4),其中结合态羊毛甾醇是油茶籽油最稳定存在的结合态甾醇化合物。
2.4.2 游离态甾醇PCA
在PCA中,游离态甾醇特征值大于1的PC有2 个,PC1的特征值为4.29,方差贡献率为47.6%,PC2的特征值为3.52,方差贡献率为39.1%,前2 个PC累计方差贡献率为86.7%,即2 个PC解释了总变异的86.7%,故提取前2 个PC进行分析。
将PCA荷载矩阵进行旋转,如图5b所示,PC1与β-谷甾醇、钝叶醇、(5α,3β,24S)-豆甾-7-烯-3-醇高度负相关,PC2与桦木醇、β-香树脂醇、环阿屯醇高度正相关,每个PC都有与其高度相关的甾醇化合物,这表明该PC基本可以反映与其高度相关甾醇的信息。β-谷甾醇在PC1上得分较高,桦木醇在PC2上得分较高,故游离态β-谷甾醇和桦木醇对油茶籽油游离态甾醇组成影响较大,是油茶籽油特征游离态甾醇,这也在油茶籽油甾醇组成分析结果中得到验证(表2),同时游离态β-谷甾醇在精炼和贮藏中表现出较好的稳定性(表3、5),是油茶籽油中最稳定存在的游离态甾醇。
结合态羊毛甾醇和游离态β-谷甾醇分别在不同形态甾醇荷载图主因子上得分最高,对油茶籽油甾醇组成影响最大,是油茶籽油主体甾醇化合物,在油茶籽油不同产品、精炼过程以及贮藏过程中都稳定存在。值得注意的是,游离态甾醇的最稳定物质与结合态不一致,这印证了在油茶籽油成品油、精炼油和贮藏油中,不同形态甾醇中均存在稳定的主体物质,甾醇存在形态不能被忽略。
3 结 论
我国油茶籽油产品甾醇共检测到9 种,均以结合和游离形态存在,总含量为3 072.87~5 713.48 mg/kg,主要甾醇化合物包括羊毛甾醇、β-香树脂醇、环阿屯醇、β-谷甾醇。结合态甾醇占97.4%~99.4%,是油茶籽油甾醇的主要存在形式,可以反映油茶籽油甾醇的总体特征,这也表明传统皂化方法分析预处理的可行性。油茶籽油精炼后,游离态甾醇受影响较大,含量降低了94.1%;结合态含量变化较小,下降了25.1%。其中脱酸对2 种形态甾醇的影响均最大,游离和结合态甾醇含量在此分别损失了92.9%、22.0%。在12 个月贮藏过程中,结合态和游离态甾醇含量分别下降了12.0%和40.9%,结合态甾醇比游离态表现出更强的氧化稳定性。PCA及荷载分析发现,结合态羊毛甾醇和游离态β-谷甾醇是油茶籽油最主要特征甾醇,在油茶籽油不同产品、精炼和贮藏中都稳定存在。可见,油茶籽油游离态和结合态甾醇在精炼、贮藏中表现出不同的变化规律,本实验补充了油茶籽油甾醇存在形态数据,并研究了来源、精炼和贮藏等因素的影响,为油茶籽油甾醇研究和开发提供了基础资料和理论依据,同时也打开了油茶籽油甾醇氧化研究的新视角。
