急性缺血性卒中患者动态血糖参数与临床预后的相关性
2021-08-31刘学源李土明
吴 滢, 刘学源, 李土明, 钟 萍
急性缺血性卒中(acute ischemic stroke,AIS)患者中约有高达三分之一伴有高血糖症[1]。高血糖症可能导致脑组织损伤加重的原因包括增加乳酸酸中毒、导致细胞毒性水肿加重、降低脑血管舒缩反应性、破坏血脑屏障等[2]。已有多项研究结果表明,高血糖是较大梗死面积、不良临床结局和较高死亡风险的独立预测因子[3,4],与静脉溶栓、机械取栓等再通治疗后发生症状脑出血、死亡等其他不良临床事件相关[5]。因此,血糖与卒中后转归的关系和机制仍需进一步研究。本研究对AIS患者进行72 h动态血糖监测并随访临床预后,分析系列性血糖指标与不同临床终点事件指标之间的相关性,以期为临床治疗提供更多的依据。
1 对象与方法
1.1 研究对象 选择2018年2月至2019年10月在上海市中西医结合医院神经内科住院的AIS患者。纳入标准:(1)符合中华医学会神经病学分会制定的《2018中国急性缺血性脑卒中诊治指南》诊断要点,并经头部CT/MRI确诊;(2)年龄≥45岁;(3)发病在14 d内;(4)住院时间>3 d;(5)具备动态血糖监测结果。排除标准:(1)合并l型糖尿病或糖尿病酮症酸中毒;(2)患有慢性感染性疾病及近期急性感染;(3)伴有严重肝、肾功能损害。所有患者均接受卒中常规治疗,血糖控制目标为7.8 mmol/L~10.0 mmol/L。本研究经上海市中西医结合医院伦理委员会批准(2019-097-1),所有患者均签署知情同意书。
1.2 研究方法 所有患者在入院后开始安装美奇动态血糖检测仪,该系统每5 min记录1次平均血糖值,每天可监测288次,监测范围在1.7 mmol/L~24 mmol/L,每天输入三餐前及睡前血糖进行血糖值校正,患者连续佩戴72 h后拆卸,最终获得72 h的血糖图谱。所有血糖参数指标通过动态血糖检测仪获得,包括测量期间的:(1)血糖最大值;(2)血糖最小值;(3)血糖平均值;(4)高血糖(血糖>11.1 mmol/L)时间比;(5)高血糖(血糖>7.8 mmol/L)时间比;(6)低血糖(血糖<3.9 mmol/L)时间比;(7)血糖波动系数;(8)空腹血糖平均值;(9)早餐后血糖平均值;(10)午餐后血糖平均值;(11)晚餐后血糖平均值。
1.3 临床资料收集 记录患者的基线特征,包括人口统计学资料(年龄、性别)、既往病史(高血压、糖尿病、高脂血症、冠心病、既往卒中、吸烟和饮酒史、降糖药物使用史)等。其中高血压定义为血压≥140/90 mmHg;使用抗高血压药或以前诊断为高血压。糖尿病定义为空腹血糖≥7.0 mmol/或随机血糖≥11.1 mmol/L;口服糖耐量试验2 h血糖≥11.1 mmol/L;服用抗糖尿病药物;或糖尿病的先前诊断。高脂血症定义为血清总甘油三酯≥1.7 mmol/L,血清总胆固醇≥5.18 mmol/L,血清低密脂胆固醇≥3.37 mmol/L,降血脂药物使用史或以前的血脂异常诊断。既往卒中史包括缺血性卒中和出血性卒中。吸烟史定义为每天吸烟1支以上,连续或累计6 m。饮酒史定义为男性平均每周饮用白酒超过500 g,女性为350 g,连续5 y以上。降糖药物使用包括胰岛素和口服降糖药物。
1.4 血生化指标 所有患者在入院2 d空腹12 h采肘静脉血,进行常规血生化检查包括,总胆红素、直接胆红素、甘油三酯、总胆固醇、低密度脂蛋白胆固醇、高密度脂蛋白胆固醇、糖化血红蛋白、糖化白蛋白、同型半胱氨酸、纤维蛋白原、肌酐、尿素氮、尿酸。
1.5 随访 每3 m进行一次随访,随访至卒中后6 m。结局指标:(1)卒中复发。卒中复发的诊断参照Sacco标准[6]:①患者在原神经系统缺损症状和体征好转或消失的基础上,再次出现同侧或对侧新的神经系统缺损症状和体征;②复发卒中也包括随访中因卒中复发导致死亡的患者;③头部CT或MRI检查发现新的病灶(同侧或对侧)。(2)卒中事件发生6 m后的功能恢复情况,采用改良Rankin量表(modified Rankin Scale,mRS)评价功能转归,0~2分定义为转归良好,>2分定义为转归不良。(3)全因死亡情况。
2 结 果
2.1 人口统计学和基线资料 研究期间共纳入AIS患者96例,其中8例因血糖资料不完整、失访而排除,最终88例纳入分析。其中男性50例,女性38例,平均年龄(68.4±12.0)岁。转归不良组16例(18.18%),转归良好组72例(81.82%),两组之间在年龄、既往卒中史、总胆红素之间有显著差异(P<0.05)。再发卒中组13例(14.77%),非再发卒中组75例(85.23%),两组间在既往卒中史、糖化血红蛋白、糖化白蛋白之间有明显差异(P<0.05)。其他人口统计学和基线临床资料差异均无统计学意义。(见表1)
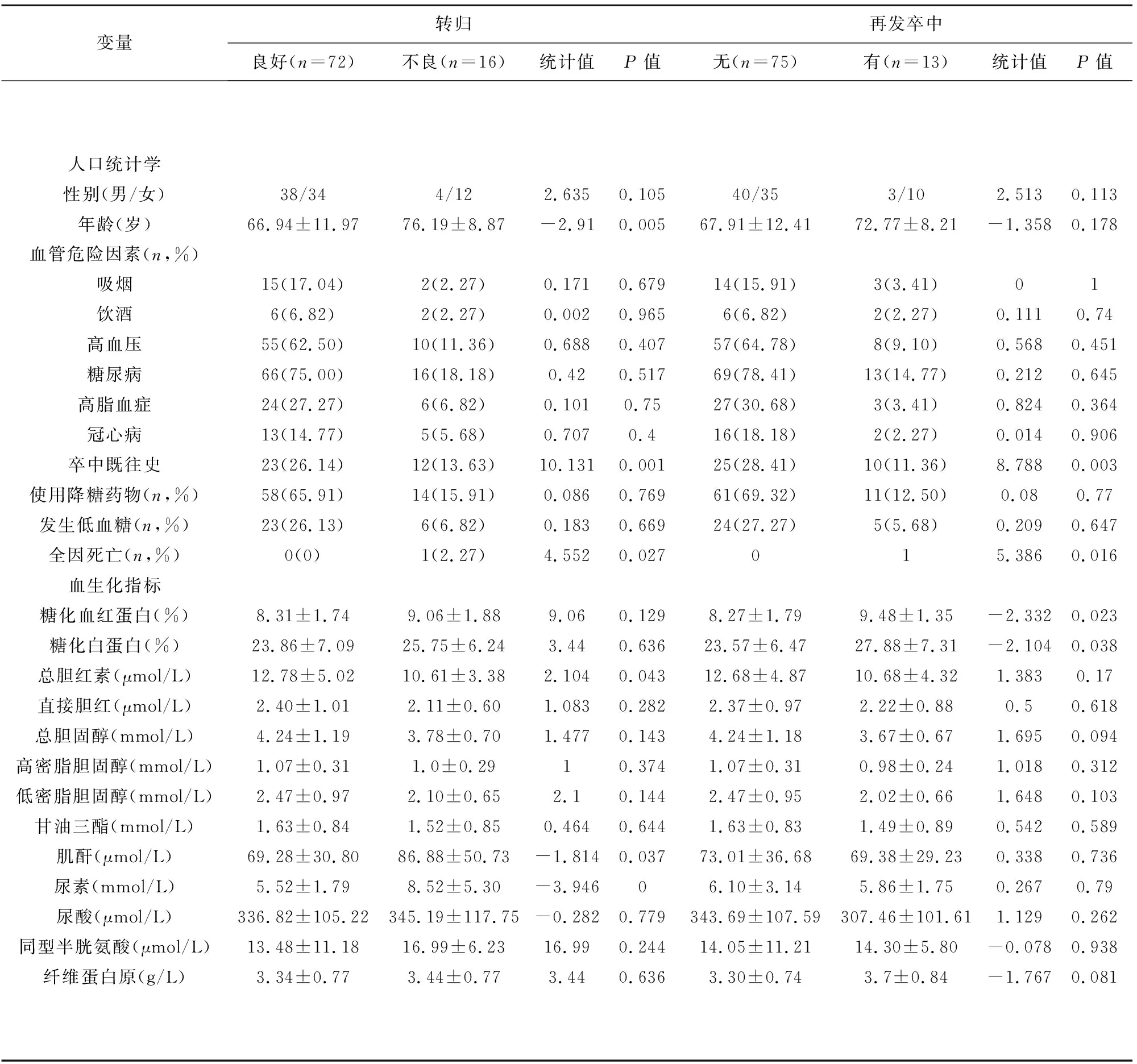
表1 研究对象的人口统计学和临床资料
2.2 AIS患者动态血糖参数与不良预后的单变量分析 转归良好组和不良转归组在血糖最大值、低血糖时间比、血糖波动系数、午餐后血糖平均值之间有显著差异(P<0.05),其他血糖参数之间无统计学差异。再发卒中组和非再发卒中组动态血糖各项参数之间无统计学差异(见表2)。

表2 研究对象的动态血糖参数与临床转归、再发卒中的相关性
2.3 预后不良和再发卒中独立危险因素的多变量Logistic回归分析 对单变量分析中具有统计学意义的因素进行多变量Logistic回归分析显示,预后不良的的独立影响因素包括既往卒中史(OR7.36,95%CI1.69~32.06;P<0.05)和低血糖时间比(OR1.6,95%CI1.01~2.55,P<0.05);再发卒中的独立危险因素包括既往卒中史(OR7.36,95%CI1.69~32.06,P<0.05)(见表3)。

表3 预后不良和再发卒中独立危险因素的多变量Logistic回归分析结果
3 讨 论
AIS患者的高血糖是较大梗死面积、不良预后和高死亡率风险的独立预测因素[7]。过去对患者血糖的监测多通过单次的血糖测量,对详细的动态血糖状态是未知的。利用动态血糖监测仪记录急性缺血性卒中患者的血糖参数有利于连续记录血糖的动态变化并发现无症状性低血糖。近年来有学者提出,利用血糖变异性即血糖的波动范围,来反应血糖的异常。Chiu等[8]纳入28354例台湾华裔糖尿病患者随访7.5 y的研究发现,血糖变异性是2型糖尿病患者发生缺血性卒中的预测因子。有糖尿病的AIS患者血糖变异性与较差的功能预后相关[9]。国内邸卫英等[10]回顾性分析了急性缺血性卒中患者3 m内病死率情况,发现血糖波动范围大提示转归不良,且平均血糖变异性比平均血糖水平能更好地预测患者 3 m内病死率。
在本研究中,对AIS患者的基线资料及动态血糖参数的单因素分析显示,预后不良组在年龄、既往卒中史、总胆红素、血糖最大值、低血糖时间比、波动系数及午餐后血糖平均值之间有显著高于预后良好组;再发卒中组在既往卒中史、糖化血红蛋白、糖化白蛋白显著高于非再发卒中组。而平均血糖水平在预后情况及再发卒中的比较中均无统计学差异。进一步的多变量Logistic回归分析结果显示,既往卒中史是预后不良和再发卒中的独立危险因素。年龄和低血糖时间比是预后不良的独立危险因素。结果显示,血糖波动系数与卒中患者的不良结局相关,血糖波动范围大提示转归不良血糖波动系数比平均血糖水平能更好地预测患者转归。这也与既往的研究结果相符。
AIS患者由于体内糖代谢情况紊乱,极易出现低血糖的情况。在本研究中,预后不良组有6例(31.25%)发生低血糖,再发卒中组有5例(38.46%)发生低血糖其中3例出现出冷汗、心慌、胸闷的低血糖症状,其他人低血糖多发生在21点~0点、3~6点,未发现明显的症状性低血糖表现,说明动态血糖检测仪能够发现无症状的低血糖。不良预后组和再发卒中组在低血糖发生数的之间无统计学差异,而不良预后组低血糖时间比之间有统计学差异,进一步的多变量Logistic回归分析低血糖时间比是预后不良的独立危险因素。
近年来,大量的临床试验证实了对AIS患者进行强化降糖后未获得功能结局或生存的任何显著的益处。同时,严格的血糖控制导致低血糖的风险增加。最新的SHINE研究是一项多中心随机双盲的研究,其显示,强化降糖方案不改善患者90 d功能预后,且增加严重低血糖发作风险[11]。因此,在对AIS患者急性血糖控制时,高血糖、低血糖和血糖波动性都是需要考虑的重要因素,我们的研究结果也与此相符。
有关AIS后高血糖的对脑组织的损伤机制包括以下几个方面:(1)脑组织在缺血损伤后由于高糖分解导致氧化代谢的减少和厌氧糖酵解的相对增加,加重脑组织酸中毒[3]。(2)在脑组织缺血损伤的急性期,活化的小胶质细胞、星形胶质细胞和巨噬细胞会释放促炎因子,加剧受损脑组织的损伤和坏死[12]。(3)增加细胞因子及蛋白酶活性,加重缺血/再灌注损伤后血脑屏障功能障碍,使脑梗死出血转化风险增加[13]。(4)体内氧化应激水平增加,导致线粒体功能障碍,加重兴奋性氨基酸毒性,促进神经元脂质、蛋白质和DNA过氧化损伤和促进炎症反应[14]。(5)降低内皮祖细胞分化、增殖、粘附功能,集落单位数量形成减少,从而导致内皮修复和新血管形成不良[15]。
本研究的不足之处是数据来源于单中心急性缺血性卒中动态血压监测资料库,有一部分患者是头部MRI发现的无症状的急性脑梗死患者,可能存在患者的选择偏倚。其次,样本量较小,仍需要大样本、前瞻性的深入研究和干预研究及进一步的机制探讨。此外,选择的卒中患者病因存在大动脉粥样硬化性、心源性及小动脉闭塞型等病因,故尚需要进一步对不同卒中类型进行分类探讨。
