鞘内药物输注系统2次置入治疗顽固性神经痛1例
2021-08-30蒋显锋朱晓龙赵明亮汤锋武
符 锋,蒋显锋,朱晓龙,赵明亮,宫 平,汤锋武
慢性顽固性疼痛一直是临床治疗的难题,口服或静脉药物治疗等传统治疗手段对其缺乏明显疗效,患者经历身心痛苦和社交情感障碍。20世纪80年代Tung等[1]首次通过鞘内注入吗啡治疗慢性难治性疼痛,可置入鞘内药物输注系统 (implanted intrathecal drug delivery system, IDDS)逐渐成为慢性疼痛患者的一项有效、微创性治疗方案。因IDDS可将药物直接输注到脑脊液,具有选择性高、药物剂量小、不良反应少等优势,得到广泛的共识,被认为是慢性疼痛三阶梯治疗等各种方法无效之后的一种理想选择[2]。由于慢性疼痛患者生存周期长,2次甚至多次行IDDS置入引发的鞘内泵电池耗竭,长期且大量使用阿片类药物后镇痛效果欠佳,鞘内导管尖端位置的个性化选择等问题[3],引起临床的广泛关注。笔者对我科2020-05收治的1例2次行IDDS治疗的顽固性会阴部痉挛性疼痛病例进行分析,为临床提供参考。
1 病例报告
1.1 一般情况 患者,女,69岁,2012-10因会阴区疼痛1年收入我院,临床表现:会阴部烧灼样、电击样疼痛,活动或大便刺激时加重,疼痛数字评分(number rating scale,NRS)6~7分;阵发性爆发痛时伴难以言明的坠胀不适,NRS 7~8分。入院行盆腔CT及超声检查排除其他器质性疾病,诊断为顽固性会阴部痉挛性疼痛。经药物、神经阻滞等治疗无效后行IDDS置入术(型号:8637-20,美国美敦力公司),鞘内吗啡输注,初始参数为:(1 mg/d),逐渐增至(12 mg/d),而后因疼痛明显缓解逐渐减低至(2 mg/d)维持输注治疗。术后NRS3-4分。2018-11-01因IDDS电池耗竭停机行“IDDS”取出术,向患者及其家属交代鞘内导管保留之必要性,患者及其家属表示知情并拒绝保留,术中取出导管。术后患者自行口服吗啡缓释片 300 mg/d治疗,疼痛控制欠佳,NRS 7~8分,日间爆发痛5~6次,NRS 8~9分,2020-05收住我院,要求再次置入IDDS。
1.2 治疗方法 由于患者为第2次行IDDS置入术,考虑原穿刺点可能发生黏连,故此次手术在全麻下行椎板切开置入术。患者取右侧卧位,以腰1棘突为中心,取腰部正中行纵切口,取右侧腹壁脐上横行切口,标记,IDDS(型号:8637-40,编号:NGV708724H,美国美敦力公司)内注入盐酸吗啡注射液40 ml(东北制药集团沈阳第一制药有限公司)。腰部切口 8 cm,依次切开皮肤,皮下组织、韧带,分离暴露硬脊膜,C形臂X线监视下证实后穿刺硬脊膜进入蛛网膜下腔,拔出针芯见无色清亮脑脊液流出,将鞘内导管置入蛛网膜下腔,向上留置胸10椎体水平,专用固定器固定导管。右侧腹部构建一个与鞘内泵大小相应的囊袋,以通条自腹部切口右侧至棘突旁切口做皮下隧道,将导管尾端引至腹部囊袋,修剪至适合长度,连接泵体药物输出口。固定泵体,关闭皮肤。
1.3 术后处理 术后根据止痛情况及不良反应,进行鞘内泵参数调控、管头位置调控及鞘内药物调配。术后第2天,按1/300将口服阿片类药物总剂量转化为鞘内背景量,采用持续剂量复合单次按压量输注模式:背景量2 mg/d,壶入0.2 mg/次,4次/d。根据患者疼痛及耐受情况,逐渐调整剂量(背景量+1~2 mg/3 d,壶入0.1~0.2 mg/次)。截至第一次泵内药物耗竭之时,鞘内泵参数为:背景量为12 mg/d,壶入1.5 mg/次,6次/d,总计21 mg/d。NRS4~5分,爆发痛时NRS 6~7分。由于药物剂量较大,但止痛效果控制欠佳,治疗组讨论后考虑药物渗出或导管肉芽肿形成,于局麻下行IDDS造影术,术中见:鞘内导管位置正确(胸10椎体水平)、导管通畅、没有折断渗漏等情况(图1)。鉴于IDDS工作正常,结合患者长期使用吗啡药物病史(8年),考虑吗啡药物耐受之可能,查阅相关文献及共识指南[4,5],拟复合罗哌卡因鞘内注射治疗,患者主诉会阴部痉挛性疼痛明显,原管头位于胸10椎体水平考虑位置偏高,于全麻下调整管头位置至胸12~腰1椎体水平,C形臂X线机下证实后固定管道。按盐酸吗啡注射液10 ml(10 mg/ml)+盐酸罗哌卡因注射液30 ml(100 mg/10 ml)配比,将初始药物浓度为罗哌卡因7.5 mg/ml+吗啡2.5 mg/ml的混合液注入药泵。术后启动鞘内泵参数:背景量10 mg/d,壶入0.1 mg/次, 6次/d,总剂量10.6 mg/d。术后第2天查房,患者诉肛周痉挛、坠胀不适较前明显减轻,但出现腰1水平以下麻木,双下肢无力,考虑与管头调整及新增药物作用有关。给予参数调整:背景8 mg/d, 壶入1 mg/次,6次/d,总剂量14 mg/d。术后第4天,患者诉无力感及麻木感较前好转,尚能忍受,可下地活动及大小便。逐日调整剂量(背景量1~2 mg/d,壶入0.1~0.2 mg/次)。期间曾有便秘,给予通便及灌肠治疗后好转。截止第2次泵内药物耗竭之时,鞘内泵参数为:背景量为罗哌卡因21 mg/d+吗啡7 mg/d (图2)。夜间NRS 2~3分,日间爆发痛2~3次,给予口服氨酚羟考酮片(330 mg/次)后好转,无难以忍受的不良反应,镇痛效果满意。
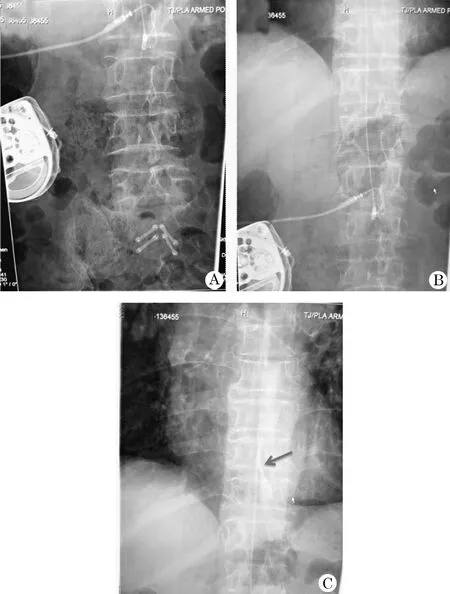
图1 IDDS造影

图2 顽固性神经痛不同时间点疼痛数字评分(NRS)
2 讨 论
随着对疼痛的病理生理学和鞘内镇痛治疗的不断研究,IDDS用于治疗各类慢性顽固性疼痛得到广泛认可。由于IDDS使用周期的延长及成本的降低,患者因IDDS鞘内泵电池耗竭、设备更新、药物疗效改变的情况越来越多。目前,对于保留导管,仅更换药泵的报道较多[3],但对于2次手术更换新泵、据患者情况个性化调整鞘内药物及管头位置的报道相对较少[6],本文对我院收治的未保留导管,再次置入IDDS全系统的病例进行报道,旨在为临床治疗提供依据。
本例由于第1次行IDDS取出术后未保留导管,考虑原穿刺点有黏连可能,2次手术时若在局麻下经腰椎穿刺切口行IDDS恐伤及神经或引发脑脊液漏。我们行椎板切开直视下完成IDDS置入术,术中见原穿刺孔及导管通路黏连,解剖结构稍紊乱。术后患者未出现感染、脑脊液漏、出血等手术并发症,说明2次手术选择全麻下切开置入较为安全。术后,我们据首次用药史,由口服换算起始量2.8 mg/d逐日调整为21 mg/d,患者仍诉镇痛效果不佳,NRS4~5分,爆发痛时NRS 6~7分。逐一排查8840 程控仪组件故障;鞘内导管通畅、折断渗漏等情况;脑脊液漏、出血,泵囊周边组织取活检排除感染等影响IDDS治疗慢性疼痛疗效的原因[5,7]。结合患者长期阿片类药物使用史及会阴部疼痛症状,故考虑药物因素及管头位置不佳可能性大。
在吗啡用量(21 mg/d)远超首次IDDS置入术后(12 mg/d)峰值剂量的情况下,患者仍感镇痛效果欠佳(NRS4~5分),我们考虑患者存在吗啡药物耐受性。根据文献[2]指出的,当不良反应在可以接受范围内而疗效下降时建议加用辅助药物,我们采用了复合罗哌卡因辅助治疗[8],逐日调整剂量后患者自感镇痛效果满意。鞘内吗啡作用于髓质阿片受体[9],而鞘内罗哌卡因作用于背根和神经根以增强镇痛疗效[10,11]。目前已有多项研究表明,鞘内持续注射罗哌卡因和吗啡混合液对顽固性疼痛患者的有效性和安全性[6,12,13]。Li等[13]用吗啡和罗哌卡因鞘内注射成功治疗难治性癌性疼痛,其最终背景量为:吗啡4.8 mg/d,罗哌卡因19.2 mg/d。我们初期调整参数时据此为最高峰值,再根据患者具体情况逐渐上调,直至到达镇痛效果及双下肢活动均能使患者满意的状态。本例患者治疗过程显示,使用联合治疗对其镇痛和生活质量提高更有益处。本例患者罗哌卡因使用量超过一般推荐剂量,但该患者仍耐受,我们仍将在随访中寻找亚麻醉状态下的镇痛与肢体运动平衡点。
此外,本例2次手术导管尖端位置调整亦值得关注。2次行IDDS置入时我们基于首次置入经验,将鞘内导管尖端放置于胸10水平。在逐日增加药量及确定IDDS工作正常的情况下,患者仍感镇痛效果不佳。查阅相关文献知,脑脊液在蛛网膜下腔仅呈“钟摆式”震荡,且震荡幅度和速率取决于其所处的脊髓节段。Flack 等[14]研究显示,持续低流量鞘内输注后,药物的扩散仅仅局限于导管尖端的几厘米内(2~3个椎体),而并非沿着脊髓广泛分布。鉴于此,该例患者导管尖端位于胸10水平,距离镇痛目标范围较远,我们将导管尖端调整至胸12~腰1椎体水平。患者除第2天出现一次下肢体麻木无力外,逐日增加药量后,患者在控制疼痛的剂量下,麻木感尚能忍受,且可下地活动。由此证实,为了达到更好的镇痛效果,根据患者的疼痛平面放置导管尖端于相应的位置尤为重要[5]。第2次沿用首次导管尖端位置后疗效不同,其原因可能与患者疼痛较前加剧、吗啡耐受有关,具体机制有待进一步研究。
通过本例治疗,我们有以下几点体会:(1)鞘内导管未保留的情况下,可能存在原穿刺孔及导管通路黏连、解剖结构紊乱。建议IDDS全系统再次置入时选择全麻下切开置入较为安全。(2)当鞘内单药治疗不能充分减轻疼痛时,可以考虑鞘内联合用药,特别是对痉挛性疼痛。不同的疼痛状态有不同的潜在机制,具有特定机制的药物往往只对一种或两种特定的疼痛情况有效。因此,联合药物可用于治疗多重疼痛,产生协同镇痛效果。(3)据疼痛部位个性化调整导管尖端位置,尽可能与疼痛平面相应[2]。
