克瑞森无核葡萄不同器官的离体培养
2021-08-30苗卫东井朋伟王萌张新宇周瑞金
苗卫东,井朋伟,王萌,张新宇,周瑞金
(河南科技学院园艺园林学院,河南 新乡 453003)
克瑞森无核葡萄(Crimson seedlessVitis viniferaL.)又名绯红无核、淑女无核,属欧亚种葡萄,是美国加利福尼亚州戴维斯农学院将皇帝与C33-199进行杂交而获得的晚熟无核葡萄品种[1]。克瑞森无核葡萄具有色泽艳丽、粒大肉脆、耐储性强等特点,深受人们喜爱[2]。采用离体培养技术可以获得克瑞森无核葡萄无菌苗,而影响成苗的关键是外植体、培养基及激素的选用。不同的外植体离体培养所需的培养基和激素不同[3-11]。郎凤红[3]、张美玲[4]、陶建敏[5]、Clog[6]等分别以葡萄叶柄、单芽茎段和叶片等为外植体通过器官发生获得植株;Zhu[7]、Reustle[8]、Salunkhe[9]等利用葡萄叶片、茎段等外植体及原生质体获得了完整植株。
本试验分别以克瑞森无核葡萄的带芽茎段、叶片和卷须为外植体,通过离体培养,确定了0.1%升汞浸泡带芽茎段外植体的消毒时间,筛选了适合叶片外植体的抗褐变剂以及分别适宜带芽茎段外植体离体培养侧芽和不定根、叶片和卷须外植体诱导愈伤组织的培养基,以期为克瑞森无核葡萄不同器官离体培养获得无菌苗提供一定的理论基础和技术指导。
1 材料与方法
1.1 供试材料
供试葡萄品种为克瑞森无核葡萄,选用一年生枝条的带芽茎段、叶片、卷须作为外植体。
1.2 试验设计
1.2.1 0.1%升汞消毒时间试验 先将葡萄带芽茎段浸泡在75%酒精中消毒1 min,再用0.1%升汞溶液分别消毒3、4、5、6、7、8 min,然后接种到B5+30 g/L蔗糖+7 g/L琼脂+1.0 mg/L 6-BA+0.5 mg/L IBA(pH 6.0)上,在(25±1)℃、光照强度1 500~2 000 lx、16 h光照/8 h黑暗条件下培养7 d,观察外植体污染情况,统计外植体污染数、褐变数和成活数,计算污染率、褐变率及成活率。污染率(%)=污染外植体数/接种总数×100;褐变率(%)=褐变外植体数/接种总数×100;存活率(%)=存活外植体数/接种总数×100。
1.2.2 不同抗褐变剂筛选试验 在培养基B5+30 g/L蔗糖+7 g/L琼脂+0.5 mg/L 6-BA+1.0 mg/L 2,4-D(pH 6.0)中分别加入1.5 g/L活性炭(AC)、2.0 g/L吡咯烷酮(PVP)、0.006 g/L维生素C(VC),将叶片外植体分别接种在这3种培养基上,培养条件同上,40 d后观察其褐变程度。诱导率(%)=愈伤组织数/接种后未污染的外植体数×100;褐变率(%)=褐变愈伤组织数/接种总数×100。
1.2.3 以带芽茎段为外植体的侧芽和不定根诱导培养基的筛选 以B5+30 g/L蔗糖+7 g/L琼脂为基本培养基(pH 6.0),加入不同浓度配比的6-BA和IBA,建立9种培养基(表1),接种葡萄带芽茎段,在上述培养条件下培养15 d后观察侧芽萌发和不定根诱导情况。侧芽萌发率(%)=侧芽萌发数/接种外植体总数×100;生根率(%)=生根外植体数/接种外植体总数×100。
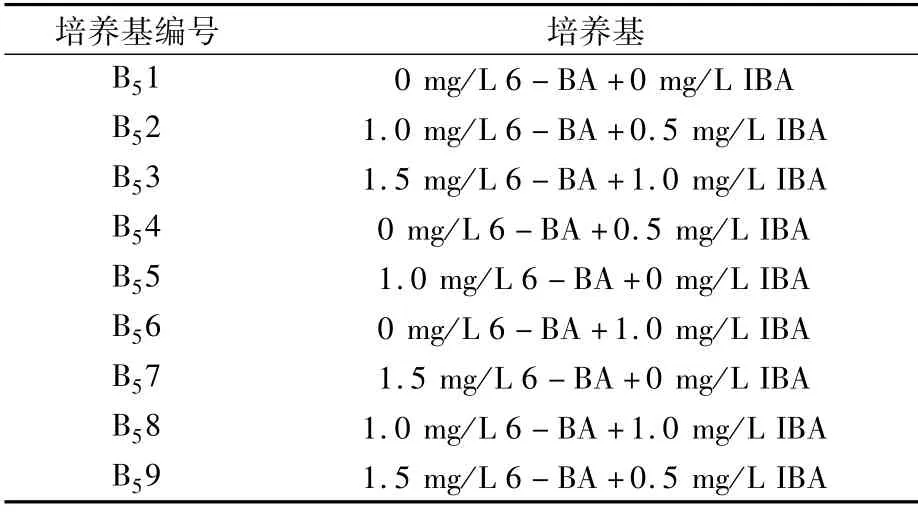
表1 侧芽和不定根诱导培养基
1.2.4 以叶片和卷须为外植体的愈伤组织诱导培养基的筛选 在培养基B5+30 g/L蔗糖+7 g/L琼脂+1.5 g/L活性炭+0.5 mg/L 6-BA中分别加入0、1.0、2.0 mg/L 2,4-D,建立3种培养基,如表2所示,调pH 6.0,分别接种克瑞森无核葡萄的叶片和卷须,培养条件同上,进行愈伤组织诱导培养。
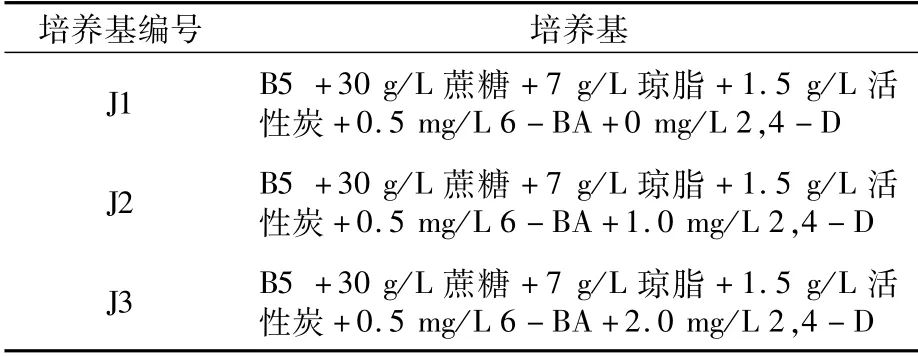
表2 以叶片和卷须为外植体的愈伤组织诱导培养基
1.3 数据处理与分析
利用Microsoft Excel 2007软件进行数据处理及统计分析。
2 结果与分析
2.1 0.1%升汞浸泡时间对克瑞森无核葡萄带芽茎段消毒效果的影响
由表3可以看出,用0.1%升汞溶液消毒6 min时,既保证了污染率和褐变率较低,又获得了较高的成活率,其污染率仅为10.0%,褐变率为16.7%,成活率为76.7%;而用0.1%升汞溶液消毒3 min时,污染率最高,为80.0%,褐变率和成活率均最低,分别为3.3%和16.7%。可见,用0.1%升汞溶液对克瑞森无核葡萄带芽茎段处理时间短时,褐变率较低,但污染率高;随处理时间延长,污染率低,但褐变率呈上升趋势。因此,适宜克瑞森无核葡萄带芽茎段外植体的消毒方法是先用75%酒精浸泡消毒1 min,再用0.1%升汞溶液消毒6 min,效果最好。
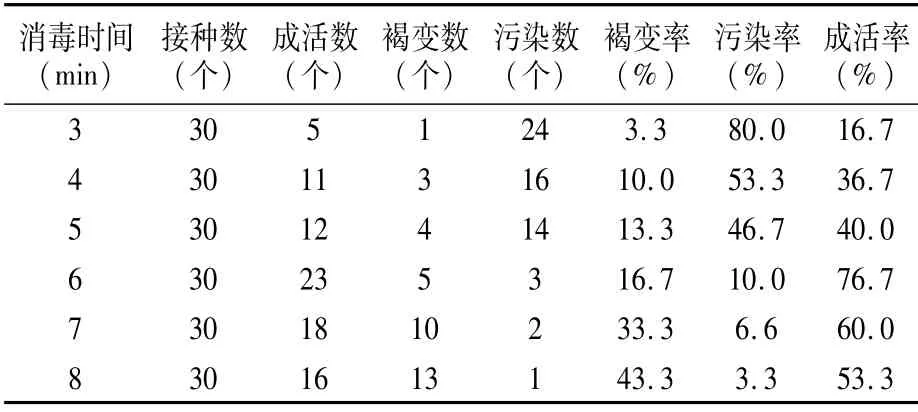
表3 0.1%升汞不同浸泡时间的克瑞森无核葡萄带芽茎段消毒效果
2.2 不同抗褐变剂对克瑞森无核葡萄叶片外植体褐变的影响
将处理好的克瑞森无核葡萄叶片分别接种在添加不同抗褐变剂AC、PVP、VC的培养基上,在无菌条件下培养7 d后,叶片逐渐向培养基中凹陷,在伤口位置出现褐变现象(图1)。从表4可以看出,不同种类抗褐变剂对叶片外植体褐变影响不同,褐变率表现为PVP<AC<VC,以添加VC的褐变率最高,达到45.0%;以添加PVP的褐变率最低,仅有25.0%。因此,对于克瑞森无核葡萄叶片外植体来说,抗褐变效果最好的是PVP。
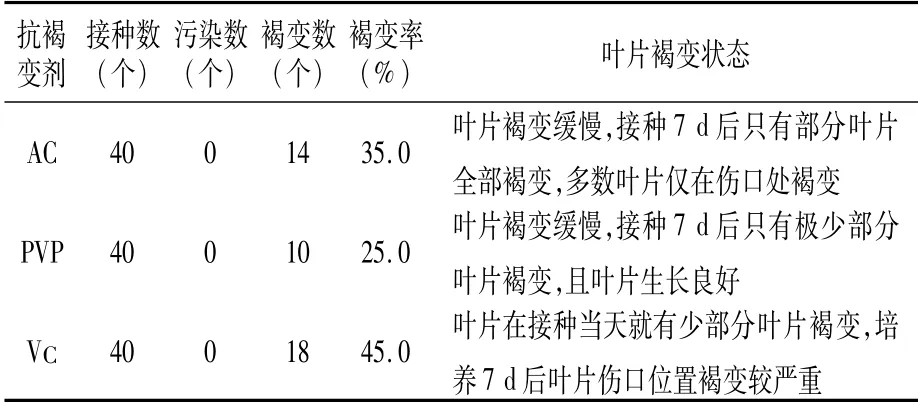
表4 不同抗褐变剂对克瑞森无核葡萄叶片外植体褐变的影响

图1 不同抗褐变剂处理下克瑞森无核葡萄叶片褐变情况
2.3 克瑞森无核葡萄不同器官离体培养的激素条件筛选
2.3.1 不同激素组合对克瑞森无核葡萄带芽茎段侧芽和不定根产生的影响 由表5和图2可以看出,IBA和6-BA浓度配比不同,对克瑞森无核葡萄带芽茎段的侧芽和不定根诱导也不同。B52培养基的侧芽和不定根诱导率均最高,分别为80.2%和78.8%;其次为B58培养基,侧芽和不定根诱导率分别为78.5%和78.3%;而B51培养基的侧芽诱导率仅为13.0%,且未产生不定根。B51、B55、B56培养基均未诱导出不定根,而这3种培养基中均未添加IBA,表明在诱导不定根产生的初代培养中IBA起到了主导作用。B51、B54、B56培养基的侧芽长势不好,芽细弱,而这3种培养基均未添加6-BA,说明6-BA对侧芽的萌发有促进作用。B58培养基虽然侧芽萌发和不定根的诱导率也较高,但产生了大量的愈伤组织,这不利于侧芽和不定根的生长,而这些愈伤组织可以通过继代诱导产生不定芽得到再次利用。综上,激素的使用对外植体侧芽萌发和不定根诱导起到关键作用,以克瑞森无核葡萄带芽茎段为外植体,适宜侧芽萌发和不定根诱导的培养基是B5+30 g/L蔗糖+7 g/L琼脂+1.0 mg/L 6-BA+0.5 mg/L IBA。

图2 不同激素组合培养基上克瑞森无核葡萄侧芽和不定根生长情况
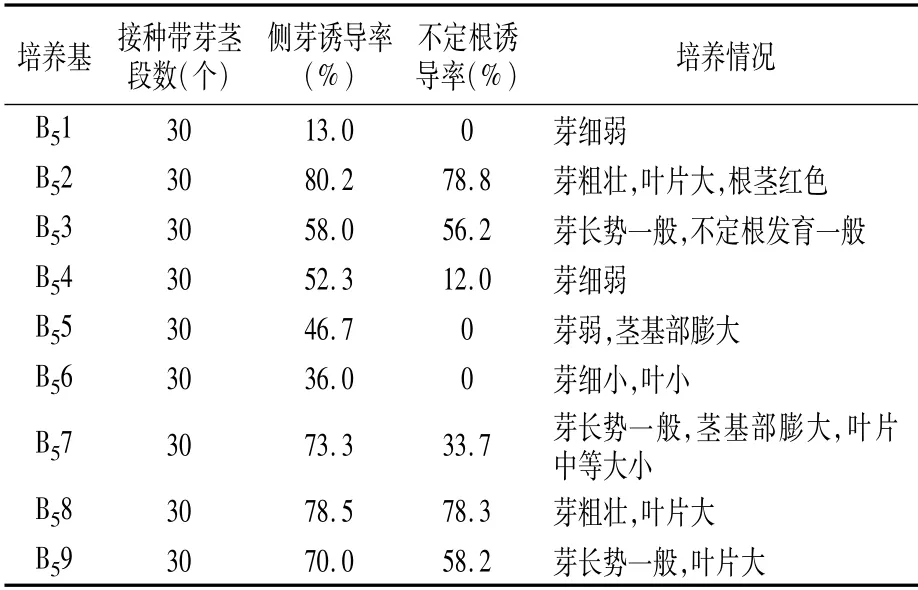
表5 不同激素组合对克瑞森无核葡萄带芽茎段侧芽和不定根产生的影响
2.3.2 2,4-D不同添加浓度对叶片和卷须外植体愈伤组织诱导的影响 从表6可以看出,以叶片为外植体进行培养时,添加2,4-D可以明显提高愈伤组织的诱导率,其中以添加1.0 mg/L 2,4-D(J2)的愈伤组织诱导率最高,可达到91.7%,且愈伤组织生长旺盛,质地紧密(图3)。因此,适宜克瑞森无核葡萄叶片愈伤组织诱导的培养基是J2培养基。
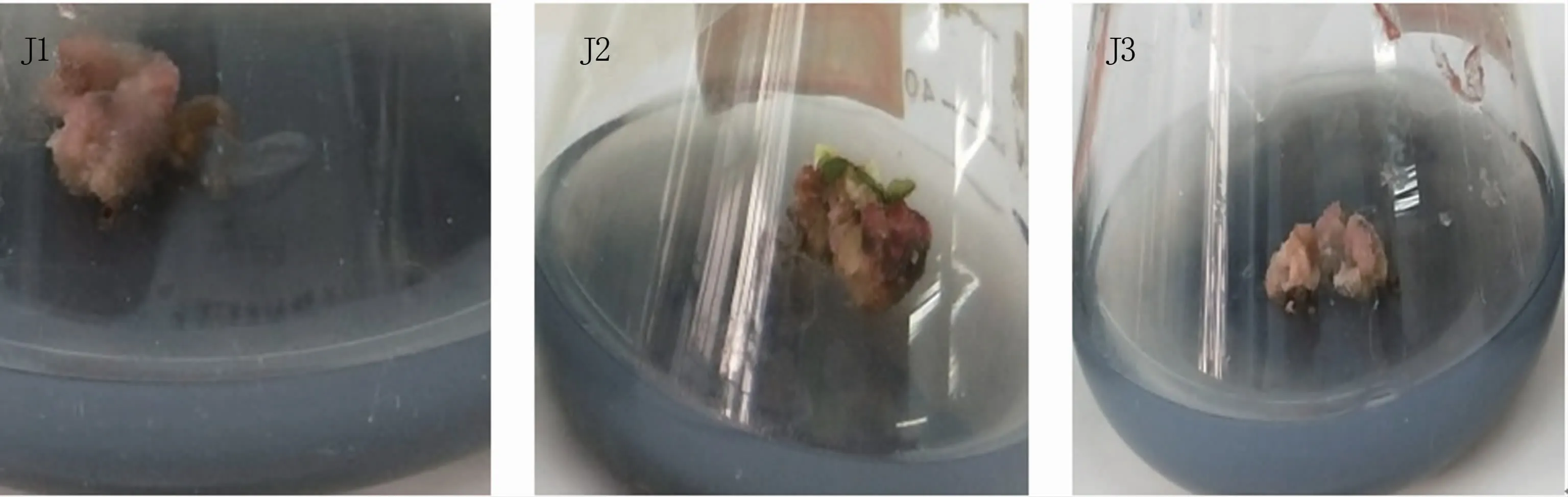
图3 不同浓度2,4-D处理下葡萄叶片的愈伤组织诱导情况
以卷须为外植体进行培养时,添加2,4-D也明显提高了愈伤组织的诱导率,以添加2.0 mg/L 2,4-D(J3培养基)的诱导率最高,为80.0%(表6),愈伤组织生长量多且质地紧密(图4)。可见,适合克瑞森无核葡萄卷须愈伤组织诱导的培养基为J3培养基。
图4 不同浓度2,4-D处理下葡萄卷须的愈伤组织诱导情况

表6 以叶片和卷须为外植体的愈伤组织诱导情况
3 讨论与结论
本研究发现外植体的污染和褐变是植物组织培养的主要障碍。有关外植体消毒方面,前人已做过大量研究[8-12],选用适合的药剂是保证外植体消毒效果的关键,另外,消毒剂处理时间不同,消毒效果也不相同。外植体消毒杀菌处理时间越短,杀灭外植体所带病菌越不彻底,培养基越容易发生霉变,而褐变率相对较低;处理时间越长,培养基污染率越低,但褐变率越高。陈云风等[13]研究表明在消毒剂中加入抗生素能有效抑制细菌的生长;胡文斌等[14]认为陇南红提葡萄外植体采用75%酒精消毒60 s后再用0.1%升汞消毒8 min时的成活率适宜;沈传进等[15]的研究也表明无核白和早熟红无核2个品种的外植体采用75%酒精消毒60 s后再用0.1%升汞(内加1%食盐)消毒8 min的效果最佳。赖呈纯等[16]综合考虑污染率和褐变率,认为福建野生葡萄带芽茎段使用升汞消毒9 min为宜。本研究结果表明,对于克瑞森无核葡萄带芽茎段,先用75%酒精消毒60 s,再用0.1%升汞浸泡6 min的消毒效果最佳。
褐变现象在植物进行离体培养时是普遍存在的[17],但不同植物的适宜抗褐变剂种类及浓度不同。李张等[18]在研究抗褐变剂对南方红豆杉愈伤组织褐变及相关物质含量的影响中表明,聚乙烯吡咯烷酮(PVP)、活性炭(AC)、维生素C(VC)和硫代硫酸钠(Na2S2O3)均有一定的抗褐变效果,以硫代硫酸钠的效果最好。陈爱萍等[19]在苜蓿和红豆愈伤组织继代培养抗褐变的研究中,对PVP、柠檬酸与硝酸银(AgNO3)的抗褐变效果进行对比发现,对愈伤组织褐变抑制效果较好的是AgNO3,这与郭鹏辉等[20]在藏药柳茶中的研究结果一致。叶睿华等[21]在AgNO3、VC、AC、PVP、Na2S2O35种抗褐变剂对杜鹃兰原球茎增殖培养的作用效果研究中发现,AC的抗褐变效果最佳。吴婉婉等[22]在茶树茎段组织培养过程中选用AC与PVP 2种抗褐变剂,发现抗褐变效果最好的是AC。饶慧云等[23]在研究抗褐变剂对葡萄愈伤组织继代培养过程中酚类物质、相关酶及其基因表达的影响试验中表明,PVP的抗褐变效果最好。本试验以克瑞森无核葡萄的叶片为外植体,比较了PVP、AC与VC的抗褐变效果,结果表明抗褐变效果最好的是PVP,这与饶慧云等[23]的试验结论相吻合。
植物激素的种类和浓度是影响植物愈伤组织诱导、侧芽和不定根发生、继代培养等的最重要因素[24,25]。外植体诱导部位不同,使用的生长调节激素不同。李国树等[26]用不同的激素诱导葡萄外植体的不同部位,结果表明适宜葡萄茎尖诱导的培养基是1/2MS+1.5 mg/L 6-BA+0.10 mg/L IBA。宾宇波等[27]研究发现1/2MS+0.1 mg/L NAA+1.0 mg/L 6-BA为百花山葡萄不定根和侧芽诱导的适宜培养基。杨光等[28]研究发现状元红继代培养的适宜培养基是1/2MS+2.0 mg/L 6-BA +0.1 mg/L IBA。细胞分裂素与生长素的比例适中,对于保持继代愈伤组织的快速生长是必要的[29]。黄贞光等[30]筛选出适合多个葡萄品种生长的广谱B5培养基,其主要特点是含有较低的铵。本试验结果表明,以B5培养基为基本培养基,克瑞森无核葡萄侧芽和不定根诱导的适宜激素配方是1.0 mg/L 6-BA +0.5 mg/L IBA。
外植体类型的选择对愈伤组织诱导极为重要。杨解解等[31]在文县纹党愈伤组织诱导的初步研究中发现,叶片的诱导率最低。常新等[32]在研究黑香蕉葡萄不同器官发生途径再生体系的优化试验中,以叶片、茎尖分生组织和叶柄为外植体,发现用茎尖分生组织更容易诱导出再生体系。吴顺等[33]在研究钩藤愈伤组织诱导与植株再生时,分别以嫩茎、嫩枝、嫩叶为外植体建立植株再生体系,结果发现以嫩枝作为外植体的出愈情况较好。本试验以克瑞森无核葡萄的叶片和卷须为外植体进行愈伤组织诱导,结果表明,以叶片为外植体的愈伤组织诱导率较高,达91.7%。
本研究结果可为克瑞森无核葡萄的离体培养以获得再生植株提供理论依据。
