清营口服液抑制H1N1猪流感病毒复制作用的研究
2021-08-30解云辉林树乾黄中利殷斌杨世发祝钰玮闫振贵吴家强刘月月
解云辉,林树乾,黄中利,殷斌,杨世发,祝钰玮,闫振贵,吴家强,刘月月
(1.山东省农业科学院家禽研究所,山东 济南 250100;2.山东省畜禽绿色保健品创制工程实验室,山东 济南 250023;3.山东农业大学动物科技学院,山东 泰安 271018;4.山东省农业科学院畜牧兽医研究所,山东 济南 250100)
猪流感病毒(swine influenza virus,SIV)属正粘病毒科甲型流感病毒属,是一种具有广泛感染范围的分节段的、单股负链的RNA病毒[1],主要感染哺乳类动物和禽类[2]。甲型流感病毒根据其表面抗原血凝素(HA)和神经氨酸酶(NA)的不同,目前分为17个亚型(H1~H17)和10个亚型(N1~N10),流感病毒可根据HA和NA多样的排列组合,形成多种不同的亚型[3,4]。SIV含有8个基因组片段,当同类型的两种或两种以上不同的病毒感染同一个宿主细胞时,这些病毒的所有基因片段都可以在病毒增殖传播中交换、重组,从而产生新的基因重组病毒[5]。在流感病毒感染细胞后,病毒的RNA进入细胞核中,并在此进行复制,从而产生新的子代病毒,并转运出核[6]。甲型流感病毒的NP蛋白是最主要的结构蛋白,因此可以通过检测NP蛋白的核定位从而对甲型流感病毒感染细胞的程度进行初步判断。目前用于治疗流感病毒感染的药物主要包括M2离子通道阻滞剂和神经氨酸酶抑制剂[7],然而由于氨基酸的突变,耐药性越来越强[8]。因此,迫切需要开发新的抗流感药物。中药有多成分、多途径、多靶点的特点[9],不仅能够抑制病毒,还有提高机体免疫功能的保健功效。H1N1 SIV在流感病毒流行中扮演重要角色,因其不仅能够感染猪,还能够感染其他哺乳动物和禽类,甚至是人类[10,11],从而导致流感大流行和季节性流行。因此本研究旨在开发一种新的抗SIV药物,为在临床上降低SIV的感染率、发病率提供基础。
清营口服液由古方清营汤改造而成,以前广泛用于治疗太阴温病、手厥阴暑温、暑痫、阳明温病等[12]。现代药理学研究也证明了清营汤在疾病治疗中的作用,如清营汤合生脉散加减可用于治疗脓毒症[13];清营汤治疗别嘌醇过敏致急性肾损伤[14];清营汤加减对糖尿病肾病热毒血瘀型在临床上也起到了积极效果[15]。在兽医临床方面,通过动物试验发现清营口服液对Wistar大鼠和鸡感染大肠杆菌有良好的预防和治疗效果,适合治疗由大肠杆菌引起的家禽热证[16]。由于清营口服液主治热入营分证,猪流感能够引起猪的热证,因此,本试验针对体内和体外试验对清营口服液抑制甲型H1N1亚型猪流感病毒的作用进行研究。
1 材料与方法
1.1 试验材料
1.1.1 药物 清营口服液组方(500 g):水牛角69 g、金银花69 g、麦冬51 g、生地黄69 g、连翘52 g、玄参69 g、黄连35 g、竹叶34 g、丹参52 g,将原材料加10倍量水浸泡30 min,煎煮2 h,过滤;第二次加5倍量水,煎煮0.5 h,过滤。合并两次滤液,浓缩至500 mL,4℃保存,备用。上述原材料采购自济南市建联中药有限公司;连花清瘟颗粒由北京以岭药业有限公司提供;利巴韦林对照品购自中国食品药品检定研究院。
1.1.2 试验动物 SPF鸡(9~11日龄)由山东省农业科学院家禽研究所昊泰动物繁育中心提供,C57BL/6小鼠购自济南朋悦试验动物繁育有限公司。
1.1.3 细胞与毒株 MDCK细胞(犬肾细胞)由山东省家禽疫病诊断与免疫重点实验室赠与;H1N1病毒株分离自发病猪(山东省泰安市某养殖场)的肺脏组织。
1.1.4 主要试剂 Anti-H1N1甲型流感virus Nucleocapsid蛋白抗体购自Abcam公司;Evo MMLV反转录试剂盒Ⅱ、SYBR GreenPro TaqHS预混型qPCR试剂盒购自Accurate Biology公司;Foetal Bovine Serum购自Biological Industries公司;Star Marker D2000购自GenStar公司;Phosphate Buffered Saline、DMEM/HIGH GLUCOSE购自HyClone公司;Cy3标记山羊抗兔IgG购自Servicebio公司;DAPI溶液购自Solarbio公司;rTaq酶、RNAiso Plus购自TaKaRa公司;Cell Counting Kit-8购自北仁化学科技有限公司。
1.2 试验方法
1.2.1 病毒分离鉴定及纯化 取发病猪的肺脏组织,使用Trizol法提取病毒RNA,使用反转录试剂盒将RNA反转为cDNA,按照TakararTaq说明书PCR扩增病毒后进行核酸电泳检测。PCR扩增程序:95℃5 min;95℃30 s,56℃30 s,72℃30 s,共36个循环;72℃5 min。引物序列如表1所示。

表1 试验所用引物
取肺脏组织研磨至匀浆状,使用0.22μm滤器过滤,接种到SPF鸡胚中,96 h后收取鸡胚尿囊液为第一代病毒液并连续传代5代。
1.2.2 体内抗病毒试验 (1)中药制剂反复给药急性毒性试验:取24只雄性小鼠,适应性喂养5 d,称重后随机分为4组,每组6只,分为空白对照组,清营口服液高、中、低(1.50、0.75、0.38 g/kg)剂量组。小鼠每天固定时间灌胃,0.02 mL/g连续灌胃7 d,对照组灌胃等体积PBS,每天观察临床表现,每两天称重一次,共观察14 d,计算体重比。体重比=当天的体重/初始体重。试验结束前12~16 h禁食不禁水,采血做血常规和生化检测。
(2)流感病毒半数感染量(ID50)测定:将H1N1 SIV在SPF鸡胚内增毒,收集鸡胚尿囊液后依次稀释10倍为10-1、10-2、10-3、10-4浓度的病毒液。取25只雄性小鼠,适应性喂养5 d,称重后随机分为5组,每组5只,分别为空白对照组和病毒对照组(10-1~10-4)。病毒对照组小鼠经乙醚麻醉后,滴鼻感染不同浓度的病毒液50μL,空白对照组小鼠滴鼻50μL PBS,每天观察临床反应,记录死亡时间,统计死亡数(24 h内死亡的不计入死亡数)、体重下降小鼠数、精神不佳小鼠数,观察14 d,利用Reed-Muench法计算病毒的半数感染量。
(3)小鼠感染模型建立及给药:将42只雄性小鼠适应性喂养5 d,称重后随机分为6组,每组7只,分为空白对照组,病毒对照组,清营口服液38、75、150 mg/kg剂量组,连花清瘟(药物对照)组。乙醚麻醉后用PBS滴鼻作为空白对照组,其余各组100ID50滴鼻50μL/只,病毒感染4 h后开始灌胃药物,连续灌胃5 d,空白对照组和病毒对照组给予与中药等体积的生理盐水。每两天测量一次小鼠体重,计算体重比。
(4)肺指数测定:连续灌胃5 d后,将小鼠用脊椎脱臼法处死,称取体重后剖开胸腔取出肺组织称重。肺指数=肺重/体重。
(5)肺组织切片观察:取各组小鼠相同部位的肺组织,4%多聚甲醛进行固定后,送至武汉塞维尔生物科技有限公司切片制作,苏木精-伊红染色法染色(HE染色),于显微镜下观察肺脏的病变情况并拍照。
(6)肺组织病毒载量测定:每组取3只小鼠相同部位、相同大小的肺组织,放入1.5 mL离心管,加入1 mL RNAiso Plus,研磨成肺组织匀浆,提取RNA,使用反转录试剂盒将RNA反转为cDNA。按照SYBR GreenPro TaqHS预混型qPCR试剂盒说明书进行体系配制,荧光定量PCR程序:95℃30 s;95℃5 s,60℃30 s,72℃10 s,共40个循环;95℃10 s,65℃60 s,97℃1 s。使用2-ΔΔCt方法计算基因表达水平的倍比变化,所有PCR反应均重复3次。
1.2.3 体外抗病毒试验 (1)病毒毒力检测:将MDCK细胞铺于96孔板中培养至单层,弃去孔中液体,用PBS清洗细胞2次。用病毒生长液将病毒按10倍倍比稀释为不同浓度,加入96孔板,每孔100μL,每个浓度8复孔;设空白对照组(正常细胞),加入病毒生长液,每孔100μL。放入细胞培养箱中吸附2 h后弃去病毒液,加入病毒生长液100μL,继续培养,每天观察细胞病变情况,直到细胞不再出现新的病变。显微镜观察并记录每个稀释倍比下出现细胞病变的孔数,记录细胞病变效应(CPE),按照Reed-Muench法计算病毒的组织细胞半数感染量(TCID50)。
(2)供试品细胞毒性检测:将MDCK细胞铺于96孔板中培养至单层,弃去孔中液体,将对半稀释后不同浓度的清营口服液、利巴韦林分别加入96孔板,对照组细胞不加药品,培养72 h后弃去含药培养基,PBS清洗2次,每孔加入10μL的CCK-8溶液,混匀。继续培养2 h,用酶标仪检测每孔的吸光度(A)值,检测波长为470 nm,根据测得的A值,按照公式计算细胞存活率。
细胞存活率(%)=试验组A值/对照组A值×100。
(3)清营口服液对H1N1 SIV的抑制作用:将MDCK细胞铺于24孔板中培养至单层,弃去24孔板中液体,用PBS清洗细胞2次。加入100TCID50病毒液与不同浓度清营口服液的混合物,作用48 h后提取RNA。
为探究清营口服液在不同阶段的作用效果,设置三种模式:吸附前期、吸附期和吸附后期(图1),同时设立正常细胞对照组和病毒对照组。
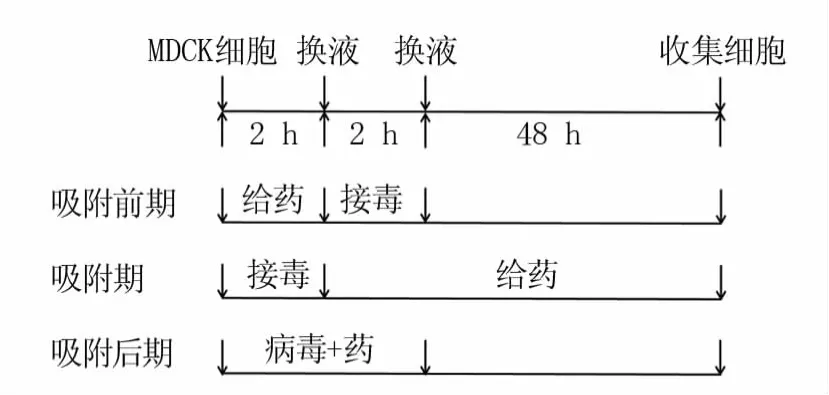
图1 药物作用模式图
吸附前期:将清营口服液不同浓度稀释液分别加入细胞中,37℃孵育2 h后换液成100TCID50病毒液,作用2 h后弃去24孔板中液体,加入400 μL维持液(含2% FBS的DMEM),48 h后提取RNA。
吸附期:向细胞中加入100TCID50病毒液,37℃感染2 h后换液成清营口服液不同浓度稀释液,48 h后提取RNA。
吸附后期:将100TCID50病毒液分别与清营口服液不同浓度稀释液混合,将混合物放于37℃作用1 h后分别加入24孔板中,作用4 h后弃去24孔板中的液体,加入400μL维持液,48 h后提取RNA。
(4)细胞病毒载量测定:将上一步提取的RNA用试剂盒反转录成cDNA,进行实时荧光定量检测。
(5)免疫荧光试验:将MDCK细胞铺于24孔板至细胞长至单层,吸出培养基,加入病毒与不同浓度药物的混合物,同时设置空白对照组、病毒对照组、利巴韦林对照组,作用48 h后进行免疫荧光试验。
吸出孔中液体,每孔加入400μL用PBS配置的4%甲醛室温固定20 min;弃掉孔中液体,每孔加入400μL PBS洗涤3次,每次3 min;每孔加入400μL用PBS配置的0.1% Triton X-100,室温通透15 min;每孔加入400μL PBS洗涤5次,每次3 min;每孔加入400μL用PBS配置的5%BSA,室温封闭30 min;每孔加入400μL PBS洗涤3次,每次3 min;用PBS按照一抗说明书浓度配置好一抗稀释液,每孔加入200μL,将12孔板置于湿盒中,4℃过夜;吸出一抗,每孔加入400 μL PBS洗涤5次,每次3 min;用PBS按照二抗说明书配置好二抗稀释液,每孔加入200μL,置于37℃温箱避光孵育1 h;每孔加入400μL PBS洗涤3次,每次3 min;每孔加入400μL DAPI,室温避光染色10 min;使用荧光倒置显微镜观察细胞,拍照。
2 结果与分析
2.1 猪流感病毒的分离与鉴定
发病猪在1月龄左右(图2A),表现高热发抖,皮肤发红,食欲减退,活动减少,并伴有喷嚏、鼻炎、咳嗽等症状。随着病程发展,发病猪出现呼吸困难、卧地不起,最终死亡。对猪场其余猪进行抗流感药物治疗后,症状有所缓解。剖检后发现气管粘膜充血,喉头有轻微出血,肺脏有充血、实变等症状(图2B)。对死亡猪的病料进行RNA提取,RT-PCR检测,确诊为H1N1流感病毒,同时对引起猪高热的其他常见疾病,包括猪瘟、猪繁殖与呼吸综合征、猪圆环、猪伪狂犬进行病原检测,结果均为阴性(图2C)。将该病毒样研磨稀释100倍后接种至SPF鸡胚,于96 h后收集尿囊液,连续传代5代后,测得血凝效价为25,收集尿囊液冻于-80℃备用。
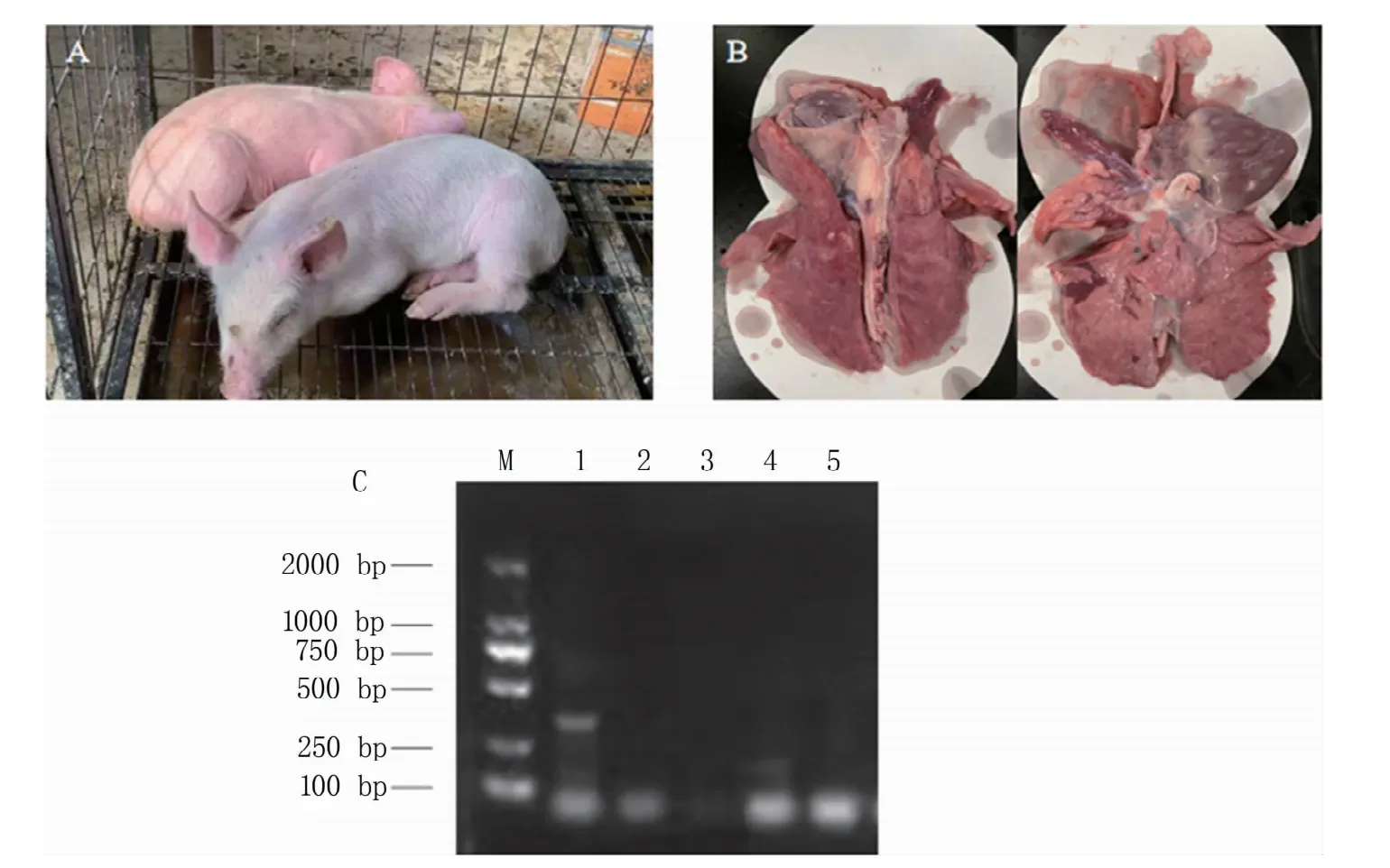
图2 发病猪(A)、临床剖检病变(B)和PCR鉴定结果(C)
2.2 体内抗病毒试验结果
2.2.1 清营口服液对小鼠的毒性作用 本试验在开始给药后的第0、2、4、6、8、10、12、14 d对小鼠进行体重测量,结果显示,0.38、0.75、1.50 g/kg剂量组和空白对照组的小鼠体重均为上升趋势(图3),PBS对照组最大增幅为原体重的5.77%,0.38 g/kg清营口服液组最大增幅为原体重的5.95%,0.75 g/kg清营口服液组最大增幅为原体重的7.24%,1.50 g/kg清营口服液组最大增幅为原体重的6.49%,表明3种剂量清营口服液均未对小鼠体重增长产生不良影响。
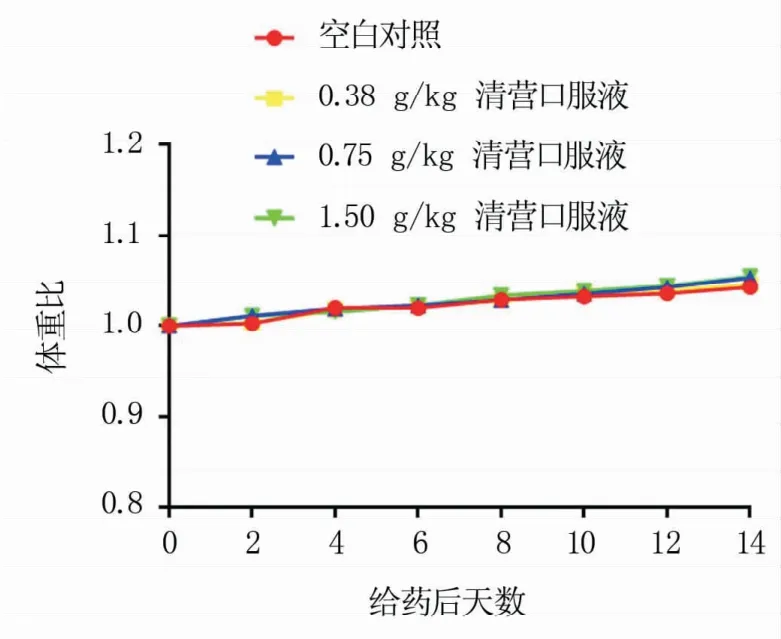
图3 不同剂量清营口服液对小鼠体重比的影响
血常规检测结果(表2)和生化检测结果(表3)均显示,各给药组与空白组均无明显差异,表明清营口服液按最大剂量给药对小鼠无毒性。
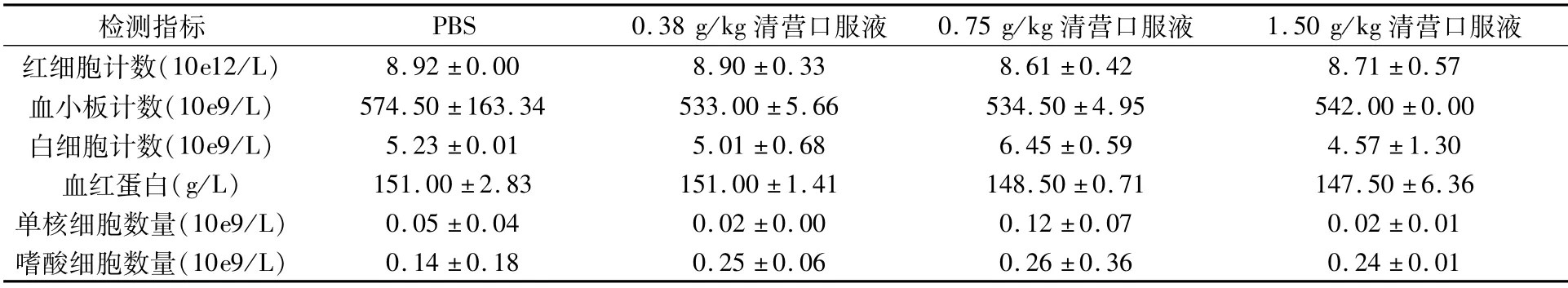
表2 小鼠血常规测定

表3 小鼠生化指标测定
2.2.2 半数感染量(ID50) 利用Reed-Muench法计算病毒的半数感染量(ID50)为10-4.48。
2.2.3 小鼠感染给药后体重比 由图4可知,0~2 d所有小鼠体重均上涨,空白对照组体重增长率为11.0%,病毒对照组为10.6%,给药组平均为14.0%;第2~4 d空白对照组体重增长率为11.5%,病毒对照组为9.7%,给药组平均为11.9%;第4~6 d所有小鼠体重较前两天均下降,空白对照组体重增长率为10.8%,病毒对照组为5.1%,给药组平均为5.7%。综上,从清营口服液对感染H1N1 SIV后小鼠体重的影响来看,药物全程均有抗病毒效果,在0~2 d药效最明显。
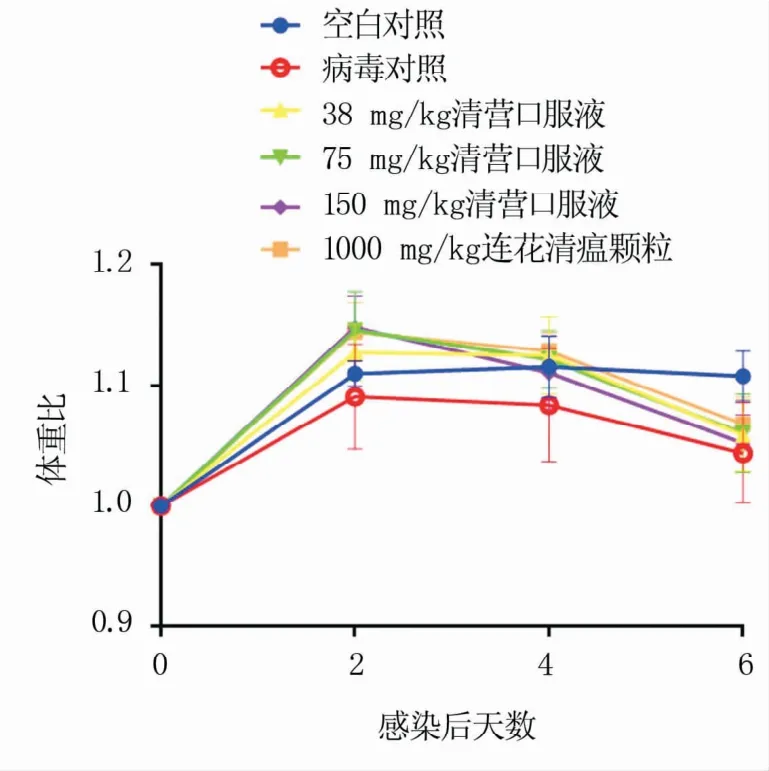
图4 感染给药模型小鼠体重比
2.2.4 小鼠感染给药后肺指数 对小鼠剖检时发现,空白对照组小鼠肺脏呈淡红色,无病变;病毒对照组小鼠肺脏出现明显水肿,呈暗红色,表面有出血点;各药物治疗组小鼠肺呈淡红色,偶见出血点。数据分析结果(图5)显示,病毒对照组与空白对照组肺指数有显著差异;各药物治疗组与空白对照组差异不显著,表明清营口服液对小鼠体内H1N1流感病毒有良好的治疗效果。
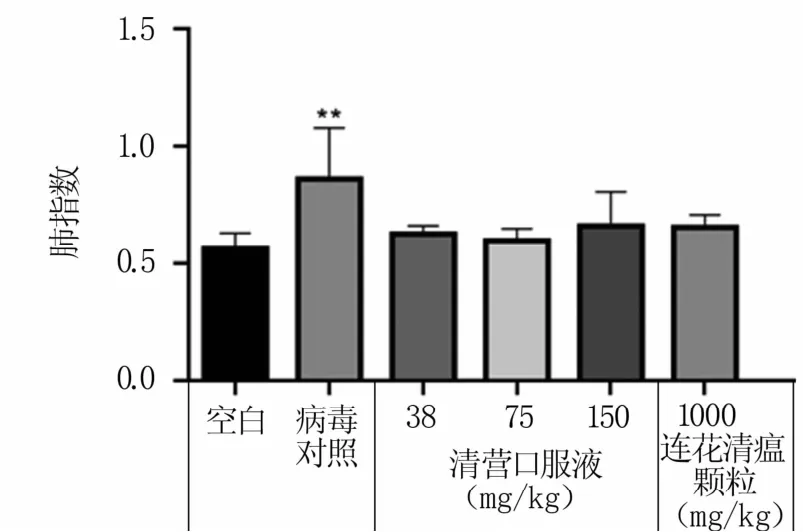
图5 感染给药后小鼠肺指数
2.2.5 各组病毒载量的变化 肺组织病毒载量检测结果(图6)显示,给药组与病毒对照组小鼠肺组织病毒载量差异达极显著水平,说明清营口服液对小鼠体内H1N1 SIV有抑制作用,平均抑制率达99.41%。
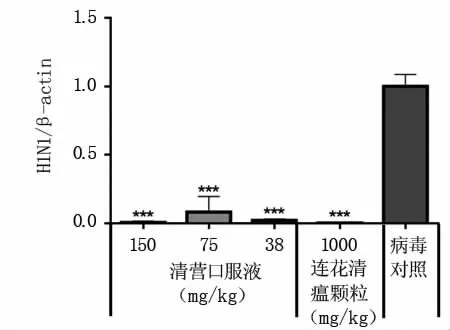
图6 感染给药后小鼠肺组织病毒载量
2.2.6 小鼠肺组织病理检查 染色结果(图7)显示,空白对照组肺泡壁较薄,无充血、出血现象,肺巨噬细胞较少;病毒对照组肺泡壁增厚,毛细血管充血,肺巨噬细胞增多;150 mg/kg清营口服液给药后与连花清瘟给药后肺巨噬细胞少量增多,无充血、出血现象,肺泡壁无明显变化;75 mg/kg清营口服液给药后肺泡壁轻微增厚,有轻微的出血现象,肺巨噬细胞增多;38 mg/kg清营口服液给药后肺泡壁严重增厚,充血现象明显,肺巨噬细胞增多。因此,150 mg/kg清营口服液对小鼠体内H1N1 SIV的治疗效果最好,75 mg/kg和38 mg/kg清营口服液效果一般。
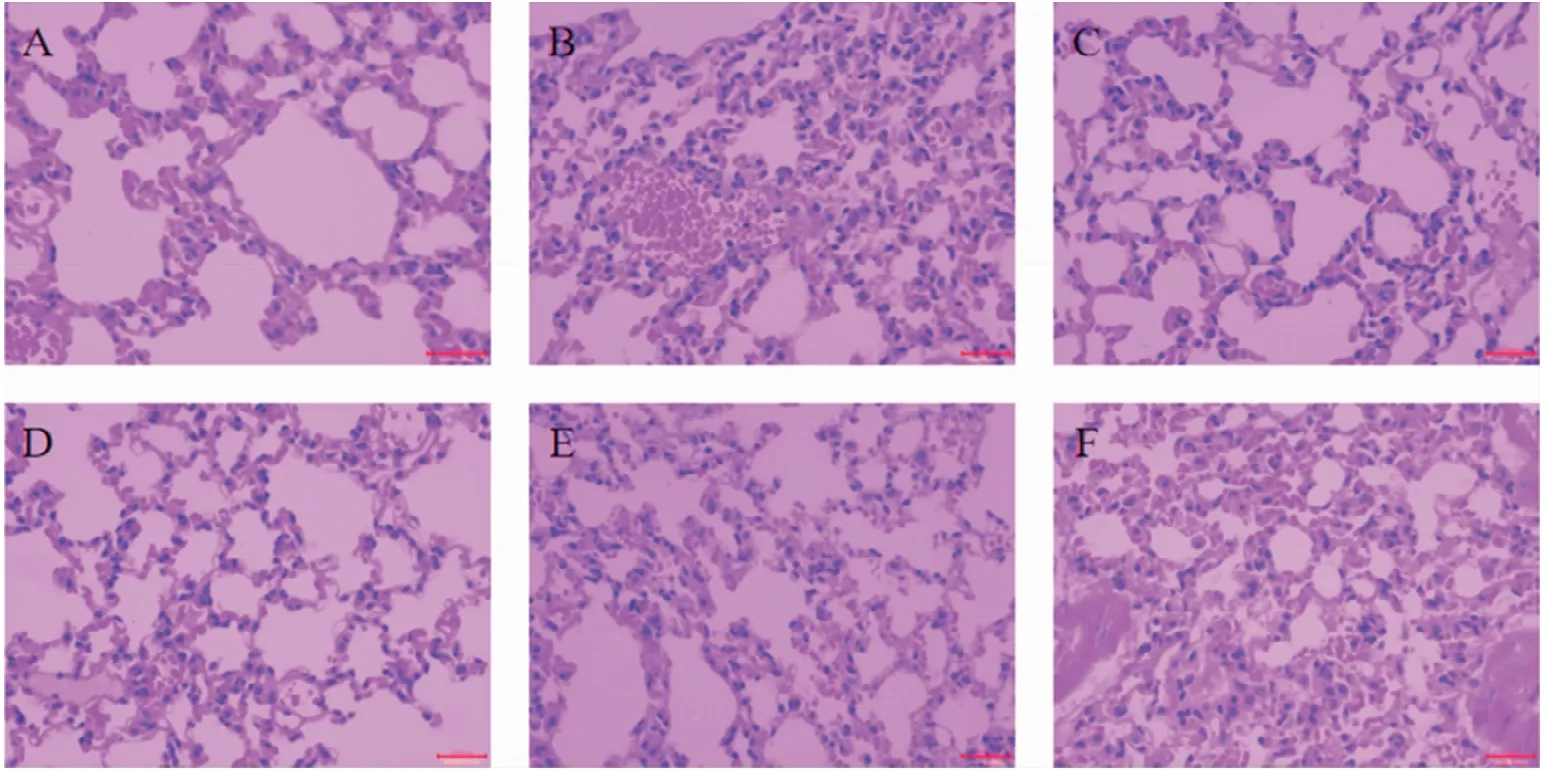
图7 感染给药后小鼠肺组织病理切片结果
2.3 体外抗病毒试验结果
2.3.1 H1N1 SIV对MDCK细胞的TCID50测定流感病毒感染MDCK细胞后会出现细胞变圆、空泡,细胞之间出现星状聚集成团、脱落、核固缩等现象;正常对照组的细胞状态良好,排列紧密。利用Reed-Muench法计算病毒的半数感染量(TCID50),每100μL为10-3.66。
2.3.2 细胞给药最大安全浓度测定 检测供试药物的细胞毒性是评价抗病毒药效的前提,在本试验中,细胞存活率≥85%被认为药物对细胞没有损伤。由图8可知,当清营口服液浓度为100 mg/mL和50 mg/mL时,细胞存活率小于85%,浓度≤25 mg/mL时,细胞存活率大于90%。使用同样方法测得对照药物利巴韦林的最大安全浓度为1.25 mg/mL。后续试验均以清营口服液和利巴韦林的最大安全浓度进行。
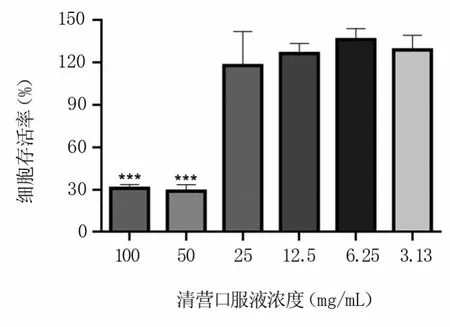
图8 清营口服液细胞毒性检测
2.3.3 药物对H1N1 SIV的抑制作用 病毒载量检测结果(图9)显示,在药物的安全范围内,随药物浓度增加,对H1N1 SIV的抑制效果增强,并且呈一定的量效关系。清营口服液和利巴韦林均可显著抑制流感病毒的增殖,其中25 mg/mL清营口服液对H1N1 SIV的抑制作用最明显。
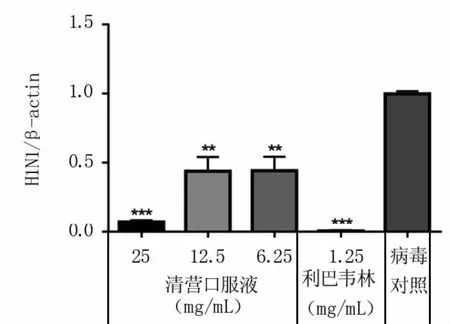
图9 不同药物及浓度下H1N1 SIV载量
为确定清营口服液在病毒生命周期中发挥作用的阶段,分别将不同浓度的药物作用于病毒吸附前期、吸附期和吸附后期并进行药效分析。结果(图10)表明,3种作用模式下,清营口服液均对H1N1 SIV表现出极显著(P<0.01)抑制效果,其中吸附后期的抑制效果最佳,25 mg/mL清营口服液在吸附后期对H1N1 SIV 的抑制率达96.8%,而吸附前期和吸附期的抑制率分别为95.6%和73.3%。以上结果表明,清营口服液具有抗H1N1 SIV活性,在感染的吸附后期效果最好。
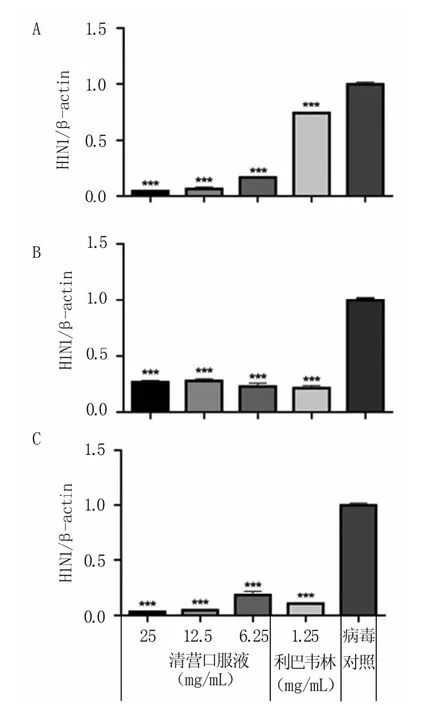
图10 清营口服液不同作用时期H1N1 SIV载量
2.3.4 药物对H1N1猪流感病毒核蛋白的抑制作用 NP蛋白在流感病毒复制过程中起重要作用,通过免疫荧光试验发现,H1N1 SIV感染MDCK细胞48 h后,病毒对照组NP蛋白弥散在细胞核和细胞质中(图11B),经过药物处理后,6.25 mg/mL清营口服液处理过的细胞核和细胞质中都存在绿色荧光(图11D),但12.5 mg/mL和25 mg/mL药物组只见细胞核中有明显绿色荧光,未见细胞质中有荧光存在(图11E、F),利巴韦林对照组细胞核内见明显荧光,细胞质中无荧光(图11C)。表明清营口服液能够有效抑制H1N1 SIV的NP蛋白核输出。
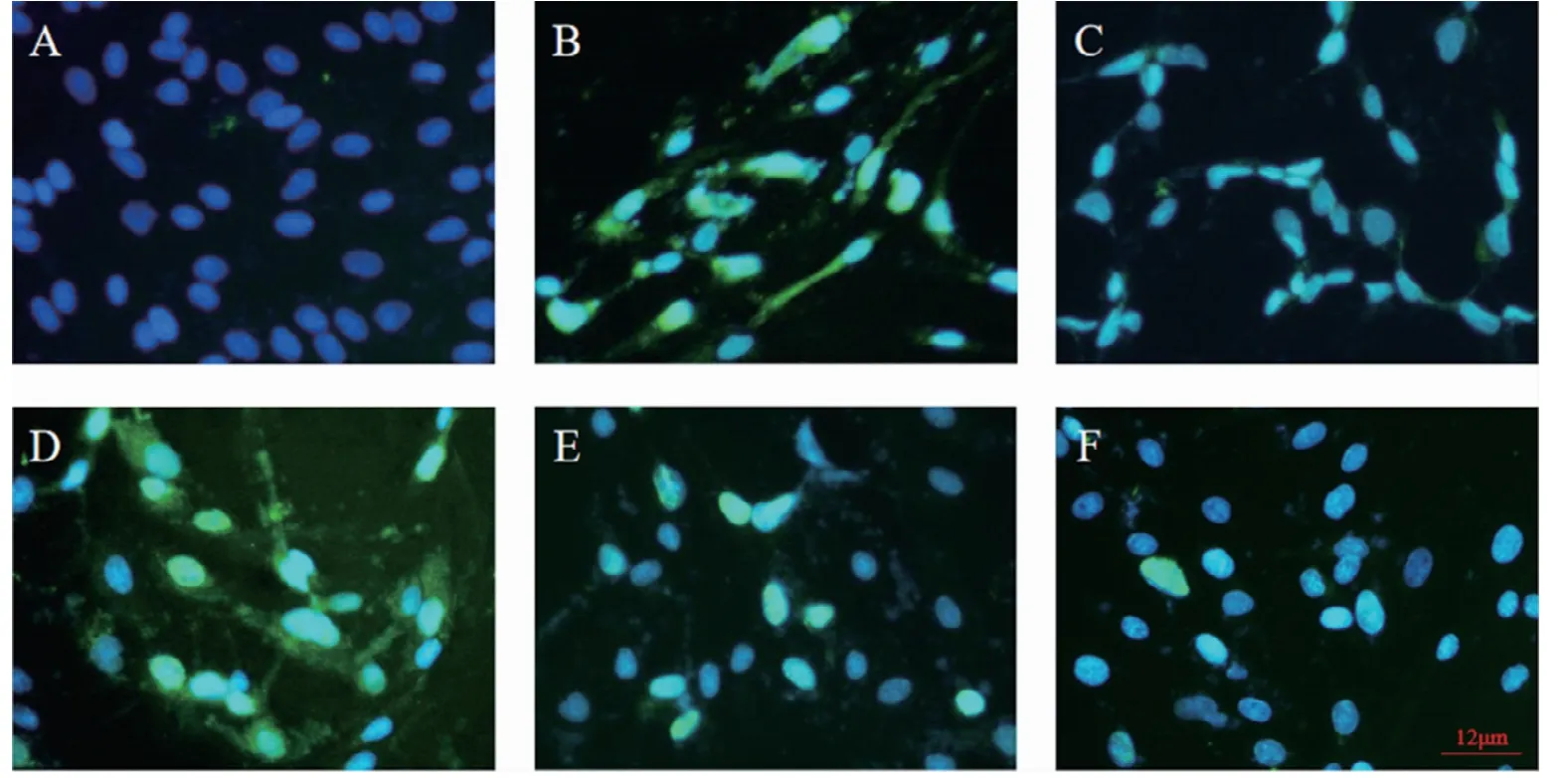
图11 免疫荧光检测清营口服液对H1N1 SIV的NP蛋白核输出的影响
3 讨论与结论
流感病毒可导致机体产生急性呼吸道症状,对人类公共卫生与健康造成极大威胁,猪有流感病毒“混合器”之称,与流感病毒的流行和爆发有着密不可分的联系。2009年爆发的猪源H1N1流感导致人体严重的流感样症状并引发了多种并发症,在人际间具有很高的传播性[17]。H1N1猪流感在我国猪群中一直存在并保持较高的流行率,2011年我国出现了人感染类禽H1N1亚型SIV事件[18];有研究人员监测到一株重组流感病毒G4EAH1N1,自2016年已成为国内猪流感病毒的主体[17],并具备在人群中流行的潜力。本课题组对山东省猪流感病毒进行检测时发现2020年的发病率和致死率均较往年有所升高,暗示该亚型病毒毒性可能逐渐增强。可见对该病毒进行防控具有重要的社会意义和经济意义。
中药是我国的瑰宝,在治疗疾病中发挥了重要角色,银屑病和阿尔茨海默症就被发现可以通过中药来治疗[19,20],尤其在2020年抗击新型冠状病毒肺炎的关键时刻,中草药的合理使用也在临床一线发挥出了重要优势[21]。清营口服液是本课题组研制的三类新兽药,由古方清营汤改造。清营汤目前对脓毒血症、糖尿病肾病热毒血瘀型发挥了良好的治疗效果,但对H1N1 SIV的抑制效果有待研究,故本课题使用改良方清营口服液针对体内和体外两方面进行了抗猪流感病毒效果的研究。
本课题组在山东省泰安市某养猪场病死猪的病料中鉴定出一株H1N1亚型猪流感病毒,通过对该株病毒的纯化,测得其血凝效价为25,在MDCK细胞上测得TCID50,每100μL为10-3.66。试验发现,清营口服液对小鼠无毒性,且对小鼠感染H1N1 SIV有明显的抑制效果。为进一步检测清营口服液抗流感病毒的作用,在细胞水平上对清营口服液抗猪流感病毒的药效进行了探究,结果发现清营口服液对病毒的抑制效果显著,且在吸附后期对H1N1 SIV的抑制效果最好,说明药物可以在细胞水平上起到良好的抗H1N1 SIV效果。利用免疫荧光试验检验清营口服液对NP蛋白的影响,发现25 mg/mL和12.5 mg/mL浓度的药物能够有效抑制NP蛋白的核输出,抑制病毒复制。综上所述,清营口服液在体内外对H1N1 SIV的复制均有明显的抑制作用。
