副猪嗜血杆菌Wza基因表达与结构预测分析
2021-08-27伊立超娄安钢
伊立超,娄安钢
副猪嗜血杆菌Wza基因表达与结构预测分析
伊立超,娄安钢*
(延边大学农学院,吉林 延吉 133000)
为了表达副猪嗜血杆菌Wza基因并获得表达产物的理化性质,试验参考GenBank中发表的副猪嗜血杆菌Wza基因序列(KC795491.1)进行重组真核表达质粒(pcDNA3.1-Wza)的构建,并在哺乳动物细胞293细胞鉴定蛋白的表达,同时分析Wza蛋白的理化性质,并预测其二级结构,并用在线软件预测Wza蛋白质的三级结构,为进一步探究其致病性提供理论基础。结果表明,成功构建pcDNA3.1-Wza质粒,并表达Wza蛋白。理化性质分析表明,其抗原指数较高。二级结构主要是β-折叠和无规卷曲,并且有许多抗原表位区域。
副猪嗜血杆菌;Wza基因;基因扩增;克隆;理化性质分析
副猪嗜血杆菌(Haemophilusparasuis,HPs)是一种多态性,非运动性,革兰氏阴性微细菌,属于巴斯德杆菌科的嗜血杆菌属。在某些情况下,它会侵入人体并引起以纤维性多发性浆膜炎、关节炎和脑膜炎为特征的全身性疾病。它已成为我国猪保育期间最普遍的继发性细菌感染和仔猪死亡的主要原因之一,因此,找到关键的致病因素拮抗细菌的致病尤为重要。副猪嗜血杆菌的致病因素研究一直是该领域的重点之一。目前,神经氨酸酶、菌毛、转铁蛋白和脂多糖都被认为是HPs的致病因子[1-2]。研究表明,有毒力的菌株可以抑制猪肺泡巨噬细胞(PAM)的吞噬作用,并且在与PAM相互作用后可以形成更明显的荚膜;而无毒力的菌株则不能形成荚膜[3-4]。但是,一些研究还发现,从健康猪的上呼吸道分离出的HPs菌株也有荚膜,但从病变部位中分离出的HPs没有荚膜产生,这表明HPs荚膜多糖合成基因(CapD)存在于HPs毒力菌株[1]。总之,尽管荚膜多糖是巴斯德氏菌细菌的公认毒力因子,并且已经进行了涉及荚膜与HPs毒力和致病性之间关系的研究,但已经进行了许多临床试验。分离株是通过对相关毒力因子进行比较研究得出的结论,因此除荚膜外可能还有其他毒力因子会影响实验结论。
目前的研究已经完成了一些不同菌株HPs的全基因组测序,并鉴定出HPs脂多糖O抗原基因簇,该基因簇的长度约为15 kb。同时,在基因簇中,已经鉴定出Wzx,Wzy,Wzc,Wzb和Wza基因。这些基因在O抗原的加工和呈递中发挥作用[5],并且还在荚膜多糖的生物合成中起重要作用。其中,Wza基因在荚膜多糖的转运中起着重要作用[6],Wza是完整的外膜蛋白,可为大分子量荚膜多糖的输出提供通道[7]。Wza蛋白是由340 kDa大分子物质组成的八聚体蛋白,其跨膜区为α螺旋,其结构与三个新的细胞质区域相连,被认为是一种新的具有代表性的外膜蛋白[8]。它位于该基因簇的11~12 kb之间,大小约为1 200 bp,G+C含量约为37 %。它属于外膜跨膜通道蛋白。它嵌合在脂多糖的外部,并与其他蛋白质如Wzc相互作用,把组装的荚膜多糖分子运输到细菌的表面。因此,本试验以副猪嗜血杆菌为研究对象,对Wza基因进行真核载体的构建与表达,并对表达蛋白的结构进行预测分析,旨在为进一步揭示Wza蛋白的功能和机制奠定基础。
1 材料与方法
1.1 材料
1.1.1 质粒和基因 pcDNA3.1(+)为本实验室保存。Wza基因序列由南京金斯瑞公司合成。
1.1.2 主要试剂 质粒小提试剂盒,DNA回收纯化试剂盒购自天根(TIANGEN)生化科技(北京)有限公司;限制性核酸内切酶购自Thermo Scientific,T4 DNA连接酶购自大连TaKaRa公司。
1.2 方法
1.2.1 Wza基因引物的设计与合成 根据NCBI上Wza基因(GenBank登录号为KC795491.1)序列,N端添加6×-His标签,由南京金斯瑞公司合成,引物由长春库美有限公司合成。
1.2.2 Wza基因的PCR扩增与克隆 以合成的PUC57-Wza为模板,利用引物Wza-F:5'-GCATGCATCATCACCATC-3',Wza-R:5'-CCCTCGAGTTACCAATTCCTCACTCTTA A-3'进行PCR扩增。利用常规分子克隆方法对Wza目的基因片段进行纯化回收,并克隆至pcDNA3.1(+)载体连接,PCR鉴定、双酶切鉴定,均为阳性的克隆质粒送往吉林省库美生物科技有限公司测序。
1.2.3 Wza蛋白表达与鉴定 重组质粒pcDNA3.1-Wza脂质体转染293细胞后48 h收集细胞沉淀并破碎,12 000 rpm 2 min离心,收集上清,Western blot鉴定蛋白表达情况。
1.2.4 Wza蛋白理化性质分析与二级结构预测 应用DNAStar软件对Wza蛋白理化性质进行分析,并预测其二级结构。
1.2.5 Wza蛋白三级结构预测 应用SWISS-model(https://swissmodel.expasy.org/)在线预测Wza蛋白的三级结构。
2 结果与分析
2.1 Wza基因PCR扩增与克隆
以合成质粒为模板,经PCR扩增得到大小为1180bp的Wza目的基因片段(图1),与预期大小相同。回收目的条带并克隆至pcDNA3.1(+)载体,PCR鉴定和双酶切鉴定两种方法鉴定重组真核表达质粒(图2),在1 000 bp ~ 2 000 bp处可见单一条带,表明pcDNA3.1(+)-Wza质粒构建成功。
2.2 Wza蛋白表达
Western blot方法鉴定目的蛋白的表达,结果表明Wza蛋白成功表达,与预期大小一致(约43 kDa)(见图2)。
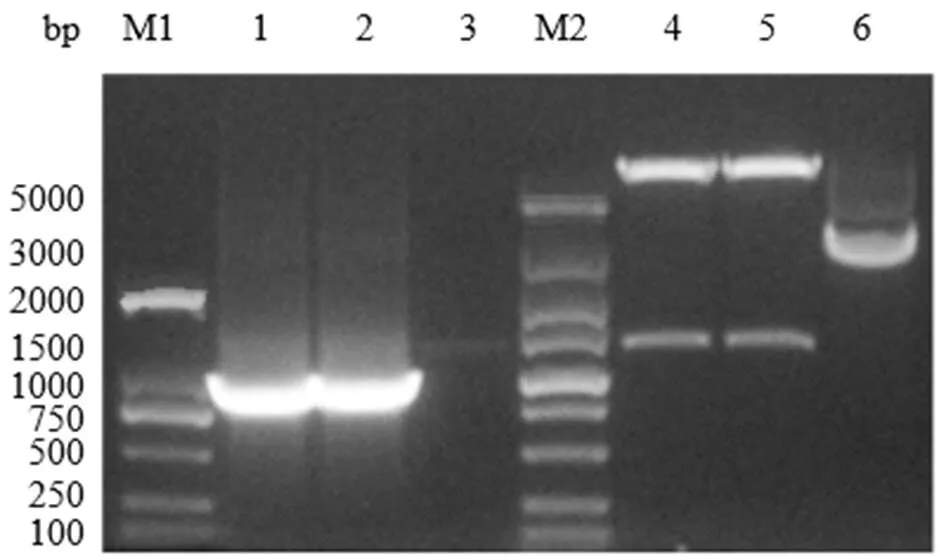
图1 Wza基因的PCR扩增结果和双酶切鉴定
M1.DL-2000;1-2.Wza基因的PCR扩增产物;3.水对照;M2. DL-5000;4-5.Nhel和Xhol双酶切结果;6.pcDNA3.1(+)-Wza

图2 Wza蛋白表达结果
M.蛋白Marker;1-2.Wza蛋白
2.3 Wza蛋白理化性质分析
DNAStar软件分析显示:Wza蛋白分子质量约为43 kDa;其亲水指数>0;抗原指数>0;表面可能性>1;肽链的可塑性好、活动性强,容易与抗体结合。Wza蛋白具有较高的抗原指数,存在多个潜在抗原表位位点,见图3。
2.4 Wza蛋白二级结构预测
Wza蛋白的结构中有22个α-螺旋且分布均匀,29个β-折叠,19个β-转角和17个无规则卷曲,见图4。
2.5 Wza蛋白三级结构预测
SWISS-model软件预测结果见图5,图6,Wza蛋白三级结构预测结果与二级结果预测结果相符。
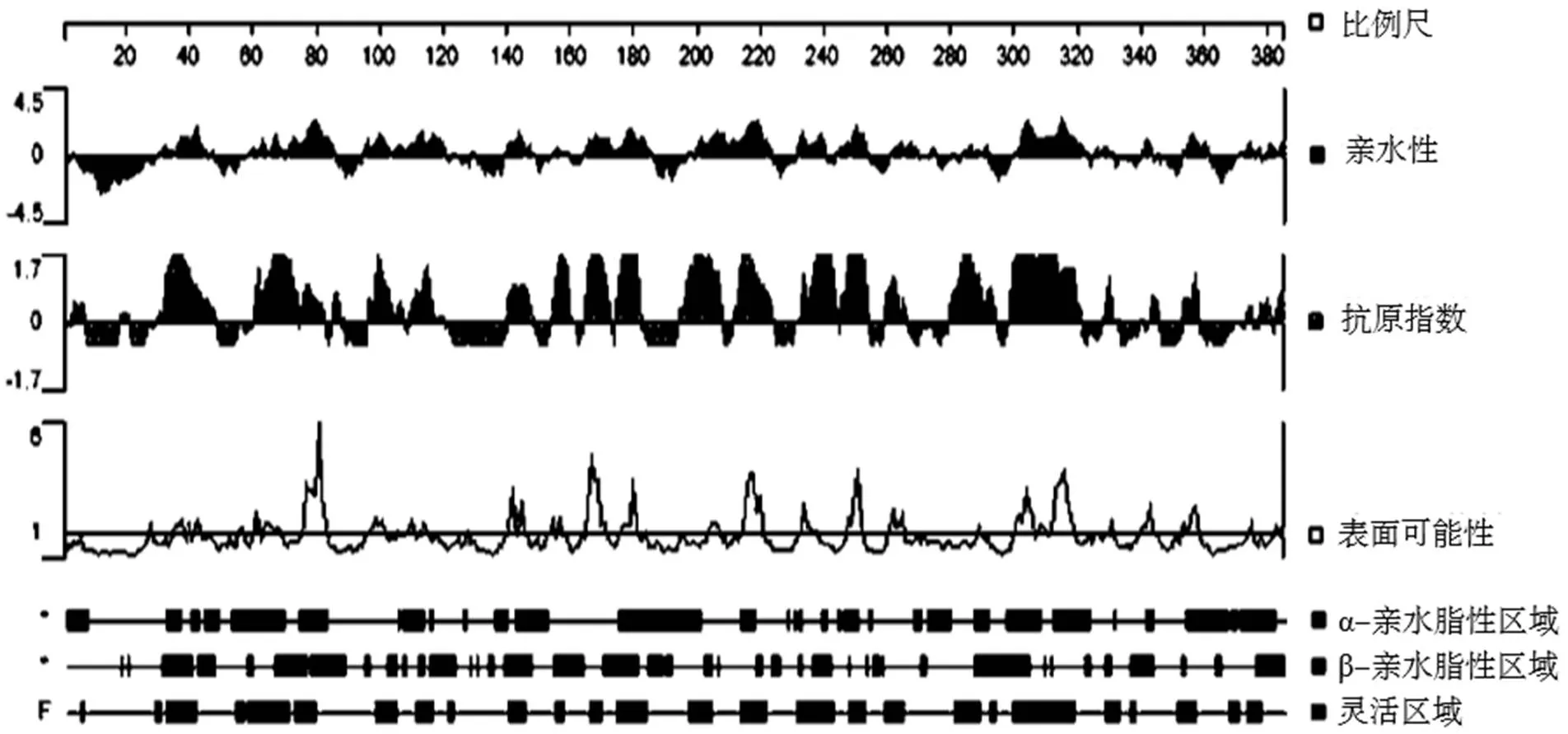
图3 Wza蛋白抗原表位预测结果

图4 Wza蛋白二级结构预测结果
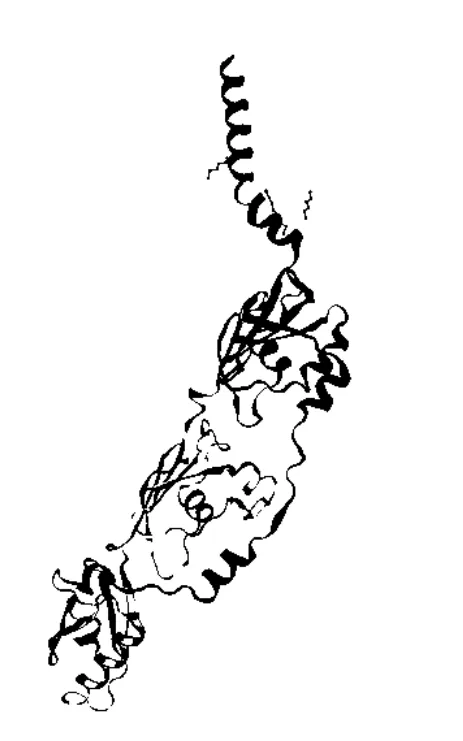
图5 Wza单体三级结构预测结果
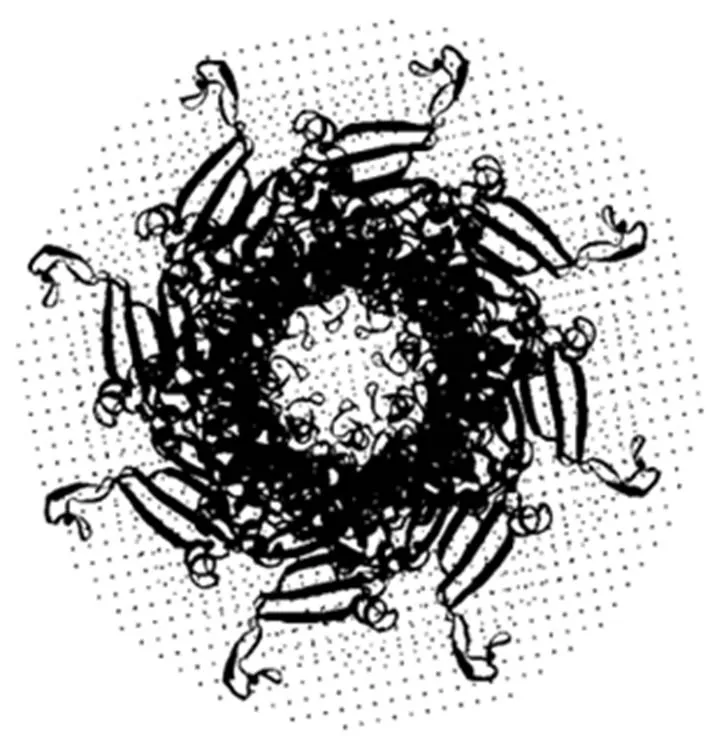
图6 Wza八聚体三级结构预测结果
3 讨论与结论
副猪嗜血杆菌是常见的条件致病细菌,通常定植在上呼吸道。它的主要特征是浆膜发炎反应,包括胸膜炎,心包炎和腹膜炎。它通常会引起脑膜炎和关节炎和肺炎[9],称为格拉瑟氏病(Glasser's disease)。格拉瑟氏病在生产商品猪的国家中更为普遍。目前,该病已成为保育仔猪死亡的主要原因之一,给全球养猪业造成巨大的经济损失。鉴于荚膜多糖在革兰氏阴性菌中是一个很重要的毒力因子,而HPs危害的严重性及其在这方面研究的贫乏,因此很有必要对荚膜多糖相关基因的功能进行研究。副猪嗜血杆菌Wza基因编码的蛋白与Wzb、Wzc等蛋白相互作用来运输荚膜多糖分子,Wza蛋白的外膜蛋白通常是开放的,但在其胞质区域存在可变的环结构,可以调节通道的打开和关闭。这种结构为研究极性大分子荚膜多糖通过细胞膜的分子机理提供了理论基础。
本试验成功构建并表达了Wza基因,并通过DNAStar软件分析得出,Wza蛋白存在多个抗原表位,Wza蛋白的二级结构多为β-折叠,三级结构为一个完整的八聚体外膜蛋白[10],这些研究为副猪嗜血杆菌疫苗或者拮抗剂的进一步探究提供了依据。
[1] Hongzhuanzhou, et al. Identification of putative virulence-associated genes of Haemophilusparasuis through suppression subtractive hybridization[J]. Veterinary Microbiology, 2010, 144(3): 377-383.
[2] SackMeike, Baltes Nina. Identification of novel potential virulence-associated factors in Haemophilusparasuis[J]. Veterinary microbiology, 2009, 136(3-4): 382-386.
[3] Virginia Aragon, BénédicteBouchet, Marcelo Gottschalk. Invasion of endothelial cells by systemic and nasal strains of Haemophilusparasuis[J]. The Veterinary Journal, 2009, 186(2): 264-267.
[4] Olvera Alexandre, et al. Differences in phagocytosis susceptibility in Haemophilusparasuis strains[J]. Veterinary research, 2009, 40(3): 24.
[5] ZhuoFeixu, et al. Genomic Characterization of Haemophilusparasuis SH0165, a Highly Virulent Strain of Serovar 5 Prevalent in China[J]. Plos One, 2011, 6(5): 28.
[6] Whitfield Chris. biosynthesis and assembly of capsular polysaccharides in escherichia coli[J]. Annual Review of Biochemistry, 2006, 75: 39-68.
[7] DrummelSmith J, Whitfield C. Translocation of group 1 capsular polysaccharide to the surface of Escherichia coli requires a multimeric complex in the outer membrane[J]. The Embo journal, 2000, 19(1): 57-66.
[8] ChangJiangdong, KonstantinosBeis, JuttaNesper, et, al. The structure of Wza, the translocon for group 1 capsular polysaccharides in Escherichia coli, identifies a new class of outer membrane protein[J]. Nature, 2006, 444(7116): 226-229.
[9] Melnikow E, Dornan S, Sargent C, et al.Microarray analysis of Haemophilusparasuis gene expression under in vitro growth conditions mimicking the in vivo environment[J]. Vet Microbiol, 2005, 110(3-4): 255-263.
[10] 曹瑞娟. 副猪嗜血杆菌wza基因在其粘附和抗吞噬中的作用研究[D]. 武汉: 华中农业大学, 2014.
S852.61+2
A
1007-1733(2021)08-0009-04
(2021–05–24)
