经旁骶尾入路改良手术治疗成人骶前良性肿瘤*
2021-08-26唐浩贺平徐良黄素曾晓梅
唐浩 贺平 徐良 黄素 曾晓梅
(1.宜宾市第三人民医院,四川 宜宾 644000;2.成都肛肠专科医院,四川 成都 610017)
骶前肿瘤在临床较为少见,病变位于骶前间隙(亦称直肠后间隙),是源于多种胚胎来源的肿瘤。其中以发育性囊肿最常见,约占先天性骶前肿瘤的60%[1]。该病多见于女性,男女比例约1∶2[1]。由于病变起源位于骶前的直肠后间隙,早期无症状,直到出现占位效应时患者才出现症状,部分女性患者以盆腔占位就诊于妇产科,较易出现误诊误治。常用的手术入路有经骶尾部、经腹部、联合入路等,但由于位置深在,无论哪个入路部分患者均存在显露困难,故最常用的俯卧折刀位往往需要切除部分骶尾骨才能彻底显露。宜宾市第三人民医院对手术入路及方法进行了改良,取得了良好的临床效果,现就该院2010年6月~2020年 5月采用经旁骶尾入路改良手术治疗的9例成人骶前良性肿瘤患者资料进行分析,旨在探讨改良手术的可行性、安全性及优点。
1 资料与方法
1.1 一般资料 选取宜宾市第三人民医院2010年6月~2020年 5月收治的经旁骶尾入路改良手术治疗的9例骶前良性肿瘤患者为研究对象,其中男性3例,女性6例;年龄16~92岁,平均35.4 岁;发病时间3天~20年。4例无明显临床症状,1 例院外手术致囊性肿瘤感染伴直肠内瘘,2例排便困难,3例包块伴疼痛。体格检查:会阴部扪及触包块5例,经直肠指检扪及包块6例;6例行术前 CT 检查,2 例同时行 MRI 检查;3例行结肠镜检查(2例正常,1例发现直肠瘘及残余线头);所有患者均行彩超检查,分别发现盆腔包块及骶尾部包块:包块最大者为20 cm×10 cm×9 cm,最小者5.1 cm×4.0 cm×4.0 cm;影像学检查者,4例提示肿瘤与直肠关系密切,1例提示肿瘤伴感染,炎症波及盆底直肠周围间隙;未发现骶骨浸润及破坏;术前9例患者血清肿瘤标志物6项均正常;肿瘤病理类型为:1例良性畸胎瘤, 3例表皮样囊肿伴慢性炎细胞浸润,4例软组织纤维瘤,1例脓肿伴炎性肉芽增生。
1.2 改良手术方式 所有患者均采用左侧卧位,右下肢屈曲,左下肢略伸直,主刀坐于患者骶尾部一侧,一助位于患者腹侧,经旁骶尾入路。根据肿瘤部位,切口上自尾骨尖上5~6 cm经右侧骶骨旁开1.5~2.0 cm作为起点,平行于后正中线走行,过尾骨尖后沿同侧臀大肌内侧缘弧形走向,下端达距肛缘 2~3 cm的3或9点位,于切口中段向对侧做丁字形延长,整个切口呈不规则的类“人”字形(见图1)。切开皮肤、皮下组织后,向外侧牵开臀大肌,于尾骨尖略下方切断肛尾韧带,以备切除后解剖重建,横向分离盆底肌,进入骶骨直肠间隙,显露肿瘤。如肿瘤下端已突出至皮下,可切除多余皮肤组织,所有患者均不需切除骶尾骨(见图2)。分离肿瘤过程中,肿瘤与骶前及直肠周围往往有致密纤维粘连,骶前粘连区术者只需头部右偏由肛门侧往头侧即可直视下分离,分离肿瘤与直肠下段后壁的致密粘连(见图3)。术者可右手带双手套食指进入肛门与术野中的左手做双合诊,确定保留直肠的厚度,确保安全,该方法优势在于手术时间短,创伤小[2]。部分患者在骶前、肿瘤顶部及直肠侧可出现难以安全分离的瘢痕化纤维板,此时可彻底游离肿瘤的周围区域后于致密纤维化区域切开囊壁,象游离疝囊一样将此处的上皮完整切除(见图4)。肿瘤切除后直肠及肛直环显示清晰(见图5),切口旁戳孔植入引流,将肛尾韧带端端缝合(见图6),两侧盆底肌间断缝合关闭(见图7),完成盆底结构的解剖复位。

图1 手术体位及切口

图2 不切除尾骨,侧卧位暴露良好
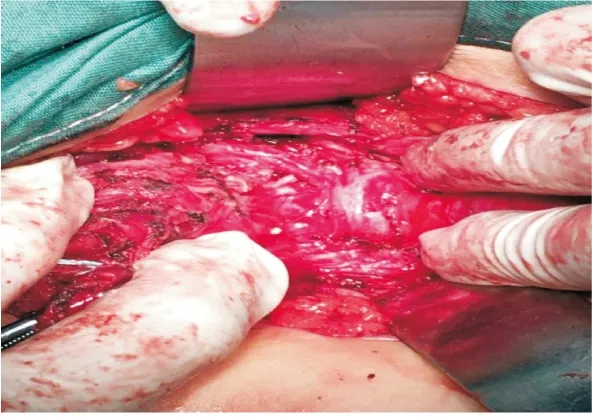
图3 分离肿瘤与直肠下段后壁粘连

图4 致密纤维化处理

图5 肿瘤切除后直肠及肛直环清晰

图6 肛尾韧带端端缝合
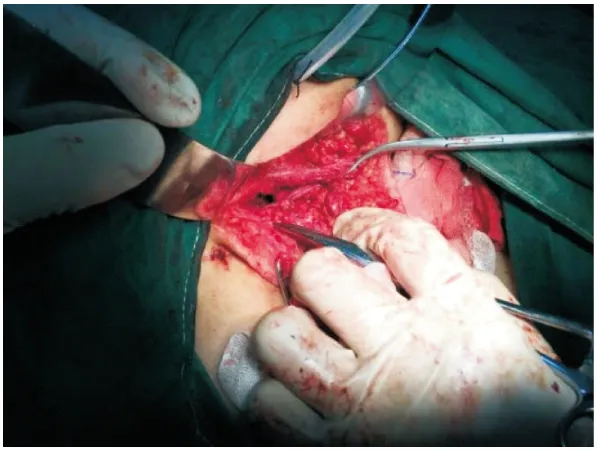
图7 两侧盆底肌间断缝合关闭
2 结果
2.1 手术及恢复情况 9例患者均采用改良侧卧位经旁骶尾入路,均未切除骶尾骨。肿瘤大者顶端达骶二水平。7例肿瘤完整切除,2例大部切除+局部上皮切除。无围术期死亡,无感染、控便功能障碍、排尿困难、肠瘘、骶前大出血等并发症发生。术中出血量10~50 mL,平均40 mL;手术时间2~5 h,平均3 h;住院时间 10~20天,平均15天;术后平均2天拔除尿管,3~8天拔除引流管。
2.2 特殊患者处理方式 1例患者为院外经腹手术失败患者,术中因直肠损伤放弃肿瘤切除,术后形成囊肿内脓肿并囊肿直肠内瘘,接诊后分三期完成手术,一、二期手术见图8~9。三期手术为末段回肠造瘘还纳术。

图8 特殊患者一期手术
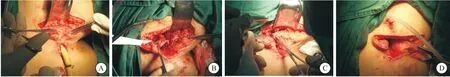
图9 特殊患者二期手术
2.3 术后随访情况 9例患者术后每1~3年复查1次,行彩超或盆腔CT检查,随访1~11 年(平均4.7年),患者未见复发。
3 讨论
成人骶前肿瘤是临床少见疾病,可分为四大类:先天性:发育性囊肿(表皮样囊肿、皮样囊肿、畸胎瘤及尾肠囊肿 );神经源性:如神经纤维瘤、神经鞘瘤等;骨性:如脊索瘤、骨软骨瘤、骨巨细胞瘤;其他:如血管瘤、脂肪瘤、肌纤维瘤等。骶前肿瘤以良性肿瘤为主,以发育性囊肿最为常见。该肿瘤的特点:起病隐匿,50%的患者无明显症状,只是在体检时偶尔发现[3];随着肿瘤向盆腔及骶尾部皮下生长,对周围组织及盆腔组织产生压迫或移位时才出现症状[4-5],多数与尾骨前方及直肠周围形成纤维化致密粘连增加手术分离风险。较小的低位囊性肿瘤伴感染者,可能会被肛肠科医师当做肛周脓肿进行引流甚至挂线治疗,造成患者经久不愈甚至恶化。对此类患者,因术前穿刺活检是否会人为造成肿瘤种植、转移,目前尚无定论,故穿刺活检应慎重[6]。由于女性发病率明显高于男性,部分患者可能以腹部超声发现盆腔包块而收入妇科,造成妇科医师的困扰。本文中1例45岁女性患者因误诊为妇科盆腔囊肿收入妇科,未行CT检查匆忙实施腹腔镜探查,结果术中盆腔内无法查及肿瘤,经术中直肠指检才确定为位于腹膜外骶前肿瘤转至肛肠外科手术治愈。因此,直肠指检是临床上最简便易行的诊断方法[7],可作为初步检查手段。经骶尾部彩超、直肠腔内彩超、盆腔CT平扫+增强、盆腔MRI等,可作为主要的诊断及评估依据;其中以增强CT或MRI对骶前肿瘤的位置、大小、范围、囊实性、与周围组织器官的关系等检测较准确[8-9]。而且MRI对骶管及腰椎管来源的肿瘤辨别更清晰[10]。同时,结肠镜检查也极其重要,特别是术后复发的患者,要警惕上一次手术直肠损伤的可能性。
骶前肿瘤手术入路主要有经腹、经骶尾部、经腹经骶尾部联合入路等。对手术入路的选择标准目前存在一定争议,一般来说,上界未超出S3-4水平的肿瘤宜采用经骶尾部入路手术;下界高于S4水平的病变易于经腹切除;而介于其间的较大肿瘤宜采用联合入路手术[11-12]。孟荣贵等[13]主张,距肛门 6 cm 以上,下缘高于骶骨岬,无广泛转移及周围组织浸润不广泛的肿瘤可经开腹手术切除;骶尾入路适用于距肛门 7.0 cm 以下的较小肿瘤,如果良性肿瘤也可用于距肛门10.0 cm 左右者。本研究选择的患者均为良性肿瘤,实体瘤直径均小于10 cm,上缘位于骶3平面以下;囊性肿瘤上缘不超过骶1水平,最大直径20 cm。所有肿瘤经直肠指检均可触及。2例肿瘤因瘤体巨大,下端已突破盆底肌达尾骨尖下方皮下。所有患者均行结直肠手术标准肠道准备,手术野消毒前用稀释碘伏液清洗直肠,降低术中指检污染风险。术中快速病检明确为良性。
本研究采取的改良术式为患者左侧卧位,右下肢屈曲,左下肢略伸直,经旁骶尾入路。此入路的优势在于主刀坐于患者后侧,稍稍偏头沿肛门后侧术野区即可避开尾骨尖的遮挡,在助手拉钩的牵引下即直视骶尾骨前间隙,而盆侧区、直肠周围间隙、肛直环的上部直观,不用像常规俯卧折刀位手术那样部分患者需切除尾骨甚至部分骶骨,这明显减少了手术创伤,也为肿瘤切除后解剖重建盆底提供了有利条件,且坐位手术相较站立折刀位手术可减轻术者疲劳。同时,改良的类“人”字形经旁骶尾旁切口,在切断肛尾韧带、分开盆底肌、拉开臀大肌及直肠后,可获得很大的手术野,可同时放入三副大号的腹腔拉钩,此术野能完成绝大多数囊性及囊实性骶前良性肿瘤及低位的直径15 cm以下的实性良性肿瘤的切除。
骶前肿瘤一旦确诊应尽早手术,一方面避免其进一步恶化,另一方面避免其合并感染[14-15]。手术完整切除是治疗骶前肿瘤的有效方式[16],而最佳治疗方案是一期完整切除[17]。要达到一期根治性切除同时又不损伤周围重要组织,需重视术中骶尾骨与肿瘤的致密附着区、肿瘤与直肠后壁及两侧的致密粘连及肿瘤近心端的顶部(如果瘤体巨大)。骶前囊肿与尾骨常紧密粘连[1、18],骶前良性肿瘤中发育性囊肿在尾骨前方往往有一片致密附着区,但通常不会波及骶前静脉,这也是有研究者支持尾骨切除以期提高彻底性根治的原因,但本研究改良术式后的左侧卧位,尾骨前方显露良好,手法触诊加直视下手术刀、超声刀、电刀等工具的合理使用,绝大多数患者可以做到安全完整的切除。如不慎发生发生骶前静脉大出血,可采用膈肌电凝法止血[19]。肿瘤与直肠后壁及两侧的处理:部分患者存在广泛包绕直肠后四分之三的致密纤维化粘连,这也是许多经腹或经腹腔镜手术导致直肠损伤的原因,如果是手术失败导致复发感染的患者这种粘连将更加严重。本研究认为腹腔镜手术的安全性会下降,即使腔镜手术同样使用双合诊的方式,由于腹侧的触觉来源于器械,方便性和真实感有差距,而且腹腔镜在此处的分离必定使用能量工具,局部热效应的控制远远达不到开放手术良好,会增加热损伤后术后肠瘘的风险[22]。肿瘤近心端的顶部,如果瘤体较大,使用本研究的改良手术方式,顶部位于骶3以下直径不超过10 cm的实体瘤可以,直径10~15 cm的实体瘤可争取,超过15 cm的实体瘤特别是下端位置低与尾骨关系密切的就需经腹经骶联合手术。对于囊性或囊实性肿瘤,直径20 cm以下,均可采用改良手术的方式完成,体积大的囊性、囊实性肿瘤主动减压需快速病理诊断为良性,术中减压并不增加复发风险,但必须选择好减压点及防止内容物溢出至术野。处理上述难点时,需在致密粘连区禁止钝性分离,全部直视下锐性分离,粘连越紧的部位越不能用钝性分离,否则必然会沿阻力最小的方向分破。仔细分离出的坚韧组织,可使用能量工具凝固,或者钳夹后切断结扎,避免创面大量渗血[20]。
对囊性肿瘤或囊实性肿瘤囊性部分,可采用上皮切除技术,先行减压,在游离大部分后于致密粘连最严重处切开囊壁,象游离疝囊一样将此处囊壁内层的上皮完整切除。这可减少骶前大出血与直肠损伤;降低重度粘连患者的手术难度。同时,由于完整切除了具有增生和分泌功能的上皮细胞,术后不易复发。本文9例患者中有3例局部使用了这种方法,经较长时间随访,无一复发。特别是1例院外经腹手术失败患者,在第二期手术中,由于患者第一次手术后反复感染,囊壁与直肠周围广泛致密粘连,特别是内瘘口周围,采用局部上皮切除,成功切除肿瘤,避免了新的直肠损伤,并准确找到直肠瘘口将其修补,已随访4年未见复发。
改良术式无需切除骶尾骨,当完成肿瘤切除、安置引流后,可解剖复位盆底结构,首先将肛尾韧带的断端对端缝合,缝合后盆底肌的分离裂口将分为两个左右两个区域,可分别间断缝合关闭,完成精准的解剖重建。
4 结论
对于大多数骶前良性肿瘤,改良的成人骶前良性肿瘤经旁骶尾入路手术,通过改变手术体位、入路设计、致密粘连区上皮切除、切除后完整重建盆底等改良方式,可明显减少创伤及恢复盆底稳定性,同时减少术中直肠及骶前损伤的并发症发生率,具有一定的临床应用价值。
