H2S对Graves甲亢小鼠甲状腺功能与甲状腺滤泡上皮细胞损伤的保护作用及机制*
2021-08-26欧慧婷汪新宇余怀新陈泽龙李明政
欧慧婷 汪新宇 余怀新 陈泽龙 李明政
(深圳市第二人民医院内分泌科,广州 深圳 518035)
Graves甲亢(Graves’disease,GD)是一种全身特异性自身免疫疾病,也是甲状腺功能亢进症的最常见原因,占所有患者的50%~80%[1]。甲亢是由于甲状腺受刺激后产生过多的甲状腺激素引起内分泌代谢性疾病,临床主要表现为高代谢症候群、交感神经兴奋症候群及甲状腺肿大,部分患者伴有突眼或胫前粘液性水肿[2]。目前,GD 甲亢的发病机制尚不明确,治疗手段主要包括抗甲状腺药物、放射性碘和甲状腺切除术,但这3种治疗手段均有利有弊。硫化氢(H2S)是继一氧化氮(NO)和一氧化碳(CO)之后发现的第三气体调节分子,H2S 在机体大部分组织均可内源性生成,其中以脑、心血管系统、肝脏、肾脏生成最多[3]。近些年来,研究证实H2S具有很好的抗氧化效应,可以有效地保护细胞免受氧化胁迫介导的损害[4-6]。但关于H2S在甲状腺疾病中特别是Graves 甲亢中的研究报道却相对较少。因此,本实验通过构建Graves甲亢小鼠模型来探讨H2S对Graves甲亢小鼠甲状腺功能的影响,以及对H2O2诱导甲状腺细胞损伤是否具有保护作用。
1 材料与方法
1.1 实验动物 SPF级6~8 周雌性 BALB/c 小鼠45只,均购自深圳大学实验动物中心。将小鼠饲养于温度恒定在(20±3)℃,相对湿度为(40±5)%,每日光照:黑暗时间=12 h:12 h的饲养箱内,饲养环境符合实验动物环境设施要求,期间小鼠自由饮水摄食。
1.2 主要试剂 Ad-TSHR289重组腺病毒和空载体病毒由武汉维诺赛生物技术有限公司设计构建;NaHS、100 IU/mL青霉素与100 μg/mL 链霉素、胎牛血清及DMEM培养基购自美国Sigma公司;甲疏咪唑购自德国默克公司;HE染色、RIPA裂解缓冲液和BCA蛋白检测试剂盒购自上海碧云天生物研究所;免疫组织化学染色试剂购自上海太阳生物科技公司;抗体NIS、TPO、Tg购自北京中杉金桥生物技术有限公司;抗体PCNA、CyclinD1、GAPDH购自美国 Abcam 公司;HRP标记的山羊抗兔购自上海碧云天生物技术公司;CCK-8试剂盒和Annexin V-FITC/ PI细胞凋亡检测试剂盒购自南京凯基生物科技发展有限公司;血清TRAb、T4 和 TSH ELISA测定试剂盒购自上海冠导生物工程有限公司;其它试剂均为国产分析纯。
1.3 方法
1.3.1 GD 动物模型的建立 将45只BALB/c小鼠随机分为正常对照组、空载体病毒组和重组腺病毒组,每组15只。重组腺病毒组小鼠采用Ad-TSHR289重组腺病毒进行胫前肌注射诱导GD小鼠模型,于实验第0、3、6周进行注射,共注射三次。同时,空载体病毒组小鼠注射空载体病毒,正常对照组小鼠注射等体积PBS溶液。饲养至第10 周时采集各组小鼠尾静脉血,检测血清促甲状腺激素受体抗体(TRAb)、甲状腺素(T4)和促甲状腺激素(TSH)浓度。
将造模阶段正常对照组和空载体病毒组小鼠继续保留,将GD造模成功[7]的15只小鼠随机分为3组:模型组(GD)、H2S组及甲疏咪唑组,每组5只。H2S组小鼠予以NaHS 溶液(56 μmol/kg/d)腹腔注射,甲疏咪唑组小鼠予以甲疏咪唑溶液腹腔注射(3.9 mg/kg/d),正常对照组和空载体病毒组小鼠予以等体积 0.9%Nacl 溶液腹腔注射,共干预 4 周。4周后,取各组小鼠血清、甲状腺组织,进行后续实验。本实验研究经医院伦理委员会批准,符合善待动物的伦理学要求。
1.3.2 血清TRAb、T4 和 TSH测定水平 将采集的静脉血在室温下静置待血液自然凝固分层后,析出少量血清,在离心机3000 rpm下离心10 min,取上清液,按照试剂盒说明书测定血清样本中TRAb、T4 和 TSH浓度。
1.3.3 甲状腺组织病理学观察 小鼠取血后处死,迅速解剖小鼠摘取甲状腺组织,采用4%多聚甲醛固定甲状腺组织。固定24 h后,经梯度酒精脱水、二甲苯透明,浸蜡与包埋,使用切片机连续切成厚度为5 μm的切片,进行HE染色,石蜡切片脱蜡水化后,用苏木素染色5 min,自来水冲洗,1%盐酸乙醇溶液中分化5 s,自来水冲洗,0.5%伊红染色2 min,脱水与透明后,中性树胶封片,在光学显微镜观察并拍照。
1.3.4 免疫组织化学染色 将甲状腺组织石蜡切片二甲苯脱蜡、梯度乙醇脱水后,在3% 过氧化氢中处理 30 min,高温(98 ℃)下加热5 min,加入山羊血清室温孵育1 h,加入兔抗PCNA(1∶100)、CyclinD1(1∶250),4 ℃孵育过夜。PBS 液洗后,加二抗室温孵育1 h。滴加 DAB 显色,自来水洗涤,加苏木素复染,二甲苯透明,中性树胶封片,在光学显微镜下观察图像并拍照,通过ImageJ软件对免疫组化染色结果图片进行分析。
1.3.5 Western blot检测NIS、TPO及Tg蛋白表达 将小鼠甲状腺组织剪碎,加入RIPA裂解缓冲液进行裂解,4 ℃下12000 r/min 离心20 min,取上清液,通过BCA法测定蛋白质含量。以50 μg蛋白加样并通过10% SDS-PAGE凝胶分离蛋白质,然后转移至聚偏氟乙烯膜上。5%脱脂奶粉室温封闭2 h,TBST洗膜后,加入稀释后的兔抗NIS(1: 1000)、TPO(1∶1000)、Tg(1∶1000)抗体,以GAPDH(1∶1000)为内参,4 ℃下孵育过夜。次日,TBST洗膜,加入辣根过氧化物酶标记的二抗(1∶5000),室温下孵育1 h,TBST洗膜后,滴加ECL化学发光液显色曝光,凝胶成像系统拍照,使用Image Pro-Plus分析系统对蛋白条带进行分析。
1.3.6 甲状腺滤泡上皮细胞分离与培养 将小鼠甲状腺组织剪碎,D-Hanks 液洗涤后,加入含0.25% 胰蛋白酶、250 U/mL Ⅱ型胶原蛋白酶的消化液在37 ℃ 的水浴箱振荡消化 60 min,以 1000 rpm离心 10 min,弃上清并加入DMEM培养基洗涤沉淀,将离心沉淀反复轻柔吹打均匀,培养于含有100 IU/mL青霉素和100 μg/mL 链霉素、100 mL/L 胎牛血清的DMEM培养基中,在37 ℃、5%二氧化碳培养箱中,次日换液,去除未贴壁的细胞,以后2~3 d 更换培养基 1 次,每 5 d 传代 1 次。通过倒置显微镜下观察细胞形态与生长状况,培养第10 d时对细胞进行特异抗原NIS免疫荧光染色进行鉴定。
1.3.7 细胞分组与处理 将培养的甲状腺滤泡上皮细胞随机分为3组:正常对照组、H2O2组及NaHS+H2O2组,并进行不同处理:正常对照组甲状腺滤泡上皮细胞正常培养,不进行任何处理;H2O2组使用H2O2(400 μmol/L)溶液处理甲状腺滤泡上皮细胞24 h; NaHS+H2O2组先用 NaHS (400 μmol/L)预处理甲状腺滤泡上皮细胞 30 min,再用H2O2(400 μmol/L)溶液处理细胞24 h。
1.3.8 CCK-8检测细胞活力 取对数生长期的甲状腺滤泡上皮细胞,调整细胞浓度为1×105个/mL,取100 μL接种于96 孔板培养,在37 ℃、5%二氧化碳培养箱中培养24 h,按照1.3.7进行分组处理后继续培养至24、48、72 h时,每孔加10 μL CCK-8溶液,再将培养板放在培养箱中培养 2 h,使用酶标仪在450 nm 处检测各组细胞吸光光度值。
1.3.9 流式细胞术检测细胞凋亡 将甲状腺滤泡上皮细胞按照1.3.7进行分组处理后,离心弃去培养基,用预冷的PBS缓冲液洗涤细胞2次,加入500 μL 1×Binding Buffer重悬细胞,在细胞悬浮液加入5 μL Annexin V-FITC和10 μL PI混合均匀,室温避光孵育30 min,立即用流式细胞仪进行检测。

2 结果
2.1 各组小鼠血清中TRAb、T4 和 TSH水平比较 与正常对照组比较,重组腺病毒组小鼠血清中TRAb和T4的水平显著上升,TSH水平显著下降(均P<0.05),而空载体病毒组较正常对照组血清中TRAb、T4 和 TSH水平差异无统计学意义(P>0.05),这提示GD小鼠模型成功构建,见表1。

表1 造模第10 周各组小鼠血清中TRAb、T4 和 TSH水平比较
药物干预4 周后,检测各组小鼠血清中TRAb、T4和TSH水平。与正常对照组比较,模型组、H2S组和甲疏咪唑组小鼠血清中TRAb和T4的水平显著上升,TSH水平显著下降(均P<0.05);与模型组比较,H2S组和甲疏咪唑组小鼠血清中TRAb和T4的水平显著下降,TSH水平显著升高(均P<0.05);H2S组和甲疏咪唑组血清中TRAb、T4 和 TSH水平比较,差异无统计学意义(P>0.05),见表2。

表2 药物干预4 周各组小鼠血清中TRAb、T4 和 TSH水平比较
2.2 各组小鼠甲状腺组织病理学变化观察 正常对照组和空载体病毒组小鼠甲状腺组织中滤泡呈扁平状,细胞排列整齐,滤泡腔光滑,可见红色、均匀的胶质;模型组小鼠甲状腺组织中滤泡大小不等,滤泡腔不光滑,腔内胶质明显减少,并出现破裂的现象;H2S组和甲疏咪唑组小鼠甲状腺组织较模型组甲状腺组织细胞形态变化得到改善,细胞形态逐渐恢复扁平状,滤泡腔内的胶质增加,见图1。

图1 HE染色观察各组小鼠甲状腺组织病理学变化(400×)
2.3 各组小鼠甲状腺组织中PCNA与CyclinD1表达检测 与正常对照组比较,模型组小鼠甲状腺组织中PCNA与CyclinD1阳性表达显著增加(P<0.05),空载体病毒组较正常对照组差异无统计学意义(P>0.05);与模型组比较,H2S组和甲疏咪唑组小鼠PCNA与CyclinD1阳性表达显著减少(P<0.05),且H2S组和甲疏咪唑组PCNA与CyclinD1阳性表达差异无统计学意义(P>0.05),见图2。

图2 免疫组化染色检测各组小鼠甲状腺组织PCNA与CyclinD1表达(400×)
2.4 各组小鼠甲状腺组织中NIS、TPO、Tg蛋白表达比较 与正常对照组比较,模型组小鼠甲状腺组织中NIS、TPO与Tg蛋白表达量显著升高(P<0.05),而空载体病毒组较正常对照组NIS、TPO与Tg蛋白表达量无统计学差异(P>0.05);与模型组比较,H2S组和甲疏咪唑组小鼠甲状腺组织中NIS、TPO与Tg蛋白表达量显著下降(P<0.05),见图3。

图3 Western blot检测甲状腺组织NIS、TPO、Tg蛋白表达
2.5 光学显微镜观察甲状腺滤泡上皮细胞 通过显微镜观察从小鼠甲状腺组织分离培养的甲状腺滤泡上皮细胞,甲状腺滤泡上皮细胞贴壁式生长,呈梭形、多角形,形态较为均一。免疫荧光染色结果显示,胞质中可见较强的NIS荧光染色,见图4。
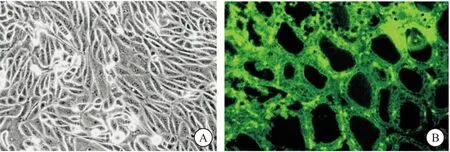
图4 甲状腺滤泡上皮细胞观察与鉴定
2.6 各组甲状腺滤泡上皮细胞活力比较 与正常对照组比较,H2O2组甲状腺滤泡上皮细胞活性在培养24、48、72h显著下降(均P<0.05);在培养48 h和72 h时,NaHS+H2O2组甲状腺滤泡上皮细胞活性较H2O2组细胞活性显著升高(P<0.05),见图5。
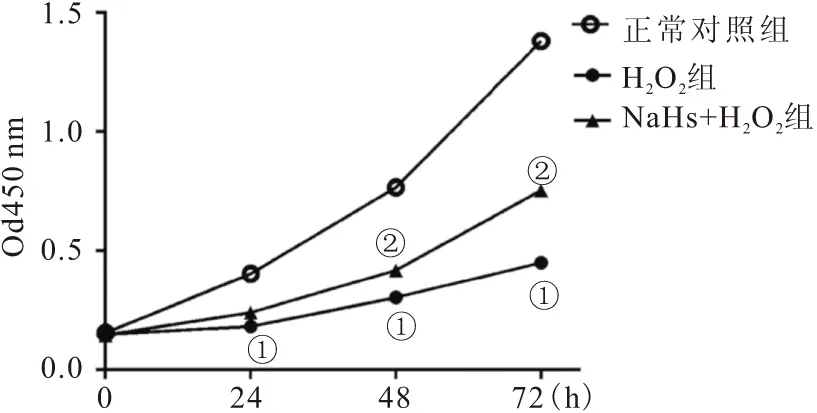
图5 CCK-8检测各组甲状腺滤泡上皮细胞活力
2.7 各组甲状腺滤泡上皮细胞凋亡比较 与正常对照组比较,H2O2组甲状腺滤泡上皮细胞凋亡率显著升高(P<0.05);NaHS+H2O2组甲状腺滤泡上皮细胞凋亡率较H2O2组细胞凋亡率显著降低(P<0.05),见图6。
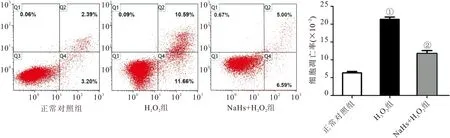
图6 流式细胞术检测各组甲状腺滤泡上皮细胞凋亡
3 讨论
近年来,GD发病率呈不断上升趋势,由于其具有病程长、易复发的特点,因此给患者带来了极大痛苦,并给家庭和社会造成了沉重的经济负担[8-9]。在 GD 发病过程中,免疫系统对甲状腺正常组织成分的免疫耐受状态被打破,免疫细胞被甲状腺组织中的特异性抗原激活,产生抗甲状腺组织的抗体,如针对甲状腺滤泡上皮细胞 TSH 受体的特异性自身抗体,称为TRAb[10-11],TRAb 含量的异常增高是GD 的发病关键,在发病机制中起着重要作用。此外,T4是甲状腺分泌的主要激素之一,其分泌量增多也是判断甲亢发生的重要指标,TSH由垂体前叶嗜碱性细胞合成,是下丘脑-垂体-甲状腺轴负反馈调节中的重要环节,可调节甲状腺激素的合成、分泌并促进甲状腺细胞的生长[12-13]。研究表明,GD过程中,T4、T3过量分泌通过负反馈途径抑制TSH的合成与分泌[14]。本研究中,通过检测发现注射Ad-TSHR289重组腺病毒的小鼠血清中TRAb和T4的水平上升,且TSH水平下降,由此说明GD小鼠模型构建成功。
H2S是一种重要的气体信号分子,与许多生理功能有密切的联系,其可以通过影响一系列细胞信号传导过程以调节细胞的功能,具有抗氧化、抗炎症、降血压、调节神经功能以及促血管舒张等作用[15-17]。Chen等[18]发现在小鼠急性肾损伤后,H2S 能够明显降低细胞内 ROS 水平,抑制炎症因子 TNF-α和 IL-1的产生。Kang等[19]的研究表明,当大鼠肝脏缺血再灌注后肝脏组织受到氧化损伤,加入NaHS有效地降低组织内炎症因子 TNF-α和IL-10 分泌水平,同时抑制凋亡相关蛋白 caspase-3 的表达。本研究结果显示,经过NaHS干预后小鼠血清中TRAb和T4的水平显著下降,TSH水平显著升高,且小鼠甲状腺组织病变得到明显改善,组织中细胞形态逐渐恢复,且滤泡腔内的胶质增加。同时,通过检测发现NIS、TPO、Tg蛋白表达水平下降。甲状腺功能失调是由于碘化物处理障碍导致甲状腺激素的生物合成出现缺陷,继而导致先天性甲状腺功能减退,这也是常见的内分泌疾病[20]。甲状腺激素的生物合成需要碘化物的存在,NIS、TPO和Tg是甲状腺素合成过程中的关键因子,而NIS、TPO及Tg增加是导致GD患者血清甲状腺素升高的重要原因。
CyclinD1是调节G1期细胞增殖的主要因子,PCNA是一种内源性增殖细胞相关抗原,PCNA与CyclinD1作为细胞生长的正性调节因子,PCNA羧基端通过与CyclinD1以及CDK结合成为具有活性的复合物,其之间相互协同对细胞由G1期过渡到S期起到了促进作用[21-22]。CyclinD1在甲状腺乳头癌中表达增高,且在GD患者和小鼠甲状腺组织中均发现PCNA表达的增加。本研究结果显示,在NaHS作用下可抑制GD小鼠甲状腺组织中PCNA与CyclinD1蛋白的阳性表达。
通过分离小鼠甲状腺组织中甲状腺滤泡上皮细胞进行体外实验,检测H2S在H2O2诱导的甲状腺滤泡上皮细胞损伤中的作用,实验结果显示,经过NaHS预处理后再经过H2O2作用的甲状腺滤泡上皮细胞,在培养48 h和72 h时细胞活性明显高于H2O2组细胞活性,同时抑制了细胞的凋亡。因此,H2S对H2O2诱导的甲状腺滤泡上皮细胞损伤起到了保护作用。
4 结论
H2S能够阻止GD小鼠血清中TRAb、T4水平升高及TSH水平下降,抑制甲状腺组织中PCNA与CyclinD1阳性表达,同时下调NIS、TPO及Tg蛋白表达,以改善甲状腺组织病变。此外,H2S对 H2O2诱导甲状腺滤泡上皮细胞氧化损伤具有一定的保护作用。但因GD发病机制复杂,H2S对甲状腺功能与甲状腺滤泡上皮细胞的损伤的作用机制还有待进一步深入探讨。
