冷冻保护剂葡聚糖-聚赖氨酸对冷冻皇冠梨品质的影响
2021-08-26曹雪慧王甄妮朱丹实吕长鑫
曹雪慧,白 鸽,王甄妮,朱丹实,吕长鑫
(渤海大学 食品科学与工程学院,辽宁 锦州 121013)
梨含有丰富的维生素、纤维素及钾、钙元素等营养成分,还具有清热解毒、清心润肺、止咳化痰等多重功效。近年来,冷冻技术在食品加工中得到广泛应用,由于梨水分含量较高,易受微生物侵害及机械损伤,将梨进行冷冻加工可以较长时间维持梨的品质及风味。浸渍冷冻(immersion freezing,IF)是一种新型的冷冻技术,以无毒无害的浸渍液为冷冻剂。液体冷冻剂传热系数高,可以快速降低食品温度,形成小而分布均匀的冰晶,同时可以减少干耗[1-2]。
葡聚糖和聚赖氨酸作为冷冻保护剂用于癌症免疫治疗中保存NK细胞,经过低温保存和复温后恢复的NK细胞立即具有活力[3]。在食品中葡聚糖作为一种生物活性多糖,具有降低胆固醇、调节血糖、提高免疫力等功能[4];聚赖氨酸是一种天然的防腐剂,水溶性好、抑菌、pH值范围广,对人体无毒害作用[5]。食品级葡聚糖、聚赖氨酸均为GB2760—2014允许使用的食品添加剂。目前将葡聚糖和聚赖氨酸作为冷冻保护剂应用于食品冷冻加工中鲜有报道[6]。
皇冠梨(PyrusbretschneideriRehd.)果核小、果肉洁白、质地细腻且松脆多汁,颇受消费者青睐。本实验拟选用皇冠梨作为研究对象,采用不同浸渍液浸渍冷冻处理,研究冷冻保护剂葡聚糖、聚赖氨酸的加入对梨块冻结特性的影响;利用低场核磁共振技术[7]和冷冻时间来监测样品的水分状态,同时比较冻融后各组样品汁液损失、抗坏血酸含量、硬度变化,从而评估冷冻梨的品质。希望本研究可为进一步了解冷冻保护剂在冷冻食品中的作用效果提供理论依据。
1 材料与方法
1.1 材料与试剂
皇冠梨,采摘于辽宁省锦州市三屯梨园。挑选新鲜饱满、无病虫害、无机械损伤、大小均一的皇冠梨运回实验室,于4 ℃冰箱中冷藏24 h以上,实验时随机抽取样品进行实验。
氯化钙(分析纯),天津市光复科技发展有限公司;无水乙醇(分析纯),天津市北辰方正试剂厂;葡聚糖、聚赖氨酸(食品级),河南万邦实业有限公司。
1.2 仪器与设备
NMI20型核磁共振成像仪(包含FID、SE、CPMG、SEG-CPMGC和IR等多个硬脉冲序列),上海纽迈电子科技有限公司;TA.XT Plus型物性测试仪(配有P/5、P/50等多个探头),英国Stable Micro System公司;i500-E8T型低温温度记录仪(配有8路探头),南京先欧仪器制造有限公司;HWS24型数显恒温水浴锅,国华电器有限公司。
1.3 实验设计
将皇冠梨从4 ℃冰箱中取出,清洗干净,去核切成大小均一的8块(30 g)。将样品随机分为IF1、IF2、IF3、IF4四组进行处理,从每个处理组中取出6个样品进行冻结时间、汁液损失、抗坏血酸含量、质构相关指标及水分分布的测定,重复实验3次。
IF1组放于-20 ℃的氯化钙载冷液(氯化钙质量分数为30%)中进行浸渍冷冻;
IF2组放于-20 ℃氯化钙-葡聚糖载冷液(氯化钙质量分数为30%,葡聚糖质量分数为1%)中进行浸渍冷冻;
IF3组放于-20 ℃氯化钙-聚赖氨酸载冷液(氯化钙质量分数为30%,聚赖氨酸质量分数为0.2%)中进行浸渍冷冻;
IF4组放于-20 ℃氯化钙-葡聚糖-聚赖氨酸载冷液(氯化钙质量分数为30%,葡聚糖质量分数为1%,聚赖氨酸质量分数为0.2%)中进行浸渍冷冻。
水的冻结点一般在0 ℃左右,以氯化钙做载冷剂冻结点可以达到-20~-50 ℃,且氯化钙可以在一定程度上保持果蔬脆度。载冷液均提前放入-20 ℃冰箱冷却,当载冷液温度达到-20 ℃即可放入梨块。浸渍冷冻过程中将温度传感器探头插入梨块几何中心,待梨块中心温度达到-18 ℃时,取出置于-20 ℃冰箱冻藏24 h。测试时,取出样品在4 ℃冰箱中解冻后进行各项指标的测定。
1.4 测定方法
1.4.1冻结时间的测定
使用低温温度记录仪对各处理样品温度进行测定。将低温温度记录仪探头插入样品的几何中心位置,另一端通过USB插口与电脑连接,当样品中心温度为-18 ℃时停止测量。
1.4.2汁液损失的测定
冻融前后样品的质量差占冻后样品质量的百分比,即为其汁液损失[8]。
1.4.3抗坏血酸含量的测定
参考曹建康等[9]的2,6-二氯酚靛酚滴定法进行抗坏血酸含量的测定。
1.4.4质构相关指标的测定
采用物性测试仪进行全质构测试。测定条件为:探头型号P/50,测前速率5.00 mm/s,测试速率1.00 mm/s,测后速率5.00 mm/s,压缩量30%,触发力5 g。
1.4.5水分分布的测定
采用低场台式脉冲分析仪对水分分布进行测定。参数设置:回波个数为18 000,回波时间的一半为200.00 μs,累加次数为14,重复时间为9 000 ms,采样频率为100 kHz,90°脉冲时间为14.00 μs,180°脉冲时间为28.00 μs,采样点数为1 024个。
1.5 数据处理
实验数据为多次重复的平均值;使用SPSS 20.0统计软件分析冷冻处理组间差异,P<0.05为差异显著,P<0.01为差异极显著;使用Origin8.5软件绘图。
2 结果与分析
2.1 不同冷冻处理对皇冠梨冻结时间的影响
冷冻食品的冻结速率和冻结时间是影响其品质的主要因素。冻结速率快,形成的冰晶体积较小且均匀,对细胞结构的破坏小,食品的品质较好[10]。物料冻结过程大致分为3个阶段,分别为预冷阶段、相变阶段、深冷阶段[11-12]。相变阶段,即最大冰晶生成阶段的结晶状态直接影响产品品质[13]。
样品冻结过程中各阶段所需时间及冻结总时间变化情况见表1。预冷阶段(0~4 ℃)除IF4浸渍冷冻处理组外,各浸渍冷冻处理组样品所需时间无显著性差异(P>0.05)。相变阶段(-5~0 ℃):IF1、IF2、IF3、IF4样品通过最大冰晶生成带的时间为12.87、10.12、10.20、7.50 min,所需时间符合速冻要求。加入冷冻保护剂浸渍冷冻处理组样品,通过最大冰晶生成带所需时间,与氯化钙浸渍冷冻对照组相比,显著缩短(P<0.05),说明冷冻保护剂的加入能够有效缩短样品冻结所用时间,从而保护样品组织结构。IF4浸渍冷冻处理组此阶段所需时间最短,可能是因为葡聚糖和聚赖氨酸有协同作用。小冰晶的熔点较低(与大冰晶相比),一旦融化液态水会与相邻的大冰晶合并重新结晶[14],水的重结晶形成大冰晶的过程会破裂梨的细胞膜,使细胞脱水,对细胞造成更大的损伤,这与Voronsov等[15]的研究结果一致。葡聚糖和聚赖氨酸可以通过抑制冰晶生长和再结晶过程,减小冰晶对样品组织的破坏[16]。低温冷却阶段(-18~-5 ℃):此阶段IF2浸渍冷冻处理同IF3浸渍冷冻处理无显著性差异(P>0.05)。IF2、IF3、IF4浸渍冷冻处理所需时间与IF1浸渍冷冻处理相比,显著缩短(P<0.05)。IF1浸渍冷冻处理样品冻结总时间最长,约为81.48 min;而IF4浸渍冷冻处理样品冻结总时间最短,为59.51 min。IF4浸渍冷冻处理总时间与IF1、IF2、IF3浸渍冷冻处理样品冻结总时间相比,显著缩短(P<0.05)。

表1 不同冷冻处理样品冻结过程各阶段时间分布Tab.1 Time distribution of freezing process at different stages of samples with different freezing treatments min
2.2 不同冷冻处理对皇冠梨汁液损失的影响
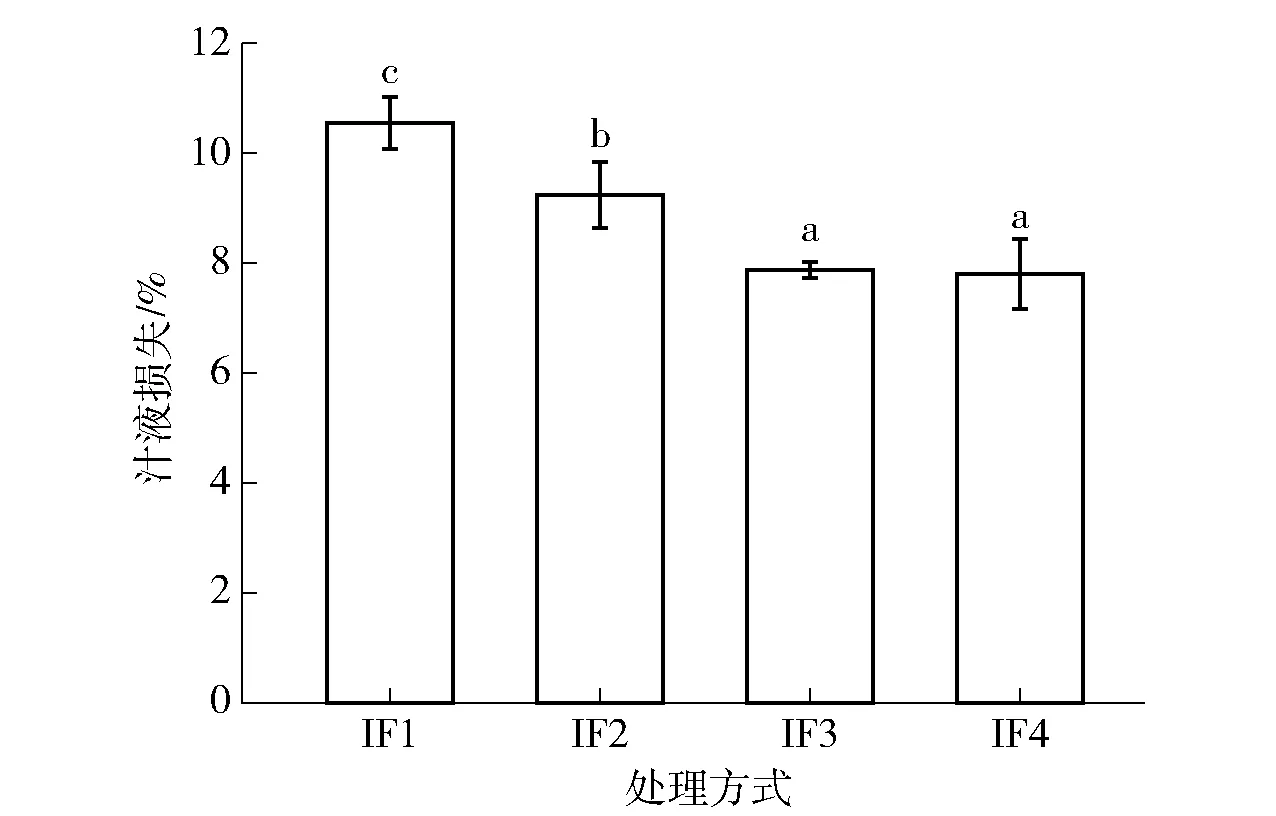
不同小写字母表示不同处理方式间具有显著差异(P<0.05)。图1 不同冷冻处理对皇冠梨汁液损失的影响Fig.1 Effect of different freezing treatments on juice loss of crown pear
水分是维持果蔬营养品质和风味的必要条件,持水能力主要通过汁液损失反映。解冻时,冻结过程中形成的大部分冰晶吸热恢复到原来的状态,部分水从细胞外基质渗透出来,造成汁液损失[17-18]。图1为不同冷冻处理样品冻融后汁液损失情况。由图1可知,IF1浸渍冷冻处理样品,解冻后显示较高的汁液损失,IF4浸渍冷冻处理样品解冻后汁液损失与IF1相比降低了25.93%。IF2和IF3浸渍冷冻处理样品,解冻后汁液损失与IF1组相比分别显著降低了12.25%和25.17%(P<0.05)。图1结果表明,在传统氯化钙浸渍冷冻的基础上,加入冷冻保护剂葡聚糖和聚赖氨酸后,可以进一步降低样品解冻后的汁液损失。葡聚糖和聚赖氨酸的存在有助于缩短冻结时间,相应减缓样品解冻后的汁液损失现象,这与Matsumura等[19]的研究结果一致。聚赖氨酸在冷却过程中对细胞膜有很好的吸附作用,有效保护了细胞膜的完整性[19-20]。
2.3 不同冷冻处理对皇冠梨抗坏血酸含量的影响

不同小写字母表示不同处理方式间具有显著差异(P<0.05)。图2 不同冷冻处理对皇冠梨抗坏血酸含量的影响Fig.2 Effect of different freezing treatments on ascorbic acid content in crown pears
抗坏血酸含量是评价果蔬产品营养品质的重要指标之一[21],通过测定冻融后样品抗坏血酸含量,可以判断不同浸渍冷冻处理对样品营养品质的影响,实验结果见图2。由图2可知,IF4浸渍冷冻处理样品解冻后抗坏血酸含量最高,为11.84 mg/100 g,比IF1、IF2、IF3处理组样品解冻后抗坏血酸含量分别显著提高了50.06%、38.80%、16.88%(P<0.05)。结合表1结果,冻结过程IF4浸渍冷冻样品,相变时间较其他浸渍冷冻处理组显著缩短,说明IF4浸渍冷冻样品减少了冰晶对组织结构的破坏,有效降低样品营养成分的损失。IF1、IF2浸渍冷冻样品解冻后抗坏血酸含量无显著性差异(P>0.05),这可能是因为IF1、IF2浸渍冷冻处理组样品解冻后汁液损失较为严重,抗坏血酸为水溶性物质,会随着样品汁液损失而减少。综合来看,加入葡聚糖和聚赖氨酸浸渍冷冻处理能通过缩短冻结时间,减小冰晶对细胞内部造成的机械损伤,减缓样品营养物质的流失,对抗坏血酸起到较好的保护作用。
2.4 不同冷冻处理对皇冠梨质构特性的影响
质构特性是衡量冷冻过程食品品质改变的重要指标。解冻过程由于冰晶的存在,许多组织不能完全复水,造成组织分离、质地变软,从而引起冻融后样品弹性、黏聚性、回复性发生改变。不同冷冻处理对皇冠梨质构特性的影响,实验结果见表2。由表2可知:添加冷冻保护剂的浸渍冷冻处理组样品,解冻后硬度值均显著高于对照组样品(P<0.05);IF4浸渍冷冻处理组梨块解冻后硬度值最大,与氯化钙浸渍冷冻对照组相比显著提高了112.38%(P<0.05)。这说明,冷冻过程中由于冰晶的存在会对梨块的质地产生不可逆转的损失[22],冷冻保护剂葡聚糖和聚赖氨酸,缩短了样品相变时间,降低了冰晶对样品组织的影响,这与Awad等[23]的研究结果一致。冻结速率快慢决定冰晶大小,冰晶大小对食品质地及营养有较大影响。胶着度和咀嚼度的大小体现为将食品破裂成可吞咽状态所需能量,添加冷冻保护剂后,浸渍冷冻的样品解冻后胶着度和咀嚼度显著提高(P<0.05),且解冻后样品胶着度和咀嚼度随硬度变化而变化。

表2 不同冷冻处理对皇冠梨质构特性的影响Tab.2 Effects of different freezing treatments on textural properties of crown pears
2.5 不同冷冻处理对皇冠梨水分分布的影响
为了研究冻融过程中梨块组织水分子的迁移和分布,采用低场核磁共振技术(LF-NMR)以确定横向弛豫时间(T2)。T2可间接反映水的自由度,弛豫峰(S2)可以清晰地反映不同亚细胞组分中水分含量,间接反映梨块细胞结构的完整性。表3是不同浸渍冷冻处理梨块冻融后,横向弛豫时间T2及其对应的峰面积(S2i)比例分布。梨块冷冻前后T2反演图谱一般出现3~4个峰,分别为T21、T22、T23。T21一般被认为是细胞壁中的水,流动性较差;T22为细胞中不易流动的水,指位于细胞质或者细胞外间隙的水分;T23被认为是存在于液泡中的水,与食品的结合能力较弱,流动性较好且最容易失去[24]。添加冷冻保护剂浸渍冷冻的梨块解冻后,T23横向弛豫时间较对照组梨块总体上发生后移,T2值越大,表明水分和组织结合越疏松,水分流动性越大。各浸渍冷冻处理组样品解冻后T21、T22横向弛豫时间没有显著性差异(P>0.05)。冷冻使样品组织细胞膜结构发生不同程度的破坏,不同部位水分交换发生迁移。IF2、IF3 、IF4浸渍冷冻处理样品解冻后,S23峰面积比例均显著大于IF1浸渍冷冻处理样品解冻后S23峰面积比例(P<0.05),IF2、IF3浸渍冷冻处理样品解冻后,S23峰面积比例没有显著性差异(P>0.05)。无论哪种冷冻方式处理,都会对样品细胞膜以及细胞壁造成一定程度的损害,液泡中的水分迁移至细胞间,导致细胞间水分发生一定程度的增加,造成汁液损失。葡聚糖和聚赖氨酸通过缩短相变时间,减小了冰晶对细胞的伤害,保护了细胞膜和细胞壁的结构,降低了自由水的迁移。
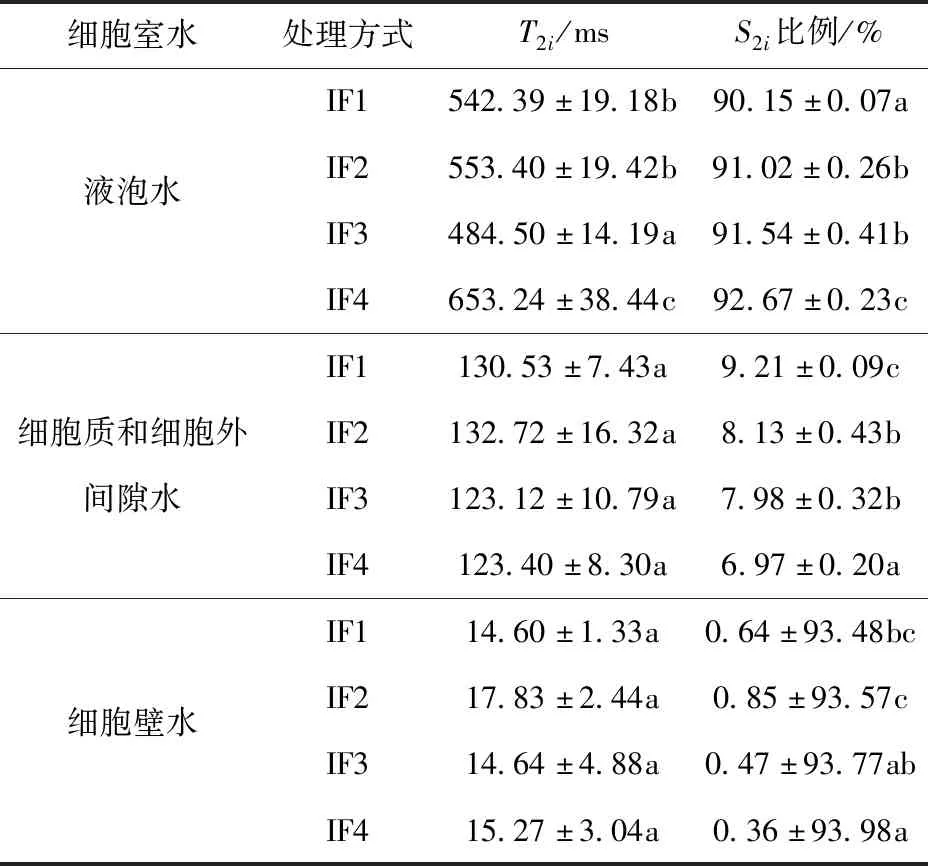
表3 冻融后皇冠梨样品中T2和峰面积比例的分布Tab.3 Distribution of T2 and peak area ratios of freeze-thaw crown pear samples
3 结 论
加入冷冻保护剂浸渍冷冻的梨块,通过最大冰晶生成带所用时间较传统氯化钙浸渍冷冻显著缩短。加入冷冻保护剂后,不仅可以降低冻融后梨块汁液损失,还可以显著提高冷冻梨块解冻后硬度,保持皇冠梨较好的感官品质。与传统氯化钙浸渍冷冻处理相比,加入冷冻保护剂后,浸渍冷冻处理样品解冻后S23峰面积比例显著升高,说明冷冻保护剂的加入缩短梨块相变时间,小而均匀的冰晶对细胞组织造成较小的破坏;且聚赖氨酸对细胞膜有很高的吸附作用,保护了细胞膜免受外界影响,使梨块解冻后拥有较好的品质。皇冠梨加入冷冻保护剂葡聚糖和聚赖氨酸后冷冻效果较传统氯化钙浸渍冷冻更好,希望本研究可为葡聚糖和聚赖氨酸作为冷冻保护剂应用于冷冻食品提供一定的研究基础。
