脱壳处理对火麻蛋白提取、功能特性和消化性的影响
2021-08-26伍圣文贾成刚
伍圣文,贾成刚,崔 春,*
(1.华南理工大学 食品科学与工程学院,广东 广州 510640;2.桂林三金药业股份有限公司,广西 桂林 541004)
火麻(CannabissativaL.),又称为汉麻,在我国有悠久的种植历史,以“长寿之乡”广西巴马所产的火麻最为出名。火麻浑身是宝,火麻籽除了有大量的膳食纤维还含有约30%的油脂和超过25%的蛋白质,已有的动物实验和体外实验证实了火麻籽对心血管、皮肤和神经系统等方面有潜在保护作用[1]。研究发现,火麻蛋白也具有一系列优点,包括无抗营养因子,具有生物活性的化合物含量丰富等。与大豆蛋白类似,火麻蛋白可能会在食品工业中有一定的应用价值,如肉类替代品的原料、可食用薄膜和纳米活性化合物封装材料等[2]。
火麻籽粕作为火麻籽榨油后的副产物,因其丰富的火麻蛋白含量而逐渐被作为新型植物蛋白资源。2002年火麻仁被列为药食同源的资源后,有关火麻籽粕中火麻蛋白提取工艺、功能特性及生理活性等方面的研究日益深入。Tang等[3]对比研究了火麻分离蛋白和大豆分离蛋白的氨基酸组成、理化性质和功能性质,认为火麻分离蛋白可以作为一种有价值的婴幼儿营养来源。徐鹏伟等[4]对比了碱溶/酸沉法和盐溶/盐析法提取的火麻仁蛋白,发现盐提蛋白虽然蛋白质回收率低,但其蛋白质含量高,且外观呈亮白色,更适合添加到高蛋白食品中。Shen等[5]研究指出了火麻蛋白是良好的蛋白质来源,其水解肽具有多种保健作用,如抗氧化、降压、降血糖等。然而,有关火麻籽壳对火麻蛋白提取和功能性质影响的研究鲜有报道。
本研究立足于生产实际问题,研究了脱壳处理对火麻蛋白提取、功能性质和消化吸收等方面的影响,以期为火麻蛋白的工业化生产提供一定理论和实践基础。
1 材料与方法
1.1 材料与试剂
火麻仁粕和未脱壳火麻籽粕,桂林三金药业股份有限公司;无水乙醇、氢氧化钠、硫酸、盐酸、碳酸钠、没食子酸,均为国产分析纯,广州芊荟化玻仪器有限公司;SDS-PAGE预制胶,上海碧云天生物技术有限公司;胃蛋白酶,上海源叶生物科技有限公司;胰酶,重庆市全新祥盛生物制药有限公司。
1.2 仪器与设备
HYP-308型消化炉、KDN-103F型凯氏定氮仪,上海纤检仪器有限公司;GL-21M 型高速冷冻离心机,浙江赛德仪器设备有限公司;FJ200-SH 型数显高速分散均质机,广州芊荟化玻仪器有限公司;CR-400型色差仪,日本Konica Minolta有限公司;L-8900 型全自动氨基酸分析仪,日立(中国)有限公司;PowerPac Basic型电泳仪,美国Bio-Rad公司。
1.3 实验方法
1.3.1火麻蛋白提取
根据课题组前期优化的条件提取火麻蛋白,具体如下:未脱壳火麻籽粕(过60目筛,蛋白质质量分数40.60%)在料液比(g/mL)1∶10、温度50 ℃、pH值12.0的条件下,碱提3 h后8 000 r/min离心15 min,所得上清液用1 mol/L的盐酸调pH值为5.0,酸沉2 h后离心除去上清液。所得沉淀加入适量去离子水重新分散,再用0.5 mol/L的盐酸调为中性,将所得火麻蛋白凝乳冻干后得未脱壳火麻蛋白。火麻仁粕(火麻籽粕脱壳处理后得到,过80目筛,蛋白质质量分数64.50%)在料液比(g/mL)1∶10、温度40 ℃、pH值12.0条件下,碱提3 h,后续操作与未脱壳火麻籽粕操作相同,得到火麻仁蛋白。
1.3.2蛋白质回收率及蛋白质质量分数计算
采用GB 5009.5—2016《食品中蛋白质的测定》中凯氏定氮法测定样品中蛋白质含量,蛋白质回收率计算见式(1)。

(1)
式(1)中,m1为冻干后火麻蛋白粉的质量,g;w1为冻干后火麻蛋白的质量分数,%;m2为所取原料的质量,g;w2为原料的蛋白质质量分数,%。
1.3.3氨基酸组成分析
参考GB 5009.124—2016《食品中氨基酸的测定》测定样品的氨基酸组成。
1.3.4色泽分析
样品的色度值由便携式色差仪获得,每次实验前,用标准白色参考瓦进行校准。实验结果用L*值(明亮度)、a*值(红绿度)、b*值(黄蓝度)和ΔE(总色差)表示。
1.3.5分子质量的测定
使用SDS-PAGE预制胶(体积分数为4%~20%)测定,Marker和样品的上样体积为10 μL,电泳条件为80 V保持约30 min,120 V保持约120 min,采用考马斯亮蓝染色45 min,脱色液(乙醇-冰醋酸水溶液)脱色1~3 h直至背景无色。
1.3.6总酚提取及测定
参考李晓辉等[6]的实验方法提取火麻籽粕及火麻蛋白中的总多酚并稍做修改。精确称取质量(m)为0.3 g的样品按照料液比(g/mL)1∶10,加入体积分数为60%的乙醇溶液,超声功率700 W提取30 min,反复提取3次,记录提取液的体积(V)。总多酚的测定参考贺芷菲等[7]的方法,取提取液1 mL加入5 mL福林酚试剂,反应5 min后,加入4 mL质量浓度为0.075 g/mL碳酸钠溶液,室温避光静置60 min后在765 nm下测定OD值,所测的OD值与没食子酸标准曲线对照,计算提取液中的总酚质量浓度(ρ)。总酚提取率计算见式(2)。

(2)
1.3.7功能特性分析
1.3.7.1 溶解度测定
不同原料提取的火麻蛋白的溶解度测定参考Fang等[8]的方法并稍做修改。取一定质量(m)火麻蛋白(蛋白质质量分数为w1)分散于不同pH值的缓冲溶液中,在室温下搅拌30 min后离心分离,记录上清液体积(V),并用福林酚法测定上清液中的蛋白质质量分数(w2),蛋白质质量分数用凯氏定氮法测得。蛋白质的溶解度按式(3)计算。
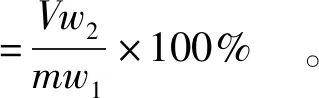
(3)
1.3.7.2 持水性与持油性测定

(4)
1.3.7.3 起泡性与起泡稳定性测定
两种火麻蛋白起泡性和起泡稳定性的测定参考张京涛等[10]的方法并稍做修改。准确称取0.1 g火麻蛋白于带刻度的平底试管中,加入10 mL的磷酸盐缓冲溶液(pH值6.8)后用高速分散均质机以10 000 r/min的条件搅打4 min。记录溶液初始体积(V)、搅打结束后溶液体积(V1)和静置30 min后的溶液体积(V2),样品起泡性和起泡稳定性的计算见式(5)、式(6)。

(5)

(6)
1.3.7.4 乳化性与乳化稳定性测定
采用离心法测定两种不同火麻蛋白的乳化性及乳化稳定性[11]。称取适量20 mg/mL蛋白质溶液加入等体积的大豆油,用高速分散均质机以10 000 r/min均质2 min后,在2 000 r/min条件下离心10 min,测定乳化层的高度(H1)和离心管内液体总高度(H0)。然后将离心管置于80 ℃水浴锅中水浴30 min后,用自来水快速冷却至室温再以2 000 r/min的条件离心10 min后测定乳化层高度(H2)。乳化性(EAI)和乳化稳定性(ESI)由式(7)、式(8)计算。
(7)
(8)
1.3.8体外模拟消化实验
参考Marambe等[12]和Lin等[13]的方法测定两种火麻蛋白的体外模拟消化率。
模拟胃消化:称取适量蛋白质样品(m)用水溶解后,用1 mol/L的盐酸将待测蛋白质样品溶液(40 mg/mL)pH值调为2.0后,在37 ℃恒温培养箱中预热10 min,添加适量模拟胃液(胃蛋白酶质量浓度4 mg/mL),使得胃蛋白酶和蛋白质质量浓度比为1∶250。将反应体系置于37 ℃恒温培养箱中孵育2 h,反应结束后用1 mol/L的氢氧化钠溶液调节pH值为6.8,终止反应。最后将反应体系离心后收集上清液(V1),计算蛋白质量分数(w1)并保存于-20 ℃。
模拟肠道消化:将经模拟胃消化的样品,加入适量的模拟肠液(胰酶质量浓度10 mg/mL),使得胰酶和待测蛋白质质量浓度比为1∶25。将反应体系置于37 ℃恒温培养箱中孵育4 h后,通过水浴煮沸10 min结束反应。反应体系离心后收集上清液(V2),计算蛋白质质量分数(w2)并保存于-20 ℃。
模拟消化率的计算见式(9)、式(10)。

(9)

(10)
1.4 数据处理
所有实验重复3次后取平均值。运用Excel 2016、OriginPro 2021和Minitab 17进行实验数据处理、统计分析及制图。
2 结果与分析
2.1 脱壳处理对蛋白质、总酚和色泽的影响
两种原料的蛋白质含量及脱壳处理对两种火麻蛋白回收率、蛋白质含量和总酚含量的影响见表1。
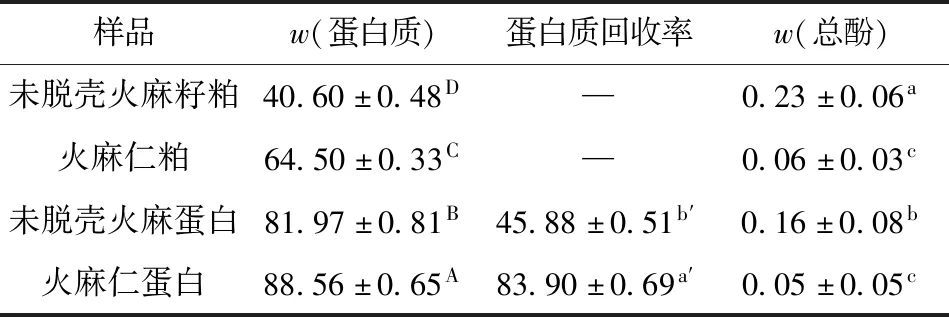
表1 脱壳处理对蛋白质和总酚含量的影响Tab.1 Effects of hulling treatment on protein and total phenol content %
由表1可知,经过脱壳处理后两种原料的蛋白质含量差异显著(P<0.05)。经过相似的碱溶酸沉工艺后,未脱壳火麻蛋白的蛋白质回收率只有45.88%,而火麻仁蛋白的蛋白质回收率高达83.90%。吴俊峰[14]用连续湿磨加喷射蒸煮法得到的火麻蛋白提取率为45.37%,宋淑敏等[15]以碱溶酸沉法提取超临界二氧化碳萃取脱脂的火麻籽粕的蛋白质,其提取率为96.10%,提取率不同的主要原因可能是采用的原料及预处理工艺的不同。
火麻籽壳占火麻籽质量的40%左右,未脱壳的火麻籽粕富含酚类化合物和纤维素[6,16]。在碱液提取过程中,未脱壳火麻籽粕中的酚类化合物、蛋白质和纤维的相互作用可能会对蛋白质的溶解产生不利影响[17],从而进一步降低未脱壳火麻籽粕的蛋白质回收率。这一点可以从表1中火麻仁粕总酚含量显著(P<0.05)少于未脱壳火麻籽粕来侧面验证。
色泽是影响火麻蛋白在市场上接受度的一个重要因素,因此,本研究分析了脱壳处理对火麻蛋白色度值的影响,结果见图1。

不同字母表示组间差异显著(P<0.05)。图1 脱壳处理对火麻籽粕和火麻蛋白色泽的影响Fig.1 Effect of hulling treatment on color of hemp seed meal and hemp protein
由图1可知,火麻仁蛋白的亮度(L*值)、黄蓝度(b*值)都显著(P<0.05)高于未脱壳火麻蛋白,而红绿度(a*值)和总色差(ΔE)显著(P<0.05)低于未脱壳火麻蛋白。这说明火麻仁蛋白色泽要比未脱壳火麻蛋白偏白、偏绿和偏黄,总色差偏小则说明火麻仁蛋白色泽更接近标准白色参考瓦,这也与两种火麻蛋白肉眼观察的色泽结果相符。在较强碱性提取条件下不仅有利于火麻蛋白的提取,同时也有利于从火麻仁粕中共提取酚类物质和籽壳中的水溶性色素,从而使得火麻蛋白的颜色呈现深棕色[18]。同时,也有研究发现,碱性条件下,酚类化合物容易经酶和非酶氧化形成醌类化合物,然后醌类化合物可以与蛋白质结合,并导致蛋白质颜色变深[9]。因此,结合表1的总酚含量的差异,推测认为未脱壳火麻蛋白比火麻仁蛋白具有更深色泽的主要原因是未脱壳火麻籽粕比火麻仁粕含有更多的酚类化合物和水溶性色素。
2.2 脱壳处理对火麻蛋白氨基酸组成的影响
表2为两种火麻蛋白的氨基酸组成分析。
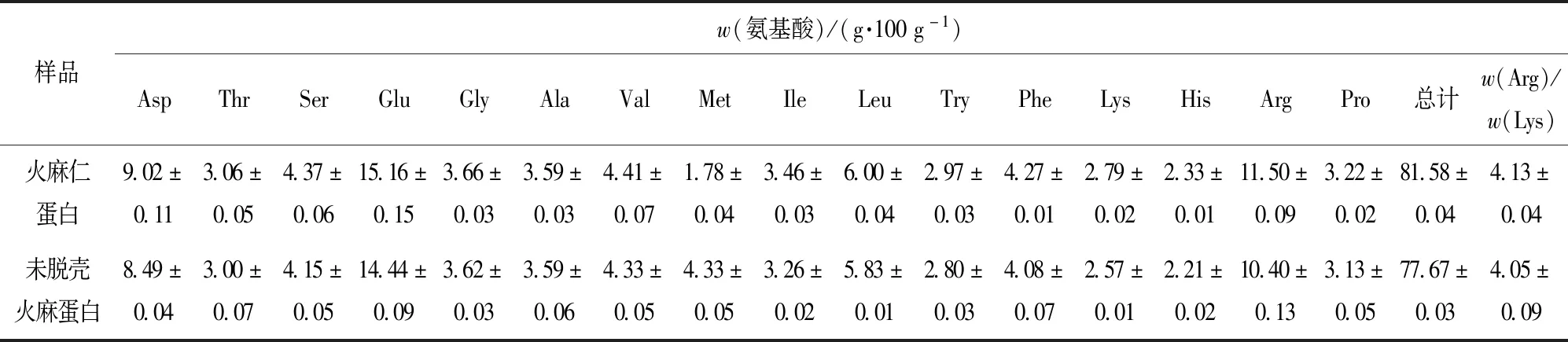
表2 两种火麻蛋白的氨基酸组成Tab.2 Amino acid composition of two kinds of hemp protein
由表2可知,两种火麻蛋白的氨基酸组成丰富,其中谷氨酸、精氨酸和天冬氨酸含量相对最高,这与以往的报道是一致的。谷氨酸和天冬氨酸是经典的呈味氨基酸,而精氨酸是一氧化氮的前体,对维护心血管健康有重要作用。此外,火麻蛋白中的w(Arg)/w(Lys)值在4.0左右,远大于大豆蛋白等一般植物蛋白中的w(Arg)/w(Lys)值,这使火麻蛋白作为促进心血管健康食品的营养配料和生物活性成分特别有价值[19]。两种火麻蛋白的氨基酸组成结构相似,这说明脱壳处理对火麻蛋白氨基酸基本不产生影响。同时整体上,火麻仁蛋白的各种氨基酸含量都要略高于未脱壳火麻蛋白,这与实验测得的火麻仁蛋白的蛋白质含量高于未脱壳火麻蛋白的结果是一致的。
2.3 脱壳处理对火麻蛋白分子质量的影响
两种火麻籽粕原料及其提取的火麻蛋白的SDS-PAGE见图2。
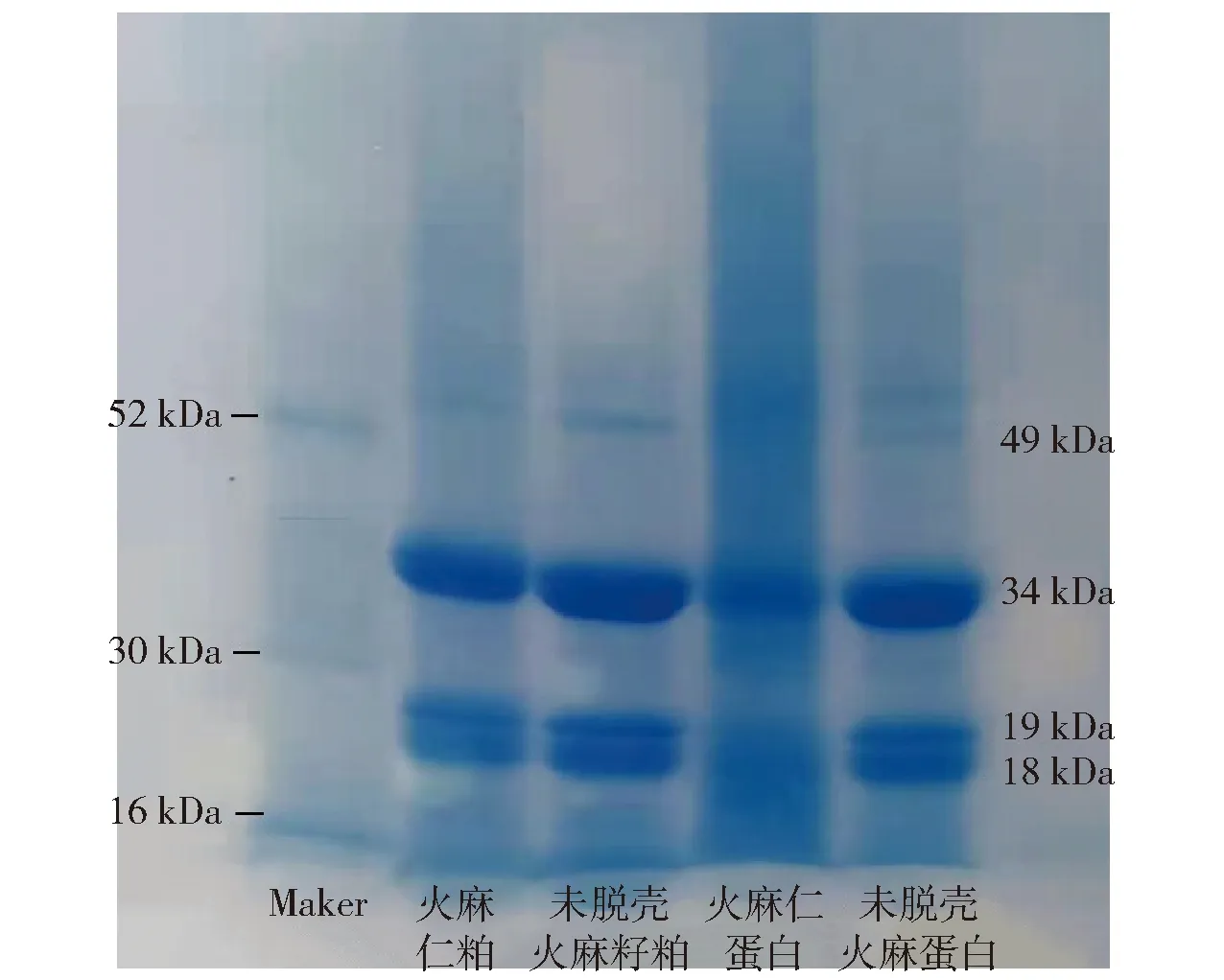
图2 火麻籽粕和火麻蛋白的SDS-PAGEFig.2 SDS-PAGE of hemp seed meal and hemp protein
火麻蛋白主要由麻仁球蛋白(约75%)和白蛋白(约25%)组成[20]。其中,麻仁球蛋白类似于大豆球蛋白,是由6个相同的单体组成。每个单体由一个酸性基团(AS)和碱性基团(BS)组成,由一个二硫键连接[3]。由图2可知,总体上看,火麻籽粕原料和碱提的火麻蛋白在电泳图谱上有很大的相似性,表明碱提过程对火麻蛋白的亚基组成没有显著的影响。两种火麻籽粕原料和火麻蛋白都在34 kDa和20 kDa附近产生了比较明显的亚基条带,在49 kDa附近还有一条比较淡的亚基条带,这也表明脱壳处理对碱提后的火麻蛋白亚基的组成没有影响。研究认为,34 kDa和20 kDa附近产生的条带来自麻仁球蛋白在还原条件下产生的亚基,而49 kDa附近的亚基是类似于β-伴蛋白球蛋白亚基[21]。电泳图上基本看不到白蛋白的条带可能是因为pH值5.0的酸沉条件下白蛋白溶解度仍较高,沉淀中所含白蛋白较少[21]。
2.4 脱壳处理对火麻蛋白功能特性的影响
2.4.1脱壳处理对火麻蛋白溶解度的影响
蛋白质溶解度是发挥其他功能特性的基础,脱壳与未脱壳火麻蛋白的溶解度见图3。
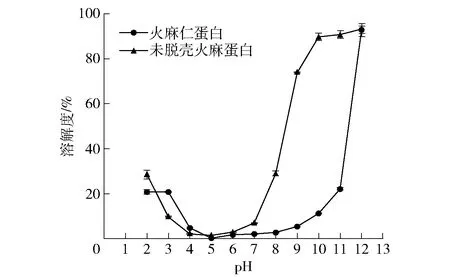
图3 两种火麻蛋白的溶解度曲线Fig.3 Solubility curves of two kinds of hemp protein
由图3可知,火麻蛋白的溶解度在偏酸和偏碱性条件下都会增加,尤其是在碱性条件下,随着pH值的升高,火麻蛋白溶解度的增加是非常显著的。这是因为偏离等点越远,蛋白质所带的净电荷越多,蛋白质不容易发生聚集,从而使得溶解度增加[4]。
同时,火麻仁蛋白与未脱壳火麻蛋白在pH值2.0~12.0内的溶解度变化趋势是相似的,且都在pH值5.0附近有最小的溶解度,这表明脱壳处理对火麻蛋白的等电点是没有影响。当pH值在7.0~11.0时,未脱壳火麻蛋白的溶解度从6.96%迅速增加到90.70%,而火麻仁蛋白的溶解度只从2.18%增加到了20.03%。这在以往的文献中比较少见,其原因有待进一步的研究。
2.4.2脱壳处理对火麻蛋白持水性与持油性的影响
蛋白质的持水性和持油性不仅影响着蛋白质产品的感官品质,也影响着食品加工、储藏过程中的物理特性,脱壳处理对火麻蛋白持水性与持油性的影响见图4。

不同字母表示组间差异显著(P<0.05)。图4 两种火麻蛋白的持水性与持油性Fig.4 Water and oil holding capacity of two kinds of hemp protein
由图4可知,同样是碱溶酸沉制备的火麻蛋白,火麻仁蛋白的持水性与持油性都显著(P<0.05)高于未脱壳火麻蛋白。这表明火麻仁蛋白除了在色泽上更有吸引力,也更适合应用在食品配料中。
2.4.3脱壳处理对火麻蛋白起泡性及乳化性的影响

不同字母表示组间差异显著(P<0.05)。图5 两种火麻蛋白的起泡性和乳化性对比Fig.5 Comparison of foaming and emulsifying capacity of two kinds of hemp protein
脱壳处理对火麻蛋白起泡性与乳化性的影响见图5。由图5(a)可知,火麻仁蛋白的起泡性和起泡稳定性虽然高于未脱壳火麻蛋白,但是两者并没有显著性差异。这说明脱壳处理对火麻蛋白的起泡性与起泡稳定性并没有太大影响。与其他植物蛋白相比,火麻蛋白的起泡性和起泡稳定性较低。杜娟等[22]研究发现在中性条件下苦杏仁蛋白的起泡性超过80%,起泡稳定性超过70%,火麻蛋白较低的起泡性与起泡稳定性主要原因可能是其在中性条件溶解度较低。由图5(b)可知,火麻仁蛋白和未脱壳火麻蛋白在中性条件下乳化性能是相近的,二者没有显著性差异;但是在乳化稳定性上,火麻仁蛋白显著(P<0.05)高于未脱壳火麻蛋白。在中性条件下,两种火麻蛋白的溶解度都很低,可能是二者乳化性相近的原因。分析认为,乳化稳定性的差异主要与未脱壳火麻蛋白多酚含量较多有关。已有研究表明:当温度升高时,多酚与蛋白质的亲和力减弱,使得多酚-蛋白复合物的结构发生改变,从而造成了两种蛋白质乳化稳定性的差异[23]。
2.5 脱壳处理对火麻蛋白体外模拟消化的影响
两种不同火麻蛋白的体外模拟消化结果见表3。由表3可知,脱壳后火麻蛋白模拟胃消化率从60.23%显著(P<0.05)提高到了68.56%,模拟胃肠消化率从78.93%显著(P<0.05)提高到了92.66%,这表明脱壳处理能显著提高火麻蛋白的消化率,类似的结果在House等[24]的报道也有体现。其中,火麻籽壳中的多酚起着主要影响,一方面,多酚能与蛋白质通过氢键、疏水相互作用及共价作用等方式与蛋白质结合形成多酚-蛋白质复合体,降低火麻蛋白的消化率[25];另一面,籽壳中的酚类化合物也会阻碍酶的作用,影响火麻蛋白的水解[26]。

表3 脱壳处理对火麻蛋白体外模拟消化率的影响Tab.3 Effect of hulling treatment on simulated digestibility of hemp protein in vitro %
3 结 论
1)经过脱壳处理的火麻粕(火麻仁粕)具有蛋白质回收率和蛋白质纯度更高及色泽更好等方面的优势,火麻仁粕更适合作为工业化生产火麻蛋白的原料。
2)脱壳处理对火麻蛋白氨基酸组成和二级结构并无显著影响,但火麻仁蛋白的持水性、持油性、起泡性和乳化性等功能特性优于未脱壳火麻蛋白。
3)经过体外模拟消化的火麻蛋白消化率能达到78.93%~92.66%,在体外模拟消化率上媲美大豆蛋白,是一种较易被人体吸收的优质植物蛋白。
4)火麻籽脱壳处理是提高火麻蛋白在食品领域潜在价值和扩大应用的必要步骤,但仅仅是脱壳处理还不足以满足其在食品体系中广泛应用的要求。因此,需要加大研究火麻蛋白改性技术来进一步提高火麻蛋白的应用价值。
