植物ABI3转录因子研究进展*
2021-08-26刘长菊杨杉杉刘石娟
刘长菊,杨杉杉,孙 鸽,刘石娟
(曲阜师范大学生命科学学院,273165,山东省曲阜市)
植物从种子发育成完整植株,开花结实繁衍生息,期间需要经历许多挑战.种子萌发和幼苗形成受到严格的调控,以最大限度地提高植物的存活率,使其成功繁殖成为可能.在其生长发育的过程中,为了能够在适当的时间发芽,种子具备了一定的监测环境的能力.与此同时,为应对多种胁迫,植物已经进化出较为完整的信号网络来整合环境信号,以精细地控制这些发育过程.而植物种子的发育过程涉及到多个转录因子的调控,ABI3就在其中发挥重要作用.近年来研究发现,ABI3不仅参与种子的发育和休眠过程,它在植物营养生长后期以及非生物胁迫方面也发挥重要作用.本文对ABI3近年来的研究进展进行了梳理,以期对ABI3转录因子有更进一步的了解.
1 ABI3的结构特点
ABI3基因在玉米、小麦、番茄、水稻、燕麦和拟南芥等多种植物的种子中广泛存在且高度保守[1,2].ABI3是一个多结构域蛋白,属于植物特有的B3蛋白家族(因含有B3结构域而命名).所有的ABI3蛋白都有4个高度保守的结构域:A1转录激活域和3个基本结构域B1、B2和B3.其中 A1结构域是转录激活结构域,位于蛋白富含酸性氨基酸的N末端[3].B1和B2结构域带有核定位序列,介导蛋白质-蛋白质相互作用.已知B1与包括植物脱落酸不敏感蛋白5(abscisic acid-insensitive 5,ABI5)在内的其他bZIP转录因子相互结合发挥作用.B2结构域可以通过与保守的G-box元件(CACGTG)或脱落酸响应元件ABREs (abscisic acid responsive element)结合而引起反式激活[4].B3结构域是ABI3蛋白最保守的结构域,能够与已知种子特异性基因的启动子区域中发现的几个保守顺式元件结合.有趣的是,ABI3的B3结构域根据不同的生理和发育线路与3个不同的共有序列结合,即Sph/RY元件(CATGCA)、G-box/ABREs(GACGTG)和生长素响应元件AuxRE(auxin response elements) (TGTCTC)[5-7].ABI3的B3结构域在不同的生理条件下与不同的顺式元件结合的能力可能赋予ABI3在植物胁迫和发育反应中的多方面作用.

图1 ABI3家族蛋白的结构域
2 ABI3参与植物生长发育
2.1 ABI3参与ABA信号途径
种子向幼苗的成功转化是植物繁殖和作物产量的先决条件.这种转变的实现主要基于两种分子机制:一是打破种子休眠并启动萌发,二是幼苗建立过程的优化和控制[8].高等植物种子发育包括胚和胚乳发育(形态发生)及种子成熟.在种子发育及成熟过程中内源ABA(来源于母体合成和胚内合成两个阶段)的含量增加,诱导和维持种子的初级休眠.但是只有胚内合成的ABA能诱导和维持种子的初级休眠,母体合成或胚发育期间外源施加ABA均不能诱导种子的初级休眠[9].植物种子从休眠到萌发的转变是植物生活史的一个重要转折点.种子萌发的启动依赖于种子内源ABA的降解和种胚对ABA的脱敏作用,并且需要多种转录因子调控.ABI3是ABA信号转导过程中的重要调控因子之一,在种子萌发中发挥着重要的作用.
植物激素ABA调节多种生理过程,包括种子成熟、胚胎形态发生和干燥、气孔运动以及逆境蛋白和代谢物的合成.ABA是目前已知的一种能诱导、调节和维持种子初级休眠的激素.良好条件下种子中ABA含量较高,GA含量较低.种子休眠是由ABA维持的,ABA的水平被发现从胚胎发生到胚胎成熟逐渐增加[10].ABA通过抑制吸水(吸胀)从而抑制细胞壁松动来限制胚胎的生长潜力,这是开始萌发的关键步骤[11].ABA还通过激活碱性亮氨酸拉链转录因子ABI5诱导晚期胚胎发生丰富基因(LEA)表达和生长停滞[12].已有报道ABI5和ABI3(由ABA激活)通过ABRE和RY元件协同抑制萌发[13,14],大致通路如下:在ABA存在下,ABA受体PyR/PYL/RCAR ( pyrabactin resistance/Pyrabactin resistance-like/regulatory component of ABA receptor)与蛋白磷酸酶2C(protein phosphatase 2C,PP2C)形成复合物,抑制PP2C的磷酸酶活性,从而激活蔗糖非酵解蛋白激酶2(SNF1-related protein kinases type 2,SnRK2).激活的SnRK2随后激活ABRE结合蛋白/ABRE结合因子(AREB/ABFs),进而激活ABA响应基因的转录.在AREB/ABFs转录因子中,ABI5是碱性亮氨酸拉链转录因子家族的成员,在调节种子中ABA应答基因方面起着核心作用[15].ABI3被报道与ABI5共同作用,诱导ABA响应基因的表达,从而调节种子休眠和萌发(如图2所示).
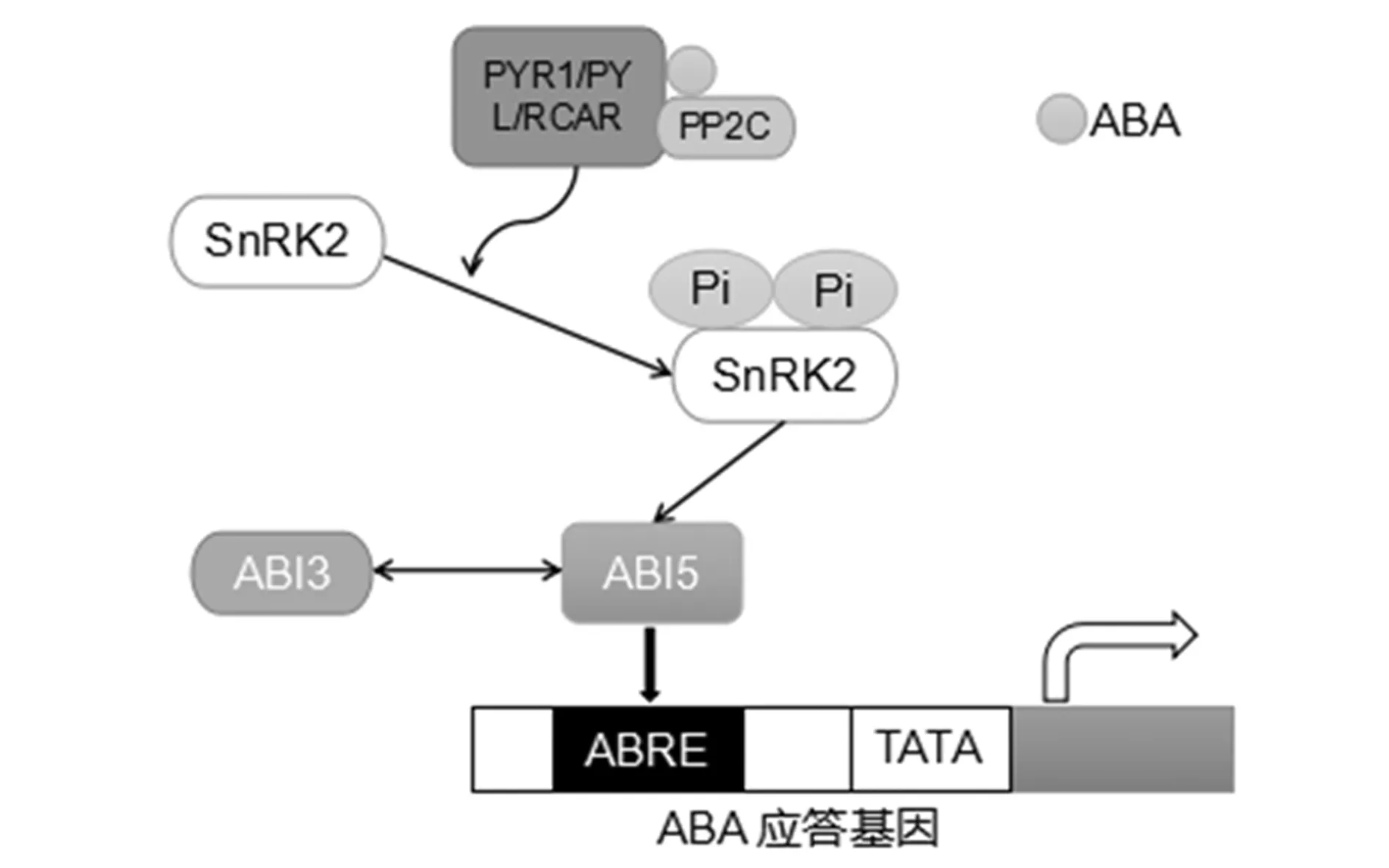
图2 种子发育过程中的ABA信号途径[15]
2.2 ABI3参与种子萌发与休眠
ABI3是众所周知的种子萌发的关键负调控因子[16].它通过B3结构域与靶标基因启动子的RY/Sph种子特异性元件相互作用激活基因转录,其功能主要在于维持胚胎发生和种子休眠,功能丧失会导致种子发育受损.研究表明ABI3在ABA介导的种子休眠和抑制种子萌发过程中起作用,AtABI3转录本水平在休眠种子中很高,萌发后迅速下降.同样,ABI3蛋白水平在萌发种子中以光依赖的方式降低[13].ABI3是ABA诱导种子萌发和萌发后生长停滞的关键因子,在转录水平和转录后水平上都受到调控:一些基因,如组蛋白去乙酰化酶6/组蛋白去乙酰化酶19 (HDA6/HDA19),通过直接或间接调节AtABI3基因的表达来调节种子萌发[17].含MDN1(midasin homologue 1)结构域的拟南芥SAG蛋白通过负调控AtABI3基因参与种子萌发和幼苗发育[18].在萌发过程中,AtABI3基因还被CHD3型染色质重塑因子PICKLE(PKL)所抑制[19].种子萌发时,活性氧积累,诱导生长素响应蛋白8(auxin-responsive protein 8,IAA8)基因的表达,从而促进IAA8蛋白的合成.随着合成的增多,IAA8蛋白的积累量增加进而抑制生长素响应因子ARF(auxin-responsive factor)活性,从而下调AtABI3基因的表达,最终促进种子萌发[20].然而拟南芥硝酸盐调控因子1 (Arabidopsis nitrate regulated 1,ANR1)通过激活AtABI3基因的表达,对环境胁迫信号和内源激素做出响应进而抑制种子萌发和萌发后生长[21].在番茄(Solanumlycopersicum)中,SlABI3转录本主要在种子吸胀过程中表达,参与种子萌发的调控[22].BR (brassinolide and castasterone)激活的BR相关转录因子BES1(bri1-ems-supperssor 1)-TPL(protein topless)-HDA19共阻遏复合物控制着AtABI3基因的表观遗传沉默,从而抑制了幼苗发育早期的ABA信号输出,促进萌发[23].
转录因子WRKY41和ABA协同调节AtABI3基因的表达和种子休眠.WRKY41直接调节成熟和吸胀种子中AtABI3基因的表达,从而控制种子的初级休眠[24].之前的研究表明,缺乏AtABI3基因(由功能丧失突变引起)会极大地减少种子的初级休眠[25].AtABI3基因在休眠中的作用与吸胀种子的高AtABI3转录本丰度特性有关[14].在种子萌发和早期幼苗发育过程中,拟南芥转录因子RAV1(related to ABI3/VP1 transcription factor)基因的表达明显增强,抑制RAV1基因表达减缓了种子萌发.在胁迫条件下,ABA水平升高,抑制RAV1基因的表达,RAV1蛋白表达减弱.由RAV1蛋白下调的AtABI3基因表达显著增强,种子休眠得到加强,以避免过度的检查点停滞[26].除此之外,在ABI3上游,Barrero等人发现一个RING-finger蛋白(一类E3泛素连接酶)的编码基因DEP (despierto)在种子发育期间调控AtABI3基因表达并影响休眠的诱导[27].与此同时,AtABI3基因还是生长素介导的种子休眠的主要下游调控成分,生长素通过ARF10和ARF16介导的AtABI3转录增加来负向调节种子萌发[15,16].
2.3 ABI3参与其他生长发育过程
ABI3还具有更广泛的功能,如质体发育、芽休眠和体细胞胚胎发生等.当将拟南芥幼苗由光下生长7天转至暗环境生长若干天后,发现abi3突变体含有典型的质体,野生型植株叶片含有发育停滞的质体,而过表达转基因植株EN35S::ABI3的叶片含有叶绿体,这些结果表明,AtABI3在营养组织中负责质体分化[28].在杨树(Populustrichocarpa)中,PtABI3在短日照条件下的芽形成过程中的芽胚叶中表达,并调节芽内胚叶的相对生长速率和分化[29].在小立碗藓(Physcomitrellapatens)中,PpABI3是一种营养发育的负调控因子,ABA和PpABI3可能通过调节生长素相关基因的表达来实现营养发育的调控[30].在拟南芥中,与植物细胞全能相关的转录因子BABY BOOM (BBM)的过表达诱导拟南芥体细胞胚的形成,AtABI3定量调节BBM介导的体细胞胚胎发生[31].此外,生长素在根中诱导了AtABI3基因的表达从而促进侧根形成和抑制萌发[32].
ABI3在营养生长期的表达模式和功能丧失的abi3-4突变体的早花表型暗示了种子休眠和幼苗早期发育之外的其他发育作用[33].ABI3对开花起负调控作用,ABI3功能的丧失诱导了长日照和短日照条件下的早花表型.BES1介导AtABI3基因的抑制从而促进开花,在野生型拟南芥和茄属植株中,AtABI3基因的异源表达特异性地损害了bes1-D突变体的早花表型,并诱导了严重的晚花表型.
3 ABI3参与非生物胁迫
植物在其生长过程中,会受到许多不良环境因素的影响.为了适应环境,在长期的进化中,植物已逐渐建立起适应和抗性机制.近年来有研究表明,ABI3转录因子在温度胁迫、脱水胁迫等非生物逆境中起到了重要调控作用.
3.1 ABI3参与脱水胁迫
干旱、盐渍、低温等外界因子引起的脱水胁迫能使植物体内产生一系列生理和生化变化, 并诱导许多特殊基因进行表达.最近发现,ABI3通过调控几个下游基因介导非种子植物和种子植物的脱水胁迫反应[34].拟南芥中AtABI3的缺失影响了其从脱水胁迫中恢复的能力.AtABI3调节与干燥耐受性有关的储存蛋白的积累.甘蓝型油菜(BrassicanapusL.)中BnABI3可以调节种皮发育,从而在种子脱水耐性中发挥作用[35].拟南芥种子成熟期间,AtABI3的表达在体内持续到最后阶段,并正向调节胚胎发育晚期丰富蛋白基因家族(late embryogenesis abundant gene family,LEA),如AtEm1和AtEm6,它们的产物被认为具有脱水耐受性[13].近年研究表明,ABI3蛋白通过占据自身基因的上游调控序列即结合启动子区域的Sph/RY元件(CATGCA)自激活以响应脱水胁迫信号.在转录抑制过程中,核小体存在于关键顺式元件(与ABI3结合)的启动子区域,这些核小体在转录活跃时被重新定位,并在应激诱导的转录过程中表现出H3K9乙酰化增强,以响应脱水胁迫和胁迫恢复[34].此外,ABI3还上调包括已知的种子特异性因子如十字花科蛋白基因CRUCIFERIN1、CRUCIFERIN3以及LEA基因家族(如LEA76、LEA6、DEHYDRIN LEA和LEA-like)在内的几个基因在胁迫恢复阶段发挥作用[36].在应对脱水胁迫时,ABI3还可以通过阻止RNA聚合酶Ⅱ的募集抑制RAV1基因的转录,RAV1基因表达下调诱导乙烯不敏感蛋白2 (ethylene insensitive 2,EIN2)和乙烯受体1(ethylene receptor 1,ETR1) 在胁迫下表达降低,从而产生有效的脱水应激反应[37].在非种子植物中,ABI3介导的应激反应的一个突破性发现是,它可以使无籽植物小立碗藓具有脱水应激耐受性[38].
3.2 ABI3参与温度胁迫
植物的生长发育需要一定的温度条件,当温度超出了植物的适应范围,就会对其形成胁迫,造成不同程度的损害.植物在长期适应过程中进化出适应和抵抗低温、高温胁迫的能力.研究植物如何应答和适应环境温度不仅具有重要的理论意义,在全球气候异常的大趋势下, 对保障国家粮食安全也具有重要的应用价值.
对于拟南芥来说,高温抑制其种子萌发或触发种子休眠使其不能正常生长.遗传和生理分析表明,表观遗传因子Powerdress (PWR)通过ABI3负调控锌指蛋白基因SOMNUS(SOM)的表达[39].无高温胁迫时,PWR与ABI3和HDA9作为复合物相互作用促进组蛋白H3脱乙酰化水平和SOM位点组蛋白变体H2A.Z沉积,从而抑制SOM转录进而促进种子萌发.高温胁迫抑制PWR转录水平,PWR无法与ABI3和HDA9形成复合物,从而减弱对SOM表达的抑制作用,与此同时ABI3、ABI5和DELLA蛋白相互作用,在体内靶向定位于SOM启动子[40],并在蛋白水平上相互结合,高温下共同激活SOM基因表达,进而导致种子萌发受到高温抑制.
在全球范围内,低温胁迫对植物生长和作物生产力产生了不利影响,而植物通过冷驯化进化出了耐低温胁迫的机制.冷驯化是一个复杂的过程,涉及到植物生理和代谢的诸多变化,其中包括低温诱导的脱落酸浓度的瞬时增加[41],这被认为是触发特定基因表达和提高耐寒性的标志.研究表明,外源ABA可以替代低温刺激诱导抗冻性发育.在拟南芥中,ABI3转基因植株在短时ABA处理下的抗冻性增强,表明ABI3基因的异位表达可能调节低温诱导的抗冻性,赋予了其对冰冻温度更高的耐受性[42].在非种子植物中,在冷驯化过程中,ABI3至少部分通过ABA信号通路参与了小立碗藓的耐冷调节.PpABI3(Δabi3-1)的缺失会影响与冷反应和抗氧化保护相关基因的诱导,从而减少低温保护剂和抗氧化剂的积累,表明PpABI3在植物的低温响应和抗冻性中起重要作用[43].与此同时,在甘蓝型油菜中ABI3基因介导的各种逆境、种子成熟和分子伴侣基因的上调导致了种子能够耐受亚致死霜冻.ABI3基因表达的增加可能直接导致种子固绿蛋白2(stay green 2,SGR2)水平上调,致使叶绿素降解,并且导致耐冻/脱水所需的依赖于ABI3的LEA、Rab18的积累;此外ABI3还通过增加瓣膜厚度来提高荚果强度,从而保证在霜冻条件下也能有效地促进叶绿素的分解,使其种子脱绿,进而保证了油料作物的经济价值[44].
3.3 ABI3参与其他胁迫
高盐度限制了植物不同的生长和发育过程,其生理效应是多方面的,盐过度敏感因子(salt overly sensitive,SOS)基因家族SOS1、SOS2、SOS3、Na+/H+交换蛋白3(sodium/hydrogenexchanger3,NHX3)、响应干旱胁迫29B(responsivetodessication29B,RD29B)、脱落酸不敏感蛋白2 (abscisicacid-insensitive2,ABI2)、ABI3、MYB15和δ-1-吡咯啉-5-羧酸合酶1(delta-1-pyrroline-5-carboxylatesynthase1,P5CS1)等基因的转录都受到盐胁迫的促进.与野生型植株相比,AtDIV2(拟南芥转录因子DIV2编码基因)功能缺失突变体的耐盐性提高,对外源ABA的敏感性增强,ABA含量显著增加.在div2突变体中,ABA相关基因以及胁迫相关基因如ABA1、ABI3和P5CS2的转录水平均上调,表明在野生型植物中AtDIV2可能适当的调控ABI3活性参与盐胁迫[45].此外ABI3还介导AtPER1 (period circadian protein homolog 1)基因的表达和氧化应激诱导[46].
4 展 望
多项研究表明,ABI3转录因子在调控种子萌发,应对非生物胁迫中发挥着巨大的作用.ABI3通常在植物生命周期的过渡(即休眠维持)期间把关,起到萌发“检查点”的作用;在非生物胁迫下,植物ABI3转录因子通过与目标DNA结合,与相关蛋白互作,参与调控信号网络,形成了多样且复杂的网状调控系统.已报道的ABI3转录因子主要通过目的基因启动子区域的特异性元件结合发挥作用,且ABI3转录因子参与ABA信号转导.但是,目前的研究大多局限于ABI3在种子萌发及幼苗发育过程的作用机制,对于ABI3在其他生长阶段发挥的作用研究较少.此外还有许多问题需要进行系统深入的研究和探讨,如农作物中ABI3具有的生物学功能是否与拟南芥中的功能相同?在某一特定生物学过程中ABI3分子调控网络是如何协同的?
随着生物信息学、基因组学、分子生物学的进步,模式植物和一些植物基因组测序的完成,转录因子ABI3功能的研究有了长足的发展,对小麦、水稻、玉米等重要农作物中ABI3进行深入的研究,有助于人们深入了解ABI3的分子调控网络,为作物遗传改良提供新的依据.
