Ni离子螯合亲和层析法分离大叶海藻中的抗氧化多肽
2021-08-25余科义徐礼龙毕静
余科义,徐礼龙,毕静
1. 河南应用技术职业学院(郑州 450042);2. 固始县农产品质量安全检测中心(信阳 465200)
海藻是海产藻类的统称,虽然是海洋中的低等生物,却是海洋中有机营养物资的主要生产者。海藻除富含蛋白质、维生素、矿物质和ω-3系列不饱和脂肪酸以外,还可生成独有的代谢性化合物(褐藻多酚、岩藻黄质等)[1-2]。大叶海藻属马尾藻科,是海藻中一种生长在浅海区域的品种,能够进行充分的光合作用与生物代谢活动,在药理活性上,具有降血脂、抗氧化、抗菌、增强免疫力等的功效,可作为营养品、化妆品、功能性食品及潜在药物资源等进行应用和开发,提高海藻的资源化优势[3-4]。
金属螯合亲和层析技术(MCAC)是近年来出现的主要针对生物大分子分离纯化的一种新型亲和层析技术,一般层析介质的结构由固相基质、螯合配基、金属离子组成,可用于蛋白质的分离纯化、活性酶的纯化及核苷酸的纯化等。尤其在蛋白质方面的应用,MCAC除了能够分离纯化以外,还可以实现蛋白质的识别和鉴定、蛋白质的定向固定及蛋白质的复性纯化。因而在生物科技及医学检测中尤为重视[5-6]。试验拟用Ni2+螯合海藻中的抗氧化多肽后经亲和层析柱分离提取,从而保证抗氧化多肽的高纯度和优良的活性。
1 材料与方法
1.1 材料、试剂和仪器
大叶海藻(正禾生物科技有限公司);NaHCO3(济南明星化工有限公司);丁醇(山东诺尔化工有限公司);IDA(湖北远成赛创科技有限公司);壳聚糖(南京松冠生物科技有限公司);CH3COOK(广州三鑫化工有限公司);span 60(江苏海安石油化工厂);Na2S2O3(郑州欣茂化工产品有限公司);CH3COOH(南京化学试剂股份有限公司);NiSO4(武汉宏信康精细化工有限公司);NH4Cl、NH3·H2O(太原安业化工有限公司)。
JFM-12细胞破壁机(济南健辰机械有限公司);DT-5离心机(广东佛衡仪器有限公司);索式提取器(上海欢奥科技有限公司);LYZ-111B培养摇床(上海新诺仪器设备有限公司);UV-1800紫外可见分光光度计(爱来宝医疗科技有限公司)。
1.2 大叶海藻的预处理
将大叶海藻进行细胞壁破碎后浸于5% NaHCO3溶液2 d,抽滤留取沉淀物,参照文献[7]对沉淀物进行甲酯化处理后离心脱去。剩余的沉淀物置于丁醇溶剂中进行浸提,采用索式提取器重复3次对浸提液纯化,得到大叶海藻的多肽粗提取液。
1.3 Ni2+螯合亲和层析柱的制备[8]
选用IDA-壳聚糖作为层析柱填料。对壳聚糖进行预处理,将壳聚糖溶解于5%的CH3COOK溶液中,加入2 mL span60和20 mL Na2S2O3溶液(质量分数5%)。形成壳聚糖微球后在50 ℃恒温水浴中加入CH3COOH溶液脱除Na2S2O3。离心沉淀后取出沉淀微球,并置于氯仿中浸泡2 h,乙醇清洗并去离子水洗后与IDA在摇床中反应生成IDA-壳聚糖微球。将此IDA-壳聚糖微球填料装柱,用0.1 mol/L的NiSO4水溶液充分冲流整个柱体,使得Ni2+被充分吸附于IDA-壳聚糖填料。采用约pH 8.0的NH3·H2O-NH4Cl缓冲溶液平衡层析柱的酸碱性,使之维持在弱碱性环境状态。
1.4 Ni2+与多肽的螯合亲和层析
用缓冲溶液NH3·H2O-NH4Cl调节多肽粗提取液至与层析柱pH相近,匀速将粗提取液倒入层析柱上端,静置等待样品与Ni2+在层析介质上充分结合[9]。采用缓冲溶液NH3·H2O-NH4Cl快速洗脱得到分离液,用不同洗脱剂洗脱,洗脱流速控制在2 mL/min,每5 min收集一批洗脱液,将收集的洗脱液再倒入层析柱中反复洗脱3次,得到的洗脱样品在240 nm下测定吸光度以判断多肽浓度高低。
1.5 试验中的相关测定
镍含量的测定:参照文献[10],采用乙二胺四乙酸滴定法进行滴定,计算得出镍含量。并根据式(1)计算出镍与抗氧化多肽的螯合率。
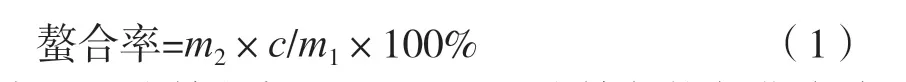
式中:m1为镍的加入量,g;m2为镍与抗氧化多肽形成的螯合物质量,g;c为镍含量,%。
抗氧化多肽的乳化活性测定:参照文献[11],将抗氧化多肽与不同pH的缓冲溶液配制成0.2%的抗氧化多肽溶液。加入1.0 mL植物油混合混匀后,吸取底部溶液与SDS溶液混合,测得的最大吸光度计为乳化活性。
抗氧化多肽对超氧负离子的清除能力:参照文献[12],采用邻苯三酚法。将不同浓度的抗氧化多肽经水浴30 ℃加热30 min后,加入Tris-HCl缓冲溶液和邻苯三酚溶液静置比色。紫外分光光度计每5 min测定1次最大吸光度,绘制最大吸光度变化曲线,经拟合处理,其斜率为抗氧化多肽清除·速率。

抗氧化多肽对羟自由基的清除能力:参照Fenton检测法[13],在试管中加入抗氧化多肽、FeSO4溶液、H2O2溶液,摇匀后静置15 min,加入水杨酸溶液,静置后于480 nm波长处测其最大吸光度,并根据式(3)计算羟自由基的清除率。

式中:A0为空白对照试验组吸光度;A1为试验组吸光度;A2为不添加水杨酸的试验组吸光度。
2 结果与讨论
2.1 不同洗脱剂对抗氧化多肽在亲和层析柱上的洗脱影响
图1为4种不同洗脱剂在浓度均为0.01 mol/L情况下的最大洗脱值对比图,可以明显看出,吡啶和甲酸钠洗脱效果较差,且会影响层析柱的pH环境。NaH2PO4和Na2HPO4的洗脱效果较好,其中,NaH2PO4不仅洗脱效果最好,而且与抗氧化多肽的活性pH范围相近,因而试验选用NaH2PO4溶液作为洗脱剂。
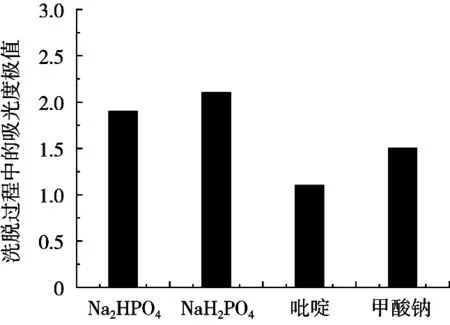
图1 几种洗脱剂的洗脱效果对比柱形图
2.2 抗氧化多肽的洗脱纯化
在Ni2+螯合亲和层析柱中加入大叶海藻多肽粗提液后,层析柱的洗脱曲线如图2所示。采用缓冲溶液洗脱得到的第1个峰为杂质洗脱峰,第2个峰为利用NaH2PO4溶液作为洗脱剂进行洗脱的特异性洗脱峰。可以看出2个峰之间的间距时间较长,这样有利于杂质的脱去而使得多肽的纯化效率提升,纯化效果提高。具体的抗氧化性多肽的纯化效率如表1所示。
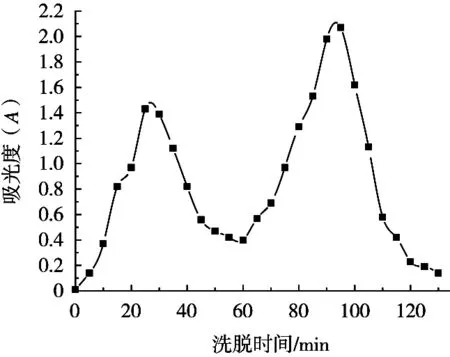
图2 蛋白质的洗脱曲线

表1 抗氧化多肽的纯化效率
2.3 抗氧化多肽-Ni螯合物的组成及螯合率分析
抗氧化多肽与Ni-IDA-壳聚糖-span60形成的螯合物组成成分含量及螯合率测定结果如表2所示。抗氧化多肽与Ni的含量较高,总占比达86.2%,其他成分则包含span60、灰分、钠钾盐等。螯合率超过70%,表明亲和层析柱对抗氧化多肽的吸附作用明显,后续洗脱工艺可以得到纯度较高的抗氧化多肽。

表2 螯合物的组成及螯合率测定结果
2.4 层析柱的pH环境对抗氧化多肽乳化活性的影响
层析柱的酸碱性对抗氧化多肽的乳化活性影响变化如图3所示。在乳化活性测定试验中,多肽被吸附于油-水交界面形成微膜,多肽链端的羧基可与油相互相作用,而氨基则与水相互相作用,从而平衡油-水交界处的平衡,此时利于乳化性能的提升。因此,抗氧化多肽在不同pH环境下的羧基基团和氨基基团数量决定着乳化活性。从图3可以看出,乳化活性在弱碱性条件下较为活跃,所以试验中的层析柱pH也应处在弱碱性范围内。
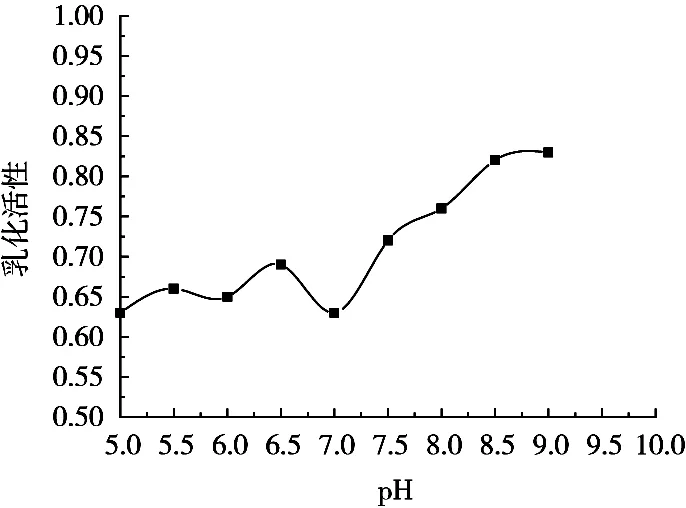
图3 层析柱的pH对抗氧化多肽乳化活性的影响曲线
2.5 大叶海藻抗氧化多肽的抗氧化活性分析

图4 抗氧化多肽质量浓度对O2-·清除率的关系曲线
2.5.2 对·OH的清除能力
不同质量浓度的抗氧化多肽对·OH的清除率测定结果如图5所示。大叶海藻中提取出来的抗氧化多肽对·OH的清除率随着其质量浓度增加而呈现清除率迅速增大的趋势。推测为抗氧化多肽的链段中存在着能与·OH发生二级反应的基团,故初始抗氧化多肽质量浓度较低时引发的·OH迁移速率较慢,一级反应的终产物浓度提升时,决定整个反应速率的二级反应才会显著加快,提高对·OH的捕捉能力,因而对·OH清除能力在抗氧化多肽质量浓度大于10 μg/mL时明显增强。
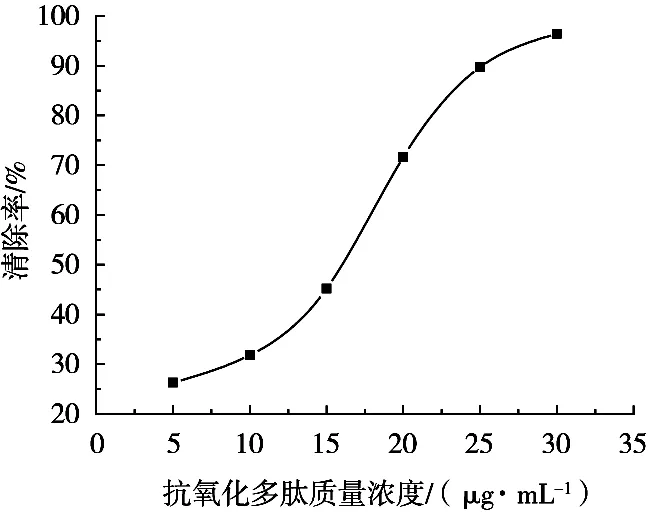
图5 抗氧化多肽质量浓度对·OH清除率的关系曲线
3 结论
以大叶海藻为原料,采用Ni2+离子亲和层析柱拟对海藻中的抗氧化多肽进行分离纯化。多肽与Ni2+形成螯合物后,吸附于IDA-壳聚糖-span60组成的层析柱中,经洗脱剂NaH2PO4溶液洗脱后即得纯化的抗氧化多肽溶液。比对几种洗脱剂的洗脱效果,NaH2PO4不仅洗脱效果最好,而且与抗氧化多肽的活性pH范围相近。抗氧化多肽-Ni螯合物经分析由抗氧化多肽、Ni、IDA-壳聚糖和其他成分组成,抗氧化多肽与Ni总占比86.2%,而螯合率也超过70%。层析柱经缓冲溶液调节约pH 8.5时分离纯化效果最佳。洗脱过程中的洗脱曲线会产生杂质洗脱峰和多肽洗脱峰,2个峰之间的间距时间较长,说明层析柱将杂质与多肽互相分离的程度较高。试验还对抗氧化多肽的抗氧化能力进行探讨,抗氧化多肽质量浓度达到30 μg/mL时,对O2-· 和·OH的清除率分别达到91.8%和96%,此时多肽的抗氧化活性较高。
