电位滴定法测定酸性镀锌溶液中氯化锌浓度
2021-08-25王晓红
王晓红,李 建
(安泰科技股份有限公司北京空港新材分公司,北京101318)
电镀主盐含量的测试是电镀溶液维护的常规项目,为了确保电镀生产过程的顺利进行,必须定期对镀液进行主盐含量的测试。
目前,电镀锌溶液中氯化锌含量的测定方法主要有EDTA滴定法[1-2],分光光度法[3],试剂盒快速测量法[4],火焰原子吸收法[5]及自动电位滴定法[6]。EDTA滴定法为:镀液中加入合适的金属离子掩蔽剂,以铬黑T为指示剂,在pH=10条件下,用EDTA标准溶液进行滴定,当溶液颜色从紫色变为蓝色即为滴定终点,通过EDTA溶液的消耗量计算镀液中氯化锌的含量。该测试过程的准确性易受到操作者对颜色变化的判断及滴定速度的控制等因素影响。分光光度法测定时,需向溶液中加入合适的显色剂,并使用分光光度计在特定的波长下测定溶液中锌离子的含量。此方法测量过程繁琐不利于镀液日常测量的应用。而试剂盒测试的准确度低,火焰原子吸收法设备采购成本高,导致这两种测试方法的应用无法推广。
现已有文献报道有关锌离子含量的电位滴定法。乐薇等[6]采用铜离子选择电极为指示电极,Cu-EDTA为置换剂,实现了溶液中锌离子和镁离子的分步滴定。但铜离子电极使用过程中存在电极电位下降,电位突跃不稳定等问题,容易导致滴定终点判定的准确性下降。本文介绍了一种采用钙离子电极为指示电极的自动电位滴定仪进行锌离子浓度的测定方法。该方法与铜离子电极电位滴定法相比,具有滴定终点电位突跃高,电极稳定性好等优点。
1 实验原理
实验采用钙离子选择电极为指示电极,EDTA为滴定剂,加入3.0 mL Ca-EDTA络合物,以指示电位变化。其原理为:在未达到终点时,Ca-EDTA中的Ca2+被Zn2+取代而对钙离子电极响应,产生相应电位,达到等当点时,Ca2+与最后加入的EDTA络合,Zn2+浓度发生突跃变化,相应的电位也发生突跃变化,从而指示反应终点。
2 测试方法
2.1 仪器与测试条件
采用ZDJ-4A型自动电位滴定仪(上海精密科学仪器有限公司出品)、指示电极为402型钙电极、参比电极为217型双盐桥甘汞电极。具体测试条件:滴定剂预加体积为2.0 mL,滴定剂最大增量为0.2 mL,搅拌速度为20 r/min。
2.2 试剂
0.05 mol/L EDTA滴定液:称取分析纯乙二胺四乙酸二钠(C10H14N2O8•2H2O)20.00 g,以水加热溶解后,冷却,稀释至1 L。
标准镀液:准确称取分析纯氯化钾240.00 g,溶于水中,加入氯化锌60.00 g,硼酸30.00 g,搅拌溶解后加入8.0 mL主光亮剂和25.0 mL副光亮剂,转移至1000 mL容量瓶中,加水定容,摇匀。此标准镀液中所含光亮剂和副光亮剂为开缸标准浓度。
标定溶液:准确称取分析纯金属锌0.4000 g于150 mL烧杯中,以少量1∶1(水和盐酸体积比)盐酸加热溶解,冷却后移入100.0 mL容量瓶中,加水稀释至刻度,摇匀;
0.05 mol/L Ca-EDTA溶液:称取乙二胺四乙酸二钠钙(C10H12CaNa2N2O8•4H2O)22.3165 g,以水加热溶解后,冷却,定容至1 L。
pH=10缓冲溶液:称取54.00 g分析纯氯化铵至200 mL水中,加入350 mL氨水(相对密度0.89),加水稀释至1 L。
2.3 测定步骤
2.3.1 EDTA滴定液的标定
准确吸取标定溶液5.00 mL至100 mL烧杯中,加水40 mL,加入3.0 mL浓度为0.05 mol/L的Ca-EDTA溶液,加入pH=10缓冲溶液3 mL,放入磁力搅拌子,设定搅拌速度20 r/min进行搅拌,插入钙电极和参比电极,开始滴定,滴定结束后记录滴定剂消耗的毫升数V标。
2.3.2 空白滴定
用5.00 mL水代替滴定溶液按2.3.1步骤滴定,记录滴定剂消耗的毫升数V空白。
2.3.3 EDTA滴定液浓度计算
EDTA滴定液浓度按照公式(1)计算:

式中:cEDTA为EDTA滴定液的浓度,mol/L;m锌为分析纯金属锌的重量,g;V标为滴定标定溶液时消耗EDTA滴定液的体积,mL;V空白为滴定空白溶液时消耗EDTA滴定液的体积,mL。
2.3.4 镀液测定
准确吸取冷却至室温的锌镀液10.00 mL置于100.0 mL容量瓶中,加水定容,混匀。
准确吸取稀释后镀液5.00 mL于100 mL反应烧杯中,依次加入40 mL水、3.0 mL浓度为0.05 mol/L的Ca-EDTA溶液以及pH=10的缓冲溶液3 mL,放入磁力搅拌子。按仪器主要参数设定实验方法,插入钙电极和参比电极,滴定结束后记录EDTA滴定剂消耗毫升数V样。
2.3.5 镀液中氯化锌含量计算
电镀液中氯化锌浓度按公式(2)计算:

式中:cEDTA为EDTA滴定液的浓度,mol/L;V样为滴定待测液消耗EDTA滴定剂的体积,mL;V空白为滴定空白溶液时消耗EDTA滴定液的体积,mL。
3 结果与讨论
3.1 电镀添加剂的影响
本公司酸性镀锌溶液中加入的添加剂有主光亮剂和副光亮剂两种。实验中,按照比例混合后进行实验。结果表明两种添加剂的加入量为规定浓度的2倍时,未发现明显影响。
3.2 镀液主盐的影响
酸性镀锌溶液中含有氯化锌、氯化钾和硼酸三种主盐,这三种主盐均不含有Ca元素,且氯化钾和硼酸与EDTA不发生化学反应,对于测试过程无影响。
3.3 杂质离子的影响
电镀溶液中常见的杂质离子有Cu2+、Fe2+、Al3+、Pb2+。实验表明,这4种杂质离子对于锌离子的络合滴定有严重干扰。少量的Fe2+和Al3+可通过加入三乙醇胺进行掩蔽[7]。
3.4 电极的选择
指示电极可以选择钙电极配合Ca-EDTA或者铜电极配合Cu-EDTA进行锌离子的滴定。经实验验证,滴定至等当点时,钙离子电极较铜电极电位突跃高。同时,铜电极的电极电势随着实验次数及使用时间的延长,电极电势逐渐降低,导致滴定终点时电极电位变化较钙电极的低。
图1 为铜电极和钙电极电位滴定曲线。钙电极每次测定之前,须活化1 h后使用。实验中选择钙电极作为指示电极。217型双盐桥甘汞电极为参比电极,使用前向电极中注满饱和硝酸钾溶液,且多次测试后须及时更换新液。

图1 铜电极和钙电极电位滴定曲线Fig.1 Potentiometric titration curves of copper electrode and calcium electrode
3.5 滴定剂预加体积的选择
为了缩短滴定总时间,滴定开始后,向反应烧杯中加入一定体积(大于最大增量)的滴定液。考虑到镀液中氯化锌浓度随着生产过程的进行会有一定的波动,设定预加液体积为2.0 mL。
3.6 滴定剂最大增量的选择
滴定剂最大增量的选择关系到滴定过程的消耗时间和滴定终点判定的准确度,实验考察了最大增量对实验时间和滴定终点的影响,标准镀液中氯化锌含量为60.00 g/L,数据见表1所示。表中相对误差按照公式(3)计算。结果表明,随着最大增量的增大,测定结果的相对误差有所增大。在确保准确性的基础上,为了缩短滴定时间,本实验选择0.2 mL为滴定剂的最大增量。

表1 最大增量对滴定时间及滴定终点的影响Tab.1 The effect of maximum increment on titration time and end point

式(3)中:氯化锌标准值为60.00 g/L。
3.7 滴定剂最小增量的选择
实验考察了滴定剂的最小增量对于滴定时间及滴定终点的影响,标准镀液中氯化锌含量为60.00 g/L,如表2所示。随着最小增量的增加,滴定终点变化不大。因此,为了提高滴定效率,本实验最终选择0.02 mL为滴定剂的最小增量。
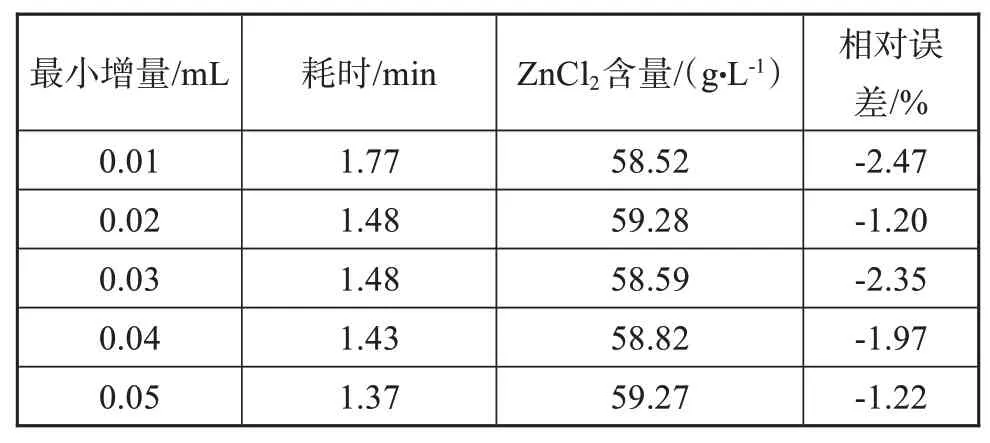
表2 最小增量对滴定时间及滴定终点的影响Tab.2 The effect of minimum increment on titration time and end point
3.8 pH=10缓冲溶液加入量的选择
在络合滴定中,体系的酸度对测定结果影响很大[8]。一般选择的缓冲体系是氨性缓冲液,氨水用量增加虽可增大体系pH,但同时也会增大Zn2+的副反应。因此,氨水用量控制不当,则达不到准确滴定的目的。
本实验考察了不同体积缓冲液的加入对终点时电位突跃的影响。如图2所示,随着加入的缓冲液体积的增加,电位突跃减小,但当缓冲液加入量小于2 mL时,溶液中产生氢氧化锌沉淀,导致溶液浑浊。本实验选择缓冲液加入量为3.0 mL。

图2 pH=10缓冲溶液加入量对电位突跃的影响Fig.2 The effect of the amount of pH=10 buffer agent on potential jump
3.9 Ca-EDTA加入量的选择
Ca-EDTA作为置换剂加入滴定溶液中,可显著提高电位滴定终点时的电位突跃。实验考察了0.05 mol/L Ca-EDTA溶液的加入量对滴定结果及等当点时ΔE/ΔV值的影响,标准镀液中氯化锌含量为60.00 g/L,如表3中数据所示。随着加入反应烧杯中的Ca-EDTA量的增大,终点时ΔE/ΔV数值增大,对氯化锌测量结果无影响。本实验选择Ca-EDTA加入量为3.0 mL。

表3 Ca-EDTA加入量对滴定终点的影响Tab.3 The effect of the amout of Ca-EDTA solution on titration end point
3.10 分析准确度和精密度
实验对配制的标准镀液和电镀生产线正在使用的两种镀液分别重复测定11次,标准镀液中氯化锌含量为60.00 g/L,实验结果如表4所示。由表中数据可知,标准镀液11次测定的相对标准偏差为0.22 %。两种镀液样品11次重复分析的相对标准偏差均不高于0.3%。实验证实,该实验方法准确度高和精密度良好,满足日常镀液分析要求。
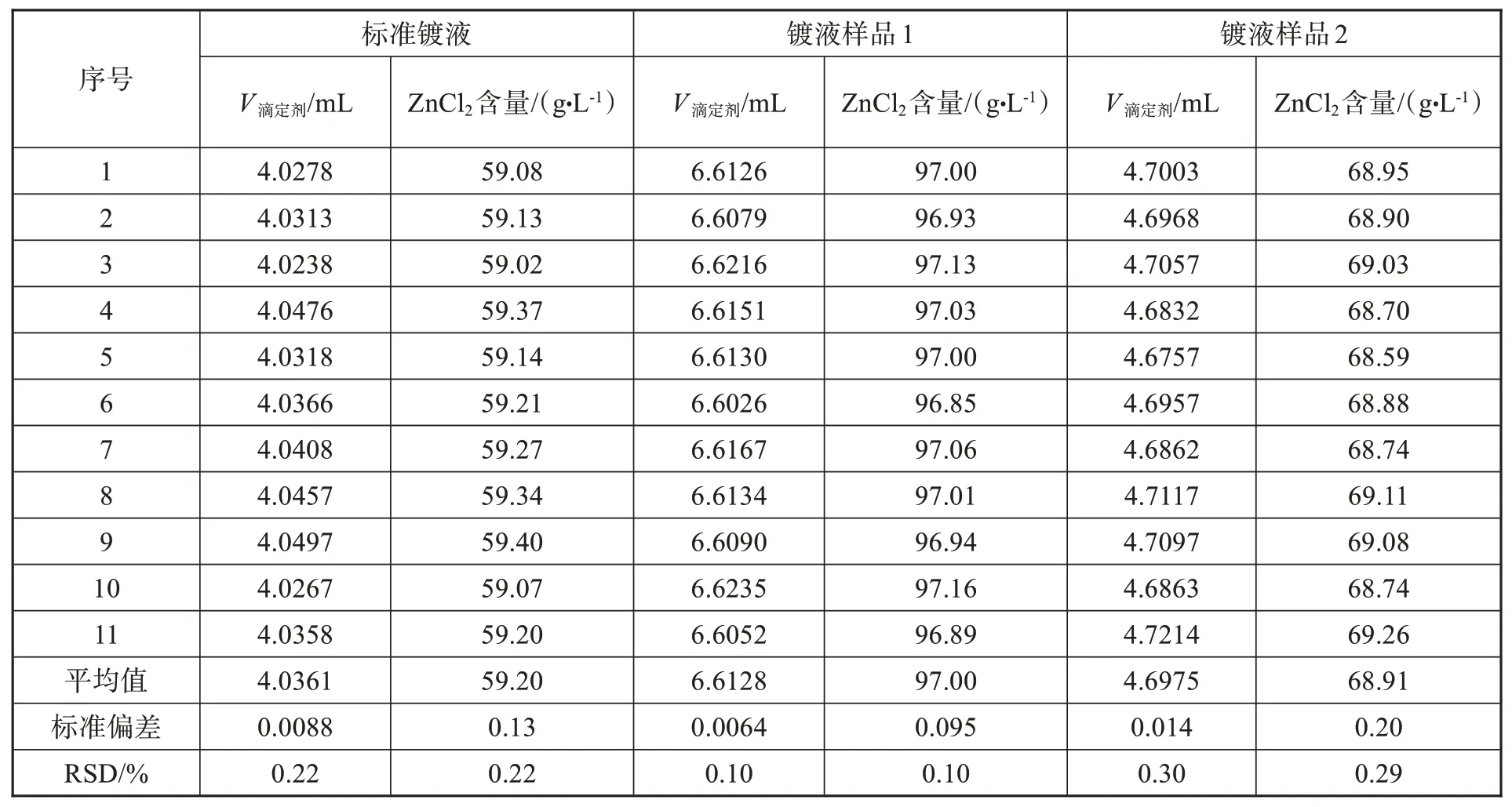
表4 镀液样品分析结果Tab.4 The test results of electroplating solution
3.11 实验结果比对
为了验证本实验方法测定结果的准确性,对已知浓度的标准镀液(氯化锌含量为60.00 g/L)分别采用自动电位滴定法和手动滴定法[8]进行测定,实验数据如表5所示。
由表5中数据可知,以上两种测试方法测量结果一致,测量结果准确可靠。

表5 两种测试方法比对结果Tab.5 Test results of two methods
4 结论
本实验用自动电位滴定仪测定了酸性镀锌溶液中氯化锌的浓度。通过实验确定了指示电极种类、滴定剂的预加体积、最大增量和最小增量等实验条件。采用钙离子电极为指示电极,双盐桥甘汞电极为参比电极,pH缓冲液调节溶液pH,Ca-EDTA作为置换剂,实现了酸性镀锌溶液中氯化锌含量的自动滴定。改进了传统的手动滴定法,避免了因目视法颜色判定不准确导致的测量误差。同时,通过钙离子电极与铜离子电极选择实验,确定采用钙离子电极作为指示电极,避免了铜离子电极因长期使用导致的电极电位下降,电位突跃不明显等问题。通过精密度实验和两种测量方法(自动电位滴定法和手动滴定法)测定结果比对实验证实,本方法具有简便、快速、准确以及精密度良好的优点,可用于日常酸性镀锌溶液中氯化锌含量的分析及监测。
