玉屏风散对变应性鼻炎模型小鼠肥大细胞成熟及活化的影响
2021-08-24陆越悦何晗昳滕尧树金卫东
陆越悦 何晗昳 滕尧树 金卫东
变应性鼻炎(allergic rhinitis,AR)是机体暴露于变应原后主要由免疫球蛋白E(IgE)介导的鼻黏膜非感染性慢性炎症,已成为主要的呼吸道慢性炎症疾病。流行病学调查显示,全球AR 患者人数超过5亿,患病率为10%~25%[1]。肥大细胞能产生Th2 型细胞因子,诱导B 细胞IgE 合成,并能通过肥大细胞-IgE-高亲和力受体(FcεRI)级联自我激活,在AR 的发病中起着重要作用[2]。研究表明,玉屏风散具有广泛的免疫调节作用,调控包括肥大细胞在内的多种免疫细胞,被广泛用于治疗支气管哮喘、AR 及呼吸道反复感染等疾病,但其药物作用机制复杂,目前尚不完全清楚[3-4]。本研究通过玉屏风散干预卵白蛋白(ovalbumin,OVA)制备的AR 模型,探索玉屏风散对AR 小鼠肥大细胞分化、成熟及活化的影响。
1 实验材料
1.1 动 物 BALB/c 近交系小鼠30 只,雄性,8~10周龄,体质量约25.0g,SPF 级。购自上海斯莱克实验动物有限公司,实验动物生产许可证号:SCXK(沪)2017-0005,合格证号:20170005036437。饲养环境:温度范围20~25℃,相对湿度范围40%~70%。饮用水为灭菌二级超纯水。实验动物使用许可证号为SYXK(浙)2015-0008。本实验通过实验动物伦理审批(审批编号:HB201601208)。
1.2 玉屏风散配置 按《中华人民共和国药典》的标准配置玉屏风散[5]。取黄芪300g,白术、防风各100g(比例3∶1∶1),加水3000mL(按每克生药加水6mL),冷水浸泡30min,煮沸后再文火慢煎40min,趁热过滤,滤液自然滴尽;二煎加水2000mL(按每克生药加水4mL),煮沸后,文火慢煎40min,趁热过滤滤液,自然滴尽。混合2 次滤液,浓缩配成1.0g/mL 的玉屏风散水煎液,置4℃冰箱备用。
1.3 主要试剂 OVA(美国Sigma 公司,批号SLBQ 9036V),氢氧化铝Al(OH)3(上海凌峰化学试剂有限公司,批号20120629),组胺酶联免疫吸附试验(ELISA)检测试剂盒(上海江莱生物科技有限公司,批号JL10420),白介素-13(IL-13)ELISA 检测试剂盒(北京索莱宝科技有限公司,批号SEKM-0014),甲苯胺蓝染色试剂盒(北京索莱宝科技有限公司,批号G3663),兔抗小鼠类胰蛋白酶单克隆抗体(美国Abcam 公司,批号ab151757),酶标山羊抗兔IgG 二抗(北京中杉金桥生物技术有限公司,批号PV-6001),Anti-mouse CD117-FITC 抗体(美国Biolegend 公司,批号105816),Anti-mouseFcεRI-APC 抗体(美国Biolegend 公司,批号134316),红细胞裂解液(杭州联科生物技术有限公司,批号MR0504-500)。
2 实验方法
2.1 分组及造模 将30 只BALB/c 近交系小鼠适应性饲养1 周后,按随机数字表法分为正常对照组、AR 模型组和玉屏风散组,每组10 只。致敏阶段:AR模型组和玉屏风散组均于第0、7、14 天腹腔注射OVA(25μg)+Al(OH)3(1mg)混悬液0.2mL,正常对照组按上述方法腹腔注射生理盐水0.2mL。激发阶段:从第21~27 天(共连续7 天)分别对AR 模型组和玉屏风散组用OVA(25mg/mL)进行滴鼻激发,每天1次,每次20μL,正常对照组则用等量生理盐水滴鼻。玉屏风散干预阶段:玉屏风散组于激发前1 天开始用玉屏风散水煎剂灌胃(25g·kg-1·d-1)治疗,连续8天,正常对照组和AR 模型组则用等量生理盐水灌胃。
2.2 行为学观察 末次激发后,观察15min 内小鼠喷嚏、挠鼻和流涕,并进行评分,采用叠加量化记分法计算总分,从而评估各组AR 发病率及严重程度,评分标准见表1[6]。

表1 小鼠鼻部症状评分标准
2.3 ELISA 检测血浆组胺和IL-13 水平 末次激发后24h,摘除小鼠眼球取血,置于肝素抗凝管中,室温下静置1h,离心(离心半径13.49cm,转速3500r/min)10min,取上清为待测血浆。按照ELISA 检测试剂盒说明书测定血浆组胺和IL-13 水平。
2.4 甲苯胺蓝染色检测鼻黏膜肥大细胞浸润 末次激发后24h,将小鼠脱颈椎处死,取下含鼻腔的小鼠头部,用4%多聚甲醛4.0℃固定24h,然后用10%EDTA 缓冲液脱钙28 天,隔日换液,最后将标本进行石蜡包埋、切片。根据试剂盒说明书进行甲苯胺蓝染色10~15min,0.5%冰乙酸分化,直到细胞核和颗粒清晰可见。计数3 个高倍镜下鼻黏膜组织切片中肥大细胞数量的平均值,评估肥大细胞浸润情况。
2.5 免疫组织化学染色检测鼻黏膜类胰蛋白酶表达将鼻腔组织的石蜡切片脱蜡水化,经高压修复抗原后加兔抗小鼠类胰蛋白酶单克隆抗体,4℃孵育过夜,用酶标山羊抗兔IgG 二抗37℃孵育30min,DBA显色,苏木素复染。每组随机取3 个视野,用Image-Pro Plus 测量样本免疫组化阳性表达平均光密度值。
2.6 流式细胞仪检测骨髓细胞表面标志物CD117、FcεRI 表达 末次激发后24h,取小鼠股骨和胫骨,以1mL 注射器针头反复冲洗骨髓腔,收集细胞悬液,200 目筛网过滤,获取单细胞悬液,离心(离心半径14cm,转速1000r/min)5min,获取细胞沉淀,加入3mL 红细胞裂解液重选细胞,室温裂红5min,离心5min,弃去上清,每支离心管再加入2mL 红细胞裂解液;离心5min,弃去上清,1mL 1640 培养基重悬骨髓细胞。按操作说明书加入Anti-mouse CD117-FITC抗体和Anti-mouse FcεRI-APC 抗体,4℃避光孵育30min。使用流式细胞仪检测CD117 和FcεRI 双阳性细胞。
2.7 统计学方法 应用SPSS 16.0 软件进行统计分析。计量资料以均数±标准差()表示,多组间差异比较采用单因素方差分析,组间两两采用Bonferroni法。P<0.05 表示差异有统计学意义。
3 结果
3.1 玉屏风散对AR 模型小鼠挠鼻和喷嚏的影响与正常对照组比较,AR 模型组小鼠的挠鼻、喷嚏及流清涕评分和鼻部症状总评分均显著增加(P<0.05);与AR 模型组比较,玉屏风散组可明显改善小鼠的挠鼻、喷嚏及流清涕评分和鼻部症状总评分,差异有统计学意义(P<0.05)。见表2。
表2 各组小鼠AR 鼻部症状评分比较(分,)
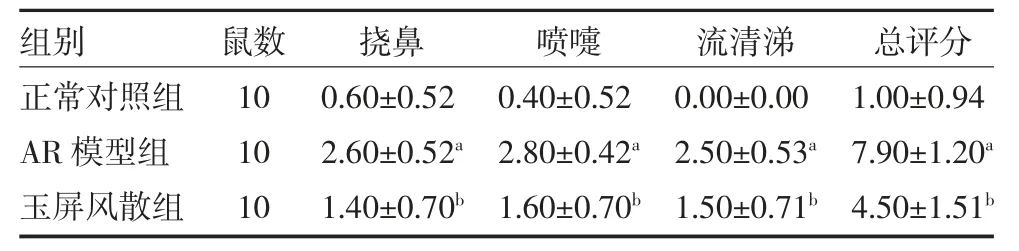
表2 各组小鼠AR 鼻部症状评分比较(分,)
注:正常对照组及AR 模型组给予等量生理盐水灌胃;玉屏风散组给予玉屏风散水煎剂(25g·kg-1·d-1)灌胃;AR 为变态性鼻炎;与正常对照组比较,aP<0.05;与AR 模型组比较,bP<0.05
3.2 玉屏风散对AR 模型小鼠血浆组胺和IL-13 水平的影响 与正常对照组比较,AR 模型组小鼠血浆组胺和IL-13 水平显著增加(P<0.05);与AR 模型组比较,玉屏风散组可明显降低小鼠血浆中组胺和IL-13 的水平,差异有统计学意义(P<0.05)。见表3。
表3 各组小鼠血浆组胺和IL-13 水平比较()

表3 各组小鼠血浆组胺和IL-13 水平比较()
注:正常对照组及AR 模型组给予等量生理盐水灌胃;玉屏风散组给予玉屏风散水煎剂(25g·kg-1·d-1)灌胃;AR 为变态性鼻炎;IL-13 为白介素-13;与正常对照组比较,aP<0.05;与AR 模型组比较,bP<0.05
3.3 玉屏风散对AR 模型小鼠鼻黏膜组织肥大细胞浸润的影响 各组小鼠鼻黏膜组织经甲苯胺蓝染色,肥大细胞呈蓝紫色。与正常对照组比较,AR 模型组鼻黏膜组织中肥大细胞数量增加,差异有统计学意义(P<0.05);与AR 模型组比较,玉屏风散组鼻黏膜组织肥大细胞数量则显著降低(P<0.05)。见表4,图1。
表4 各组小鼠鼻黏膜组织肥大细胞数量及类胰蛋白酶表达比较()

表4 各组小鼠鼻黏膜组织肥大细胞数量及类胰蛋白酶表达比较()
注:正常对照组及AR 模型组给予等量生理盐水灌胃;玉屏风散组给予玉屏风散水煎剂(25g·kg-1·d-1)灌胃;AR 为变态性鼻炎;与正常对照组比较,aP<0.05;与AR 模型组比较,bP<0.05

图1 各组小鼠鼻黏膜组织甲苯胺蓝染色(×400)
3.4 玉屏风散对AR 模型小鼠鼻黏膜组织类胰蛋白酶表达的影响 与正常对照组比较,AR 模型组鼻黏膜组织中类胰蛋白酶表达水平显著增高,差异有统计学意义(P<0.05);与AR 模型组比较,玉屏风散组鼻黏膜组织中类胰蛋白酶表达水平则显著降低(P<0.05)。见表4,图2。

图2 各组小鼠鼻黏膜组织中类胰蛋白酶免疫组化染色(×200)
3.5 玉屏风散对AR 模型小鼠骨髓细胞表达CD117和FcεRI 的影响 各组小鼠骨髓细胞经流式细胞仪检测发现,与正常对照组比较,AR 组小鼠骨髓CD117和FcεRI 双阳性细胞比例明显增高,差异有统计学意义(P<0.05);与AR 模型组比较,玉屏风散组小鼠骨髓中CD117 和FcεRI 双阳性细胞比例则显著降低(P<0.05)。见表5,图3。

图3 流式细胞仪检测各组小鼠骨髓细胞中CD117 和FcεRI 双阳性细胞比例
表5 各组小鼠骨髓细胞CD117 和FcεRI 双阳性细胞比例比较(%,)
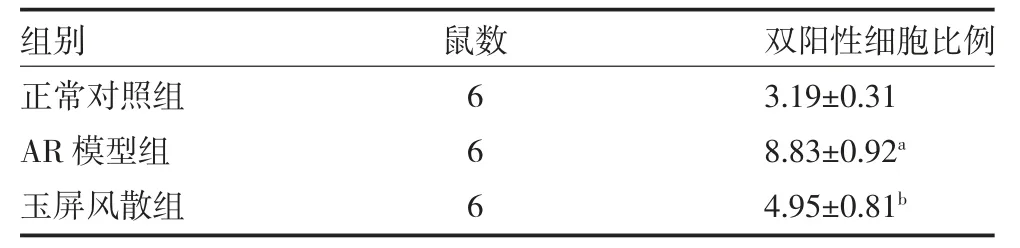
表5 各组小鼠骨髓细胞CD117 和FcεRI 双阳性细胞比例比较(%,)
注:正常对照组及AR 模型组给予等量生理盐水灌胃;玉屏风散组给予玉屏风散水煎剂(25g·kg-1·d-1)灌胃;AR 为变态性鼻炎;CD117 为特异性受体;FcεRI 为肥大细胞-IgE-高亲和力受体;与正常对照组比较,aP<0.05;与AR 模型组比较,bP<0.05
4 讨论
AR 是以特应性个体接触致敏原后经IgE 介导的肥大细胞脱颗粒为开端的,多种免疫细胞和细胞因子参与的鼻黏膜Ⅰ型变态反应,肥大细胞源自CD34+骨髓前体细胞,干细胞因子能与特异性受体(CD117)结合,使上述前体细胞分化为肥大细胞。特应性个体吸入变应原,经气道黏膜中的抗原提呈细胞识别,提呈给T 淋巴细胞,促使Th0 向Th2 转换,Th2 通过分泌IL-4、IL-5、IL-13 等炎性因子,促进气道变应性炎症的发生、发展,并诱导变应原特异性B细胞增殖、分化以及合成特异性IgE,与聚集在鼻黏膜组织中成熟肥大细胞表面FcεRI 相结合[7-8]。当机体再次接触相同变应原时,变应原与锚定在肥大细胞表面的IgE 分子交联,活化肥大细胞,导致组胺等预贮存在肥大细胞颗粒物中的炎性介质释放,引起速发相反应;肥大细胞还能分泌白三烯等细胞炎性因子,诱导血管内皮细胞、上皮细胞等分泌黏附分子、趋化因子及细胞因子等,募集和活化嗜酸粒细胞及Th2 细胞等免疫细胞,参与迟发相反应[2,9-10]。因此,肥大细胞作为AR 的重要效应细胞,调控其分化、成熟及活化过程,对于抑制AR 速发相和迟发相反应具有重要价值。
AR 归属中医“鼻鼽”范畴。中医认为,AR 患者的临床发病往往属于虚证,其中肺气虚型患者最为常见。玉屏风散组方中的黄芪能滋补肺脾之气,固表止汗;白术益气健脾,防风祛风御邪,全方共奏益气实卫之功效[11]。研究表明,玉屏风能优化机体内T 淋巴细胞亚群分布比例,继而调节细胞免疫和体液免疫的功能,已广泛用于AR、支气管哮喘、呼吸道感染性疾病以及慢性阻塞性肺疾病[3,12]。玉屏风散能使AR大鼠鼻黏膜嗜酸性粒细胞趋化因子和调节激活正常T 细胞表达和分泌因子表达降低,减少AR 大鼠鼻黏膜中嗜酸性粒细胞的浸润,从而减轻鼻黏膜的变应性炎症[13]。
肥大细胞脱颗粒是肥大细胞区别于其他细胞的一种特异性功能状态,为Ⅰ型变态反应中肥大细胞活化的重要标志。组胺、类胰蛋白酶、β 己糖胺酶常被用作定量测定肥大细胞脱颗粒水平的生物标志物[14-15]。CD117 和FcεRI 的表达水平可以用来分析肥大细胞的成熟度和纯度[16-17]。本研究结果显示,玉屏风散可明显改善AR 模型小鼠的鼻部症状,减轻其鼻黏膜组织肥大细胞浸润,降低鼻黏膜组织中类胰蛋白酶表达、血浆组胺和IL-13 水平,以及骨髓细胞CD117 和FcεRI 双阳细胞的比例等提示肥大细胞成熟和活化的指标。因此,我们认为,玉屏风散不仅能抑制肥大细胞的分化、成熟及组织浸润,也能通过降低肥大细胞脱颗粒及炎性因子分泌水平达到抑制肥大细胞活化的目的,从而改善AR 的鼻部症状。但其具体机制及相关信号通路尚不明确,有待细胞实验及进一步动物实验验证。
综上所述,玉屏风散对AR 具有良好的治疗作用,其作用机制可能与调控肥大细胞的分化、成熟以及脱颗粒和分泌细胞因子水平有关。
