广枣总黄酮对三氧化二砷诱导心肌细胞损伤的作用
2021-08-23杨秀华肖云峰
杨秀华 智 慧 艾 丹 肖云峰
1.呼伦贝尔职业技术学院蒙医蒙药系,内蒙古呼伦贝尔 021000;2.内蒙古医科大学药学院,内蒙古呼和浩特 010110
三氧化二砷(arsenic trioxide,ATO)俗称砒霜,是最古老的毒药之一,外用杀虫去腐,内服截痰平喘,攻毒抑癌[1],也被用于治疗结核、银屑病、梅毒等疾病[2],现用于急性早幼粒细胞白血病(acute promyelocytic leukemia,APL)的治疗[3-4],对乳腺癌[5-6]、肝癌[7-9]、胃癌[10]等恶性肿瘤也可发挥较好的效果,应用前景良好[11-12]。但是,ATO 属于剧毒药物,在治疗肿瘤的过程中所引起的心脏毒性,限制其在临床上的广泛应用。长期使用可致Q-T 间期延长[13]、尖端扭转型室速[14]、甚至心源性猝死[15-17]。因此,如何减少ATO 在应用过程中产生的心脏毒性,是现代药理学研究的重点内容之一。广枣是漆树科植物南酸枣的成熟果实,为蒙医常用药材,在治疗心血管疾病的药方中,半数以上是以广枣为主药或是配伍有广枣[18]。广枣总黄酮(total flavnoids of fructus choerospondiatis,TFFC)是广枣治疗心血管系统疾病的主要活性成分,具有抗心律失常[19-20]、增强免疫力[21]、改善心肌缺血[22-23]等作用,可以清除心肌缺血时产生的大量氧自由基[24-25],保护心肌免受严重损伤。本研究深入的探讨蒙药广枣对ATO 诱导心肌损伤的作用,为TFFC 减轻ATO 产生的心肌损伤提供重要的实验依据。
1 材料与方法
1.1 材料
CCK-8 试剂盒(武汉博士德生物工程有限公司,13H30C60);Hoechst 染色试剂(上海碧云天公司,051618180905);倒置生物显微镜(德国Leica 公司,DM3000);CO2培养箱(美国Thermo Fisher Scientific 公司);全自动生化分析仪(爱尔兰apphire 公司,Multiskan MK3);流式细胞仪(美国Merck 公司,guava easyCyte);健康清洁级Wistar 乳鼠25 只(雌雄不限,1~3 d,5~9 g)购自内蒙古医科大学实验动物中心,实验动物生产许可证编号:SCXK(蒙)2015-0001,饲养于内蒙古医科大学动物实验中心(温度20~26℃,湿度40%~70%),动物饮水为无菌水,每天定时喂食,每隔2 d 更换1次垫料。所有动物实验经过内蒙古医科大学动物管理协会批准进行,符合内蒙古医科大学伦理委员会动物实验相关要求。
1.2 原代乳鼠心肌细胞的培养与分离
在无菌条件下取新生Wistar 乳鼠的心尖组织,置PBS 液清洗,移至0.1%胰酶中,剪碎,加入6 ml 0.1%胰酶消化6 min,静置后弃上清。再加入5 ml 混酶,消化5 min,静置后吸上清转移至玻璃瓶中,加入5 ml 10%FBS 的培养基终止消化,重复10 次。1000 r/min(r=13.5 cm)离心10 min,弃上清,用20%FBS 的培养基重悬,置培养箱内培养60 min,转移至新培养瓶,继续培养48 h 后进行后续实验[26]。
1.3 心肌细胞形态学观察
在倒置显微镜下观察培养0、12、24、48、72 h 以及7 d 的心肌细胞的生长情况与细胞的形态。
1.4 细胞分组及处理
实验设置空白组、模型组(ATO 6 μg/ml)、TFFC高浓度组(TFFC 100 μg/ml+ATO 6 μg/ml)、TFFC 中浓度组(TFFC 50 μg/ml+ATO 6 μg/ml)、TFFC 低浓度组(TFFC 25 μg/ml+ATO 6 μg/ml)。空白组加入无血清DMEM/F12 培养基培养12 h 后换用无血清DMEM/F12 培养基培养12 h;模型组加入无血清DMEM/F12 培养基培养12 h 后换用终浓度为6 μg/ml ATO 培养基培养12 h;TFFC 低、中、高浓度组分别加入终浓度为25、50 μg/ml 和100 μg/ml TFFC 培养基培养12 h 后换用终浓度为6 μg/ml ATO 培养基培养12 h。
1.5 CCK-8 法检测细胞存活率
按“1.4”分组处理后,每孔加入10 μl CCK-8 试剂,培养1 h,于酶标仪450 nm 处测量吸收度值,计算存活率,实验重复6 次,取平均值。
1.6 各心肌酶及抗氧化酶检测
培养液中谷草转氨酶(glutamic oxaloacetic transaminase,GOT)、磷酸肌酸激酶(creatine kinase,CK)、乳酸脱氢酶(lactic dehydrogenase,LDH)活力的检测:按“1.4”分组处理后,采用全自动生化分析仪检测,重复6 次,取平均值。
细胞中超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、过氧化氢酶(catalase,CAT)活力的检测:按“1.4”分组处理后,严格按照试剂盒说明书进行检测,重复6 次,取平均值。
1.7 细胞凋亡的测定
1.7.1 Hoechst 33342 染色观察心肌细胞凋亡水平按“1.4”分组处理后,弃培养液。加入Hoechst 33342染液250 μl,避光孵育30 min,使用荧光显微镜观察细胞凋亡情况。
1.7.2 Annexin V-FITC 细胞凋亡检测试剂盒检测心肌细胞凋亡率 按“1.4”分组处理后,用0.25%胰酶消化收集细胞,后续操作严格按照说明书进行,用流式细胞仪在1 h 内检测细胞凋亡率,实验重复3 次,取平均值。
1.8 统计学方法
采用Graphpad Prism8.0 软件和SPSS 22.0 软件进行数据统计分析。计量资料以均数±标准差()表示,多组比较采用方差分析,两组比较采用独立样本t检验。计数资料以例数表示。以P <0.05 为差异有统计学意义。
2 结果
2.1 心肌细胞形态学观察
刚分离纯化的细胞多为圆形,见图1A;培养12 h细胞已部分贴壁,多数仍为圆形,见图1B;培养24 h细胞大部分已贴壁,多数呈梭形、圆形,少数细胞有自发性搏动,见图1C;培养48 h 细胞基本都贴壁,大多数细胞伸出伪足伴有自发性搏动,见图1D,此时的细胞可用于后续实验;培养72 h 细胞形成细胞簇,成放射状排列,且同步搏动,见图1E;培养5~7 d 的细胞形成细胞层,搏动快而强且同步化,见图1F。
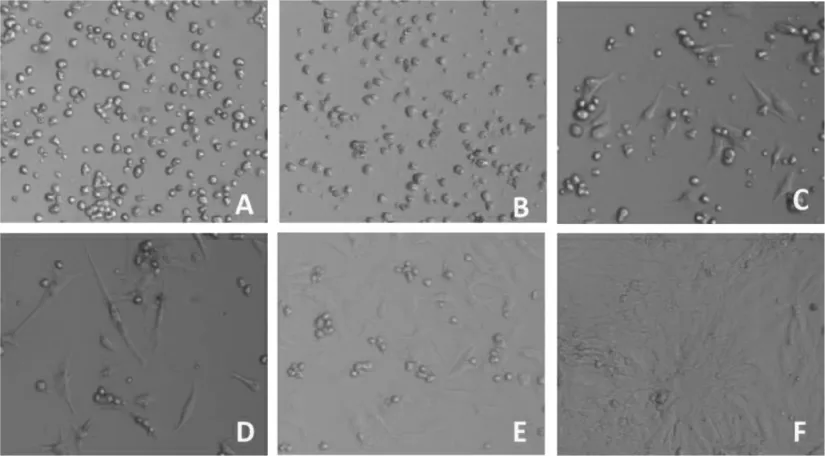
图1 倒置显微镜下心肌细胞的形态(100×)
2.2 CCK-8 法检测心肌细胞活力
与空白组比较,模型组细胞存活率显著下降,差异有高度统计学意义(P <0.05)。与模型组比较,TFFC 各浓度组细胞存活率显著升高,差异有高度统计学意义(P <0.05)。TFFC 中、高浓度组细胞存活率高于TFFC 低浓度组,且TFFC 高浓度组高于TFFC中浓度组,差异有统计学意义(P <0.05)。见图2。
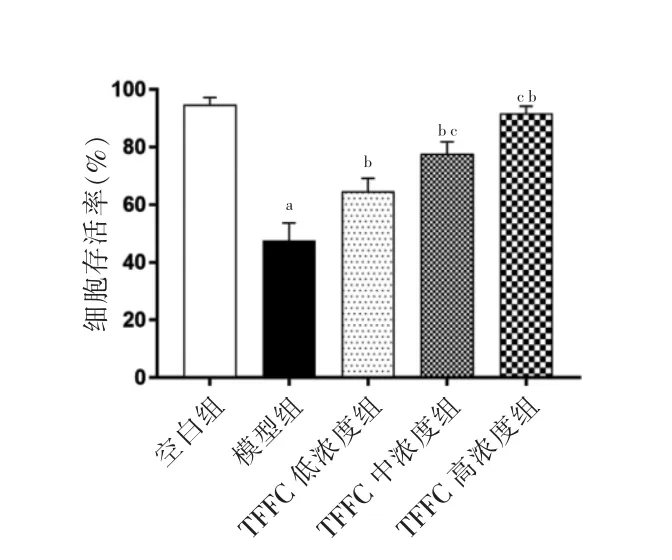
图2 TFFC 对ATO 诱导心肌损伤的保护作用(n=6)
2.3 TFFC 对心肌酶和抗氧化酶活力检测结果的影响
与空白组比较,模型组细胞培养液中GOT、CK 和LDH 的活力显著升高,心肌细胞中SOD、GSH-Px、CAT 活力显著降低,差异有统计学意义(P <0.05);与模型组比较,TFFC 各浓度组细胞培养液中GOT、CK和LDH 的活力均显著降低,心肌细胞中SOD、GSH-Px、CAT 活力显著升高,差异有统计学意义(P <0.05)。见表1~2。
表1 各组心肌细胞培养液中GOT、CK、LDH 比较(U/L,,n=6)
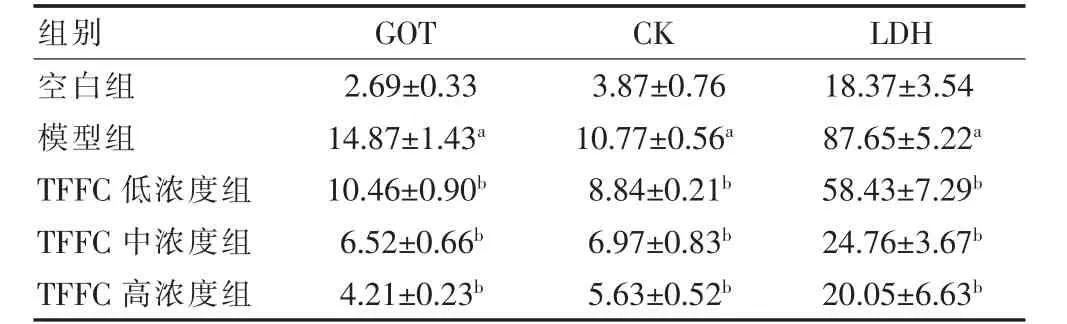
表1 各组心肌细胞培养液中GOT、CK、LDH 比较(U/L,,n=6)
注:与空白组比较,aP <0.05;与模型组比较,bP <0.05。TFFC:广枣总黄酮;GOT:谷草转氨酶;CK:磷酸肌酸激酶;LDH:乳酸脱氢酶
表2 各组细胞中SOD、GSH-Px、CAT 比较(,n=6)
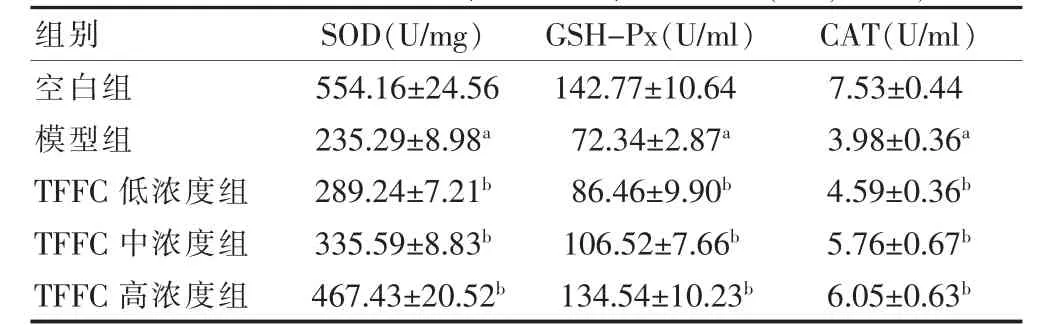
表2 各组细胞中SOD、GSH-Px、CAT 比较(,n=6)
注:与空白组比较,aP <0.05;与模型组比较,bP <0.05。TFFC:广枣总黄酮;SOD:超氧化物歧化酶;GSH-Px:谷胱甘肽过氧化物酶;CAT:过氧化氢酶
2.4 Hoechst 33342 染色观察心肌细胞凋亡形态
空白组心肌细胞呈均一核染,呈现均匀的低强度荧光,且未见核异常,见图3A;模型组细胞呈亮蓝色,凋亡细胞数目增多,见图3B;TFFC 低、中、高浓度组蓝色荧光强度明显减弱,见3C~E。
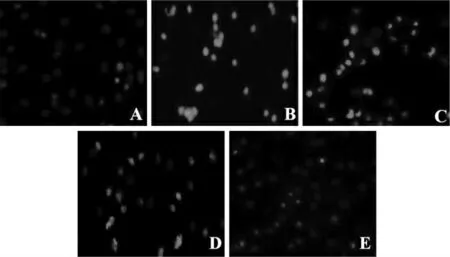
图3 Hoechst 染色观察心肌细胞凋亡形态(100×)
2.5 Annexin V-FITC 细胞凋亡检测试剂盒检测心肌细胞凋亡率
空白组仅有少部分细胞发生凋亡,见图4A;模型组凋亡细胞数目明显增加,见图4B;TFFC 各浓度组细胞的凋亡情况均不同程度得到改善。见图4C~E。与空白组比较,模型组细胞凋亡率显著增加,差异有统计学意义(P <0.05)。与模型组比较,TFFC 各浓度组细胞凋亡率均显著降低,差异有统计学意义(P <0.05)。TFFC 中、高浓度组细胞存活率低于TFFC 低浓度组,且TFFC 高浓度组低于TFFC 中浓度组,差异有统计学意义(P <0.05)。见图5。
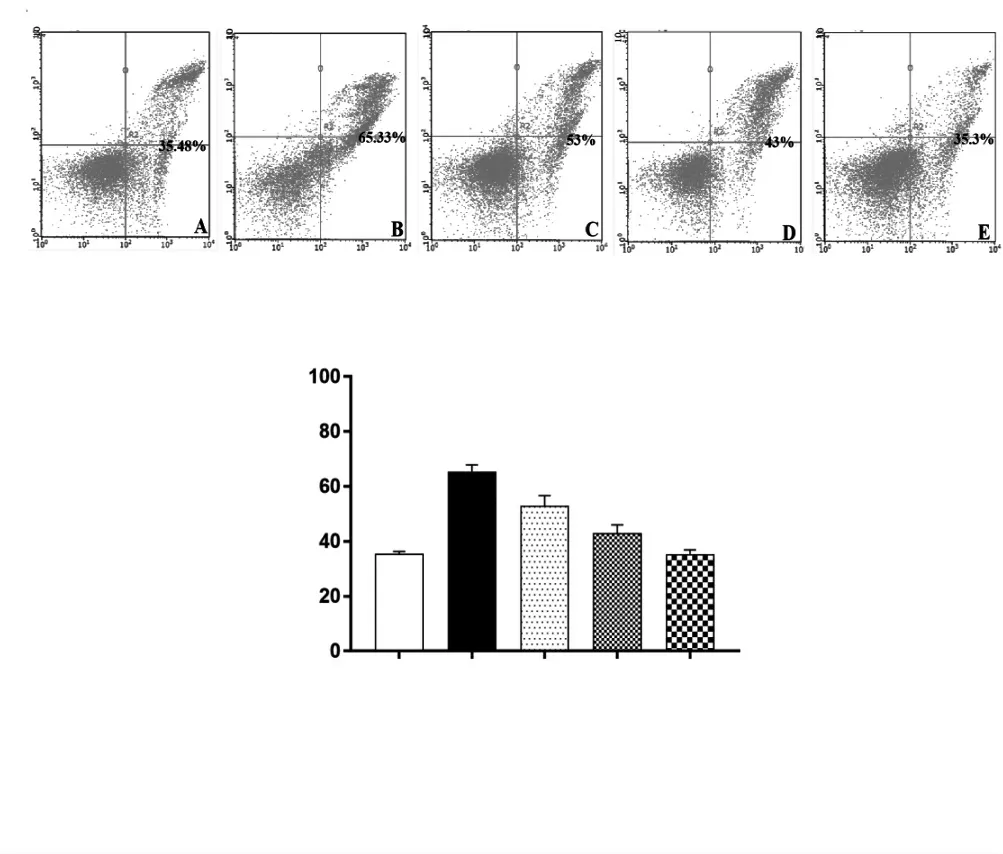
图4 流式细胞图
3 讨论
本研究在传统的原代心肌细胞培养基础上进行改良优化,从鼠龄、消化酶的种类、浓度、时间、程度及差速贴壁时间等多个方面进行考察,成功构建了良好的乳鼠原代心肌细胞的模型。利用6 μg/ml ATO 建立体外心肌氧化损伤模型,CCK-8 检测结果显示,ATO可显著降低心肌细胞的活力,而TFFC 各浓度组均可明显增加ATO 诱导状态下心肌细胞的活力。
评定心肌受损的重要标志之一是心肌酶表达水平的变化,临床上常以LDH、CK、GOT 活力升高作为判断心肌受损的诊断指标[27]。正常生理状态下,心肌细胞培养液中LDH、CK、GOT 的活力较低,而当心肌细胞膜受损时,心肌酶漏出量将显著增加。研究结果显示,TFFC 低、中、高浓度组均能够显著降低ATO 诱导的细胞培养液中LDH、CK 和GOT 活力,提示TFFC能够抑制受损细胞的LDH、CK、GOT 漏出,维护细胞膜的完整性,改善心肌的受损程度。CAT、GSH-Px 和SOD 是体内重要的抗氧化酶,是评估机体抗氧化防御体系功能的重要指标。CAT 可将过氧化氢分解为水和氧气,清除体内的过氧化氢,防止过量的过氧化氢对机体造成的损伤。GSH-Px 通过维持机体氧化与抗氧化平衡,而使细胞膜免受过氧化物的损伤。SOD 是重要的自由基清除剂,广泛存在于生物体的各组织中,可对抗和修复氧自由基对心肌组织所造成的损伤[28-29],本实验结果显示,TFFC 各浓度组心肌细胞中CAT、GSH-Px 和SOD 活力较ATO 模型组显著升高,提示ATO 抑制内在的保护性抗氧化能力来诱导心肌细胞的氧化应激,TFFC 具有较好的抗氧化作用,有利于减轻由ATO 诱导的心肌损伤。
心肌细胞凋亡是导致心肌损伤的重要发病机制之一。Hoechst 33342 荧光染色可以直观观察心肌细胞的凋亡状态,AV/PI 双染流式检测实验可以用来区分细胞的不同存活状态,定量检测心肌细胞的凋亡率。通过Hoechst 33342 荧光染色可知,模型组细胞呈亮蓝色,提示凋亡细胞数目较多,而TFFC 各浓度组蓝色荧光强度明显减弱,提示TFFC 可以改善心肌细胞凋亡状态。流式细胞仪检测细胞凋亡率可知,模型组凋亡细胞及坏死细胞数目较多,而TFFC 各浓度组可以显著降低凋亡率,对ATO 损伤的心肌细胞凋亡具有明显的抑制作用,课题组下一步将展开TFFC 调控具体凋亡基因的研究。
本研究认为TFFC 对ATO 诱导的心肌细胞损伤具有显著的保护作用。提示TFFC 与ATO 的组合可能有益于防止ATO 诱导的心脏毒性,TFFC 在心血管疾病的治疗中能够发挥重要作用。
