白术-苍术药对干预溃疡性结肠炎作用机制的网络药理学研究
2021-08-23戴明明程伟玲王春鹏林才志
戴明明 廖 丹 程伟玲 王春鹏 林才志
1.广西中医药大学研究生院,广西南宁 530000;2.广西中医药大学基础医学院,广西南宁 530000;3.广西中医药大学第一附属医院脾胃肝病科,广西南宁 530000
溃疡性结肠炎(ulcerative colitis,UC)是一种主要以结肠或直肠黏膜连续性、弥漫性的炎症改变为特征的慢性非特异性肠道炎症性疾病[1],主要的临床症状为腹泻、大便伴有黏液或脓血、腹痛等。病情往往反复迁延,治疗后容易复发,难以完全治愈,并存在一定的癌变风险[2]。UC 发病机制尚未完全明确,目前研究认为主要与遗传易感性、自身免疫、外在环境的刺激及肠道黏膜屏障损伤有较大关联[3]。因此,治疗方法以控制炎症、改善临床症状、减少复发为主[4],药物选择上主要选择使用水杨酸类、糖皮质激素类、免疫抑制剂类药物[5-6],但仍缺乏能够彻底治愈UC 的方法,且长时间药物治疗带来的不良反应一直困扰着医患双方[7]。
中医药治疗UC 是不可忽视的一种手段,UC 属中医“痢疾”“泄泻”等范畴。白术、苍术为中医治疗泻痢之要药,二者常作为药对配伍使用。现代药理学研究表明,二者的主要成分具有保护肠黏膜、抑制炎症、增强免疫力等药理作用,其水提物能纠正UC 大鼠模型的免疫紊乱,机制可能与其调节炎症因子白细胞介素(interleukin,IL)-2、IL-17 的作用有关[8-10]。但目前UC 的临床研究仍然多针对于近期疗效,机制研究相对较少[11]。本研究基于网络药理学探讨白术-苍术干预UC 的作用机制,为后续进一步研究提供参考依据。
1 材料与方法
1.1 白术-苍术药对主要化学成分研究
使用中药系统药理学数据库和分析平台(traditional Chinese medicine systems pharmacology database and analysis platform,TCMSP)与中药分子机制的生物信息学分析工具(bioinformatics analysis tool for molecular mechanism of traditional Chinese medicine,Batman-TCM)收集白术-苍术的主要化学成分,并使用PubChem 数据库来核对这些化合物的名称与分子结构。设置口服生物利用度(oral bioavailability,OB)≥30%[12]及类药性(drug likeness,DL)≥0.18 作为筛选的条件来筛选这些化合物。
1.2 苍术-白术药对的靶点预测和UC 靶点及苍术-白术药对治病靶点研究
通过Batman-TCM 分析平台,检索白术-苍术的主要化学成分可能作用靶点,靶点获取设置条件Prediction Score cutoff>20,利用Uniprot 数据库校正靶点名称。以“ulcerative colitis”为关键词在人类基因数据库GeneCards 检索并下载有关的基因。使用“Venny”将苍术-白术药对靶点与UC 作用靶点取交集。
1.3 药物-活性成分-靶点-疾病网络构建
使用Cytoscape 3.2.1 将上述的预测和筛选结果,构建“药物-活性成分-靶点-疾病”网络。
1.4 白术-苍术药对治病靶点蛋白质-蛋白质相互作用(proteinprotein ineraction,PPI)网络数据
通过String 数据库分别构建白术-苍术药对治病靶点PPI 网络图,并绘制PPI 网络中蛋白的条形图。
1.5 GO 功能和KEGG 通路富集分析
运用R 语言软件对“1.3”中的靶点蛋白进行GO功能富集分析与KEGG 通路富集分析。从富集分析来阐释白术-苍术药对生物学角度的科学内涵。
2 结果
2.1 白术-苍术药对主要成分及靶点
利用TCMSP 和Batman-TCM 收集白术-苍术的主要化学成分,经筛选后共获取16 个有效活性成分,其中白术7 个、苍术9 个。见表1。

表1 筛选出的白术-苍术主要成分与靶点
2.2 UC 相关基因
通过GeneCards 数据库共检索出4209 个UC 相关基因,与白术和苍术有效成分对应的靶基因取交集,得到259 个共同基因。见图1。
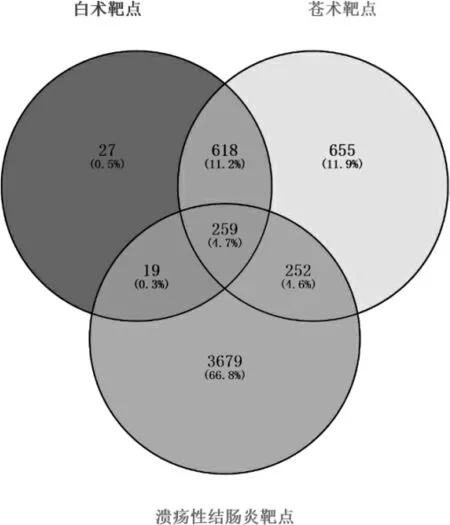
图1 药物成分靶点与疾病靶点韦恩图
2.3 构建药物-活性成分-靶点-疾病网络
运用Cytoscape 软件来构建网络,见图2,可见白术-苍术药对通过259 种共同有效成分作用于与UC相关的31 个靶点。图中八边形表示白术-苍术共同有效成分,圆形表示药物-UC 共同靶点。
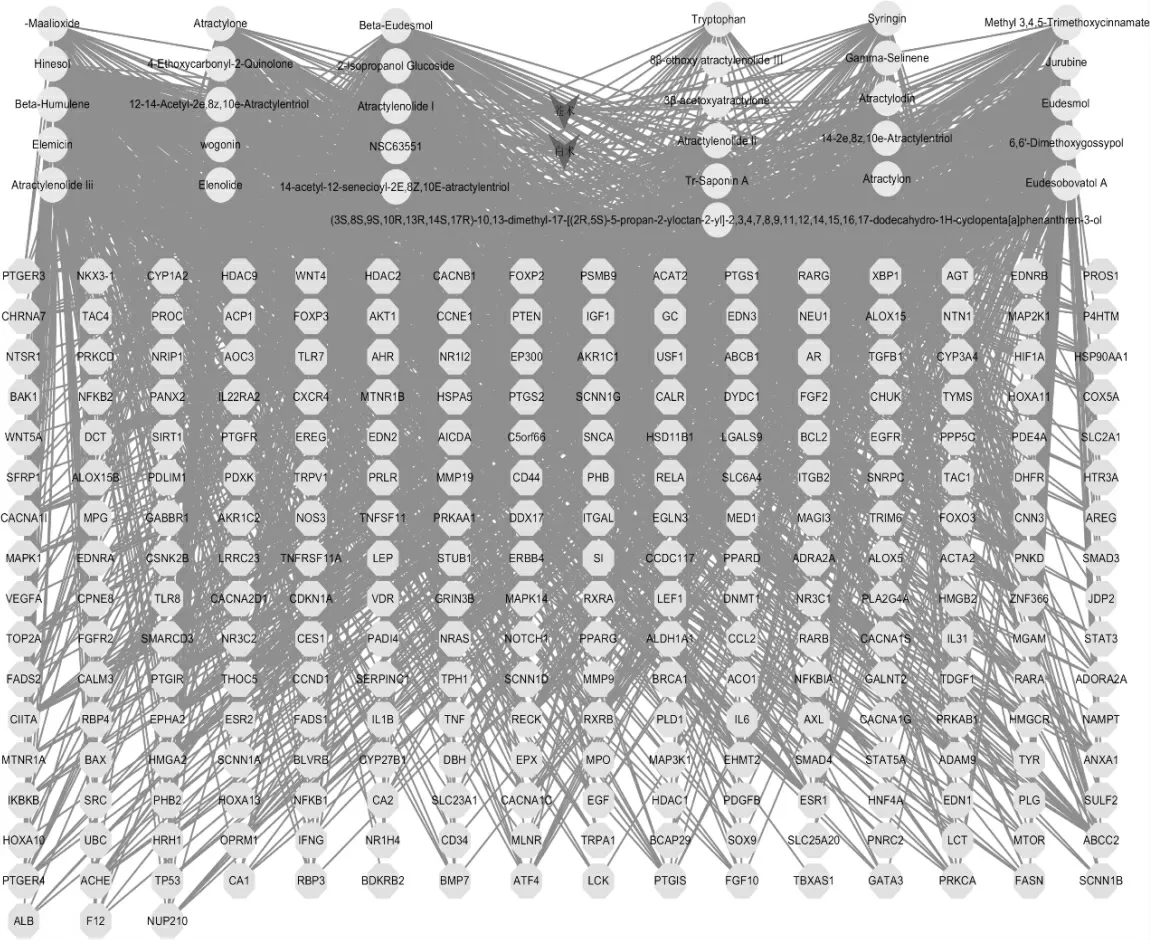
图2 药物-活性成分-靶点-疾病网络图
2.4 构建PPI 网络
把“2.3”中得到的共同靶点导入String 数据库里面,得到PPI 网络互作图,见图3,图中共含有31 个节点与1920 条边。图中的各个节点表示各基因蛋白,节点互相间的连接线代表所相接的2 个蛋白存在相互作用的关系,连接线越粗则代表这种关系越强。依据邻接节点数,选出居于前30 位靶点,见图4,左列是基因名,数字代表着相应基因邻接节点数目,例如,“MAPK1”邻接节点的数目为41。每个基因邻接的节点数目越多,则意味着其成为核心基因的概率就越大。分析出核心基因主要有E1A 结合蛋白P300(EP300)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、丝裂原活化蛋白激酶1(mitogen-activation protein kinase 1,MAPK1)等。
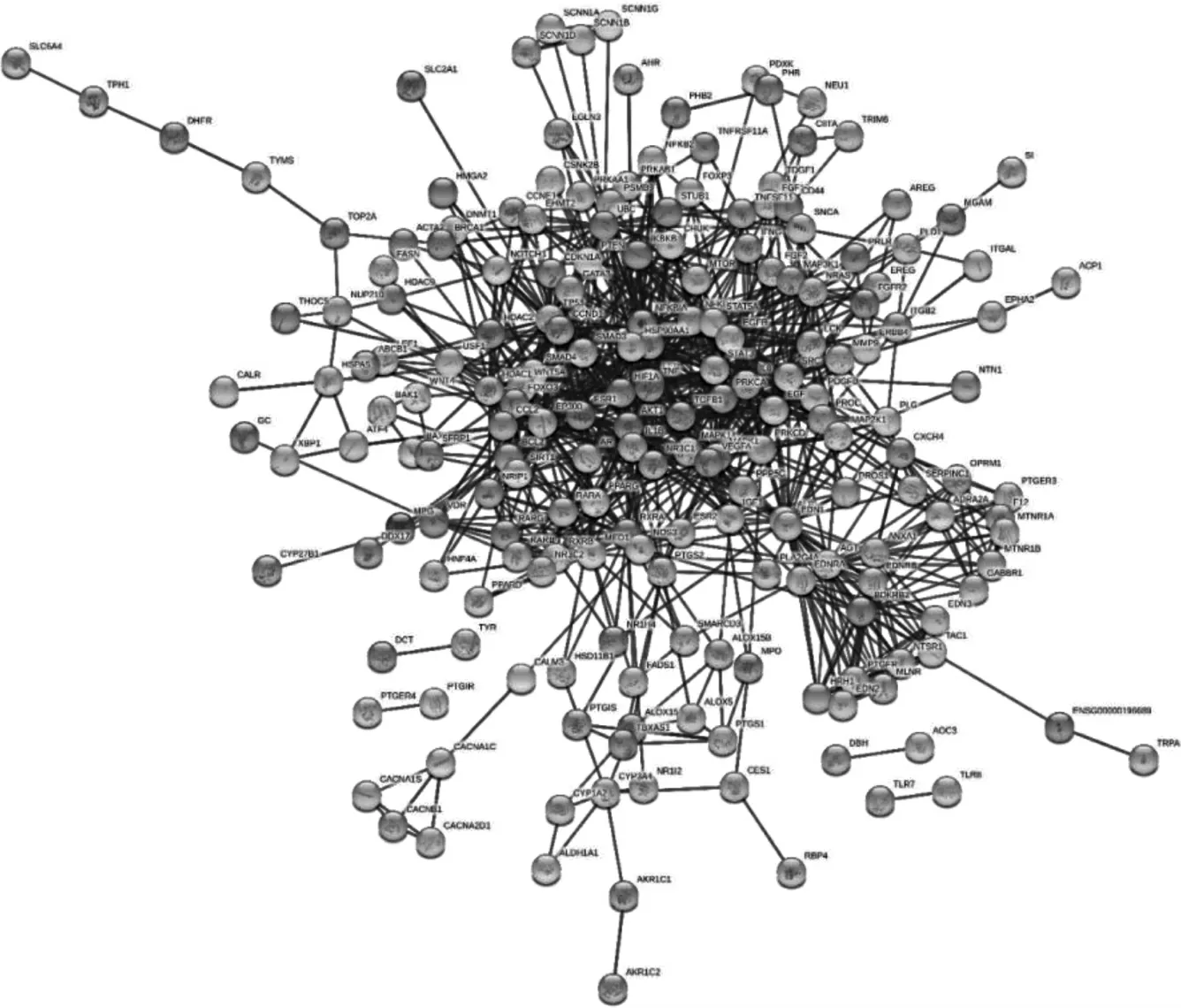
图3 白术-苍术药对治病靶点蛋白质-蛋白质相互作用网络图
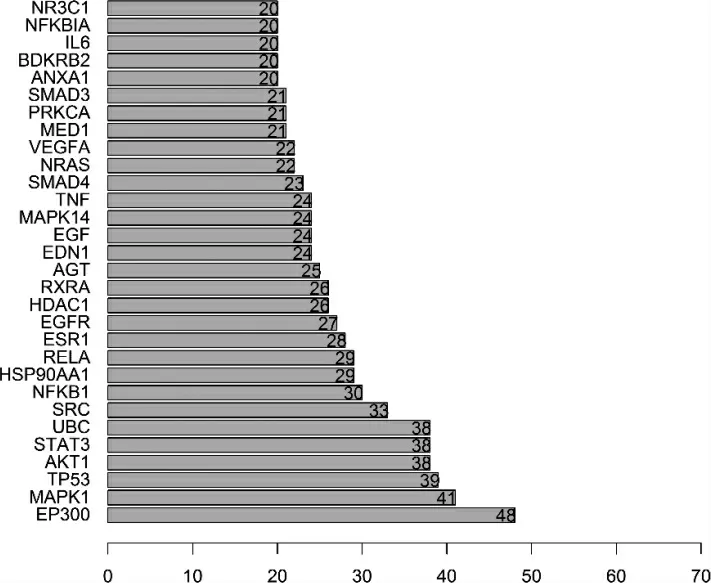
图4 筛选出的前30 位核心基因
2.5 关键靶基因GO 功能与KEGG 通路富集分析
利用R 语言软件进行GO 功能和KEGG 通路富集分析后,获得GO 条目1038 个,其中生物过程有829 个,细胞组分有59 个,分子功能有150 个。分别选取前20 位,富集情况见图5~7,主要涉及RNA 聚合酶Ⅱ启动子转录、调控DNA 模板转录、细胞增殖与凋亡的调节、细胞外信号调节激酶、细胞内质网膜、炎症反应、特异序列DNA 绑定、蛋白激酶结合、转录共激活因子活性等。KEGG 通路富集中(P <0.05)有122 条,选取前18 条通路,富集情况见图8。可见主要有PI3K/Akt 信号通路、缺氧诱导因子-1(hypoxia-inducible factor-1,HIF-1)信号通路、核因子κB(nuclear factor-κB,NF-κB)信号通路、人类嗜T 细胞病毒1 型(human T-cell lymphotropic virus-1,HTLV-1)、TNF 信号通路、MAPK 信号通路等。
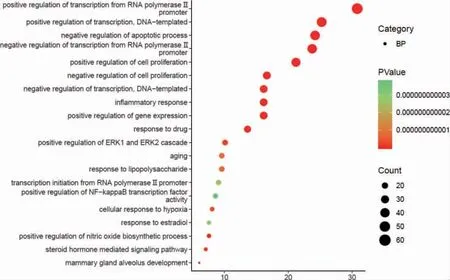
图5 GO(生物过程)富集气泡图
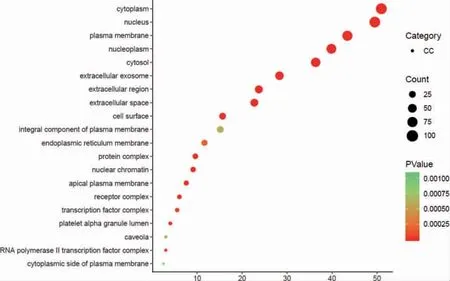
图6 GO(细胞组分)富集气泡图
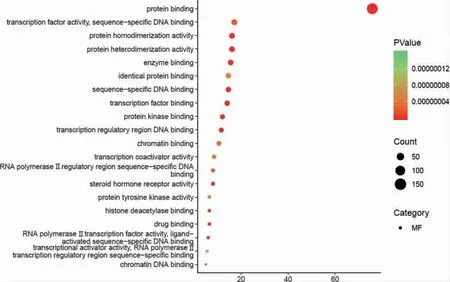
图7 GO(分子功能)富集气泡图
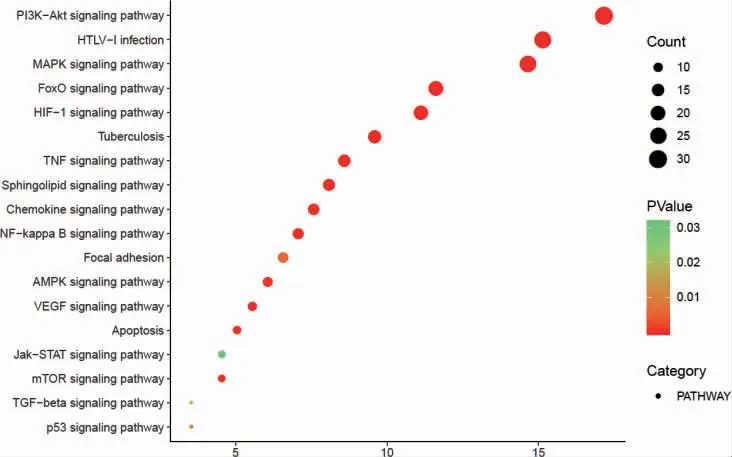
图8 KEGG 富集气泡图
3 讨论
UC 属于慢性非特异性炎症性肠病,相关炎症信号通路在特定条件刺激下被激活,从而引起肠黏膜炎症损伤。本文通过网络药理学分析得出EP300、TNF-α等核心基因在肠黏膜的炎症反应过程中有重要作用,NF-κB、MAPK、PI3K/Akt 等通路属于炎症信号通路,与UC 的发病有密切联系,具体阐述如下:
NF-κB 在UC 发病机制中的作用:研究表明,NF-κB 在调控与黏膜炎症反应相关的基因中起核心作用,在炎症信号刺激下,NF-κB 从细胞膜向细胞核转位,介导相关下游靶基因的释放,调控细胞坏死、凋亡与癌变等。正常情况下,介导NF-κB 通路的激活信号在T 细胞及其他大多数细胞类型中都是短暂的,主要刺激典型NF-κB 通路,但NF-κB 在HTLV-1 转化的T 细胞株和新近分离的T 细胞中均可被激活,导致HTLV-1 可对NF-κB 进行持续性激活[13],使得结肠黏膜持续性损伤,而阻断叉形头转录因子O 亚型3的表达,可使NF-κB 活性受到抑制,从而让结肠黏膜损伤得到缓解[14-15]。
NF-κB 与MAPK、PI3K/Akt 信号通路在UC 发病机制中的关系:巨噬细胞特异性表达激活了许多炎症反应链,包括Toll 样受体4(Toll-like receptor,TLR4)、PI3K/Akt 及其下游NF-κB 和MAPK 信号通路等。这些通路在调节UC 患者细胞因子释放和参与UC 肠道炎症和免疫反应中起着核心作用[16]。PI3K/Akt 信号通路在肠道通过大量的细胞因子介导异常炎症反应,其信号活化后,首要的功能就是激活NF-κB 并参与TNF-α、IL-1 等促炎性细胞因子释放,诱导UC 发病[17-18],而阻断PI3K/Akt 信号通路可以缓解结肠黏膜的损伤[19-20]。在炎症反应过程中,巨噬细胞中MAPK 的磷酸化对NF-κB 的激活和随后促炎症介质的释放至关重要[21]。阻断TLR4 及其下游的NF-κB/MAPK 通路,可降低TLR4、NF-κB、MAPK 信号相关蛋白的表达,同时下调体内炎症因子的释放,从而减轻UC 的炎症反应[22]。
核心基因EP300、TNF-α 与UC 发病的关联:P300 蛋白是一种多向共激活因子,参与结肠组织细胞的凋亡、分化和增殖,体细胞突变EP300 基因已在多种人类恶性肿瘤中发现,包括结肠癌[23],而EP300 表达水平与结肠癌淋巴结浸润之间存在一定相关性,组织中肿瘤蛋白TP53 的表达水平也高于正常结肠组织[24]。通过巨噬细胞产生的炎症启动因子TNF-α 可促使UC 的发生与进展[25],其主要通过对中性粒细胞趋化作用,浸润肠黏膜组织细胞,使其出现炎症损伤[26-27]。研究表明,药物可通过抑制TNF-α 的表达水平,并上调相关抗炎因子的表达,修复结肠组织,促进溃疡的愈合,且与IL-22 联合干预UC 的治疗,具有一定靶向治疗的意义[28]。
目前为止,UC 的发病原因与机制研究仍是一个瓶颈,一般认为其主要与环境、感染、遗传及免疫因素相关性较大[29]。本研究采用网络药理学的方法,对于白术-苍术药对通过多成分、多靶点、多通路来干预UC 的作用机制进行了阐释,为下一步实验性的药理研究提供了一定线索,拓展了思路。然而目前对UC 的认知仍处在不断完善之中,其次,网络药理学也具有一定自身局限性,因此可能存在一定程度的偏倚风险,仍需要后续的实验性研究进一步佐证。
