上市MEK 抑制剂Ⅰ期临床试验数据总结
2021-08-23郭玉莹田红旗
郭玉莹 田红旗
北京协和医学院 中国医学科学院放射医学研究所 天津市放射医学与分子核医学重点实验室,天津 300192
丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)级联反应调控重要的细胞过程包括基因表达、细胞增殖及细胞运动[1]。丝裂原活化的细胞外信号调节激酶(mitogen-activated extracellular signal-regulated kinase,MEK)是选择性磷酸化靶蛋白上丝氨酸/苏氨酸和酪氨酸残基的双特异性蛋白激酶,位于MAPK 蛋白上游。其已经成为一个关键的抗癌靶点,因为抑制这种酶可以阻止细胞增殖和诱导细胞凋亡[2-3]。Ⅰ期临床试验主要是探索不同给药方案下的剂量限制性毒性(dose limited toxicity,DLT)、最大耐受剂量(maximum-tolerated dose,MTD),评估药物的安全性和有效性,并推荐下一步研究的给药方案,对药物的耐受性、药物代谢动力学(pharmacokinetics,PK)进行初步研究。黄慧瑶等[4]对中国肿瘤药物临床试验统计分析中显示,Ⅰ期临床试验在临床试验中占比最多(53.8%)。同时Ⅰ期临床试验风险大、致死率高,若给药方案不合理则有可能导致后期整个临床试验的失败[5-6]。本文总结了上市MEK 抑制剂(曲美替尼、考比替尼、比美替尼和司美替尼)Ⅰ期临床试验的重要数据,希望能够对其他新型MEK 抑制剂提供一些借鉴。
1 曲美替尼
曲美替尼是首个被批准上市的MEK 抑制剂(图1)。其首次Ⅰ临床试验在美国开展(NCT00687622),该研究是建立在强大的体外、异种移植模型数据和肿瘤患者基因突变类型的基础上[7]。试验共招募了206 例原发肿瘤患者,研究团队采用加速滴定方案设计确定MTD。虽然在4 mg 的给药剂量下所报告的不良反应没有达到MTD 的标准,但是考虑到不良反应事件的早发性研究团队将每天口服3 mg 曲美替尼定为MTD。然而在接受该剂量治疗1 个周期的12 例患者中1 例患者由于疲劳退出,5 例患者中断给药,2 例患者减小了给药剂量。于是综合报告显示在2 mg 给药方案中药物暴露浓度高于临床前目标阈值、通路抑制、持久的客观反应和MTD 下患者耐受性较差等因素,研究团队最终选择每天口服2 mg 曲美替尼作为推荐的临床Ⅱ期剂量。毒性方面,DLTs 包括皮疹、腹泻和中枢性浆液性视网膜病变,常见治疗相关的不良事件(adverse events,AEs)为1 或2 级痤疮样皮疹或皮炎和腹泻。药效方面,报告显示在所有剂量水平下患者的客观缓解率为10%,最敏感人群为BRAF 突变的黑色素瘤患者,这也是MEK 抑制剂第一次表现出实质性的临床活性[8]。研究发现患者长期使用BRAF 抑制剂导致ERK 的矛盾激活从而促进继发性肿瘤的发生,与MEK 抑制剂联合使用能够延缓耐药[7]。一项曲美替尼与拉菲尼联合用于BRAFV600 突变的黑色素瘤患者的Ⅰ/Ⅱ期临床试验在美国开展(NCT01072175)。报告显示联合用药组中可管理的发热高于达拉菲尼组,皮肤鳞状细胞癌发生率低于单药组,研究团队推荐临床Ⅱ期剂量为每天两次150 mg 达拉菲尼和每天1 次2 mg 曲美替尼[9]。为了黑色瘤患者能够获得更大的临床效益,另有研究团队开展了一项与度伐利尤单抗(PD-L1 抑制剂)和达拉菲尼三联疗法用于BRAFV600突变的黑色素瘤患者的Ⅰ期临床试验,结果显示药物毒性增加但客观缓解率有明显提高[10]。
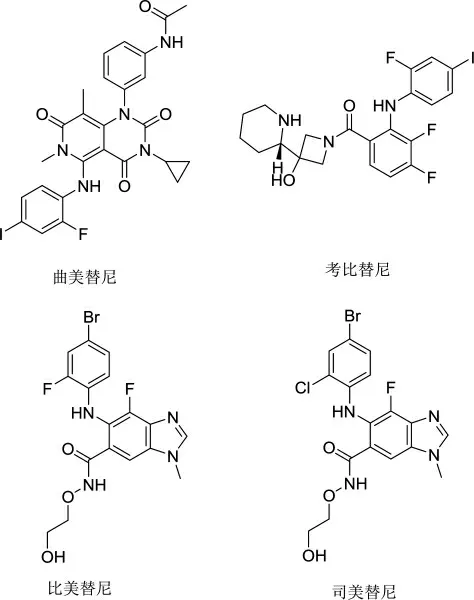
图1 FDA 批准上市的MEK 抑制剂
2 考比替尼
考比替尼被批准和BRAF 抑制剂威罗菲尼联合用于治疗BRAFV600E 或V600K 突变的不可切除或转移性黑色素瘤患者[11](图1)。在考比替尼用于治疗实体肿瘤的Ⅰ期临床试验(NCT00467779)中,研究团队采用“3+3”设计评估了周期28 d 的给药21 d(21/7)和给药,4 d(14/14)两个队列的MTD、DLT、PK 等。试验共纳入97 例结直肠癌、黑色素瘤等实体肿瘤患者,报告显示DLTs 分别为4 级肝性脑病、3 级腹泻和皮疹;伴有视网膜下可逆性液体的3 级皮疹和视力模糊,MTD 分别为每天口服60 mg 或100 mg 考比替尼。AEs 大都是1 或2 级腹泻、皮疹、疲劳、水肿、恶心和呕吐,部分患者出现3 级或者更高的不良反应(最常见的是皮疹和腹泻),但也是可控的。在MTD 治疗下,两个队列患者的皮疹和水肿的发生率相似。但总体的来说14/14 队列AEs 发生率更高,因此团队最终采用的给药方案为每天60 mg(21/7)[12]。另一项与威罗菲尼联合用于治疗晚期BRAFV600 突变黑色素瘤患者的Ⅰb 期临床试验中(NCT01271803),研究团队采用标准的“3+3”设计确定MTD 为每天2 次960 mg 威罗菲尼联合每天60 mg 考比替尼(21/7)。毒性方面,DLTs 为口炎和疲劳和关节及肌肉痛,最常见的AEs是轻中度腹泻、非痤疮样皮疹、肝酶异常、疲劳、恶心和光敏,最常见的3 级或4 级不良事件是皮肤鳞状细胞癌,碱性磷酸酶升高和贫血。药效方面,报告显示在近期使用威罗菲尼治疗取得进展的66 例患者中有10 例证实客观缓解,从未接受过BRAF 抑制剂治疗的63 例患者中有55 例证实客观缓解,其中6 例完全缓解[13]。为了取得更大的临床效果,与阿替利珠单抗(PD-L1 抑制剂)和威罗菲尼联合用于BRAF 突变黑色素瘤患者的多中心、“3+3”设计Ⅰ期临床试验结果显示其具有可管理的毒性和更好的疗效[14],依据其Ⅲ期临床试验结果已被批准其用于治疗BRAFV600突变的晚期黑色素瘤患者。
3 比美替尼
比美替尼和司美替尼均由Array Biopharma 公司设计(图1)。在比美替尼用于治疗晚期癌症患者的Ⅰ期临床试验中(NCT00959127)研究团队采用3+3设计方案确定MTD 为每天2 次60 mg 比美替尼,但是在扩展阶段1 例患者在该剂量下发生了高于预期的眼毒性,故新入组的患者给药剂量减少为每天2 次45 mg,该剂量也为研究团队推荐的Ⅱ期临床剂量[15]。毒性方面,DLTs 为痤疮样皮炎和脉络膜视网膜病变,常见的AEs 包括1 或2 级皮疹、恶心、呕吐、腹泻、外周水肿和疲劳。PK 数据显示其半衰期比其他MEK1/2 抑制剂短,这意味着患者在中断药物治疗后药物毒性能够被更快消除[16]。在可评估的91 例患者中1 例完全缓解、2 例部分缓解,均为胆道癌患者[15]。研究人员考虑到其在Ⅰ期临床试验展现出对肠道癌的疗效,比美替尼作为单药或与其他药物联合用于治疗肠道癌的研究正在被开展[17]。Lowery 等[18]报道一项关于其联合吉西他滨和顺铂用于治疗晚期肠道癌患者的Ⅰ/Ⅱ期临床试验(NCT01828034)结果显示,虽然该联合具有较好的安全性但有效性不足而被终止。Kim 等[19]报道其联合卡培他滨对接受过吉西他滨治疗的肠道癌患者的Ⅰ期临床试验(NCT02773459)中显示了可接受的耐受性和良好的抗肿瘤效果。此外,临床数据显示,BRAF抑制剂恩考芬尼联合比美替尼可进一步改善BRAF突变黑色素瘤患者的治疗[20]。FDA 根据COLUMBUS研究结果批准恩考芬尼和比美替尼联合治疗BRAF突变的不可切除或转移性黑色素瘤[21]。
4 司美替尼
由阿斯利康公司开发的司美替尼已被批准用于Ⅲ或Ⅳ期分化型甲状腺癌的辅助治疗、1 型神经纤维瘤病和有症状不能手术的丛状神经纤维瘤的儿童患者。一项司美替尼游离碱悬浮液用于治疗晚期癌症患者的Ⅰ期临床试验研究共招募了黑色素瘤、乳腺癌和结直肠癌等57 例患者。研究团队采用标准的“3+3”设计方案确定每天2 次口服给药200 mg 为MTD,但由于毒性问题最终推荐100 mg 为临床Ⅱ期试验剂量,最常见DLTs 是1 或2 级皮疹[22]。为了提高药物依从性,Banerji 等[23]报道了一项含有硫酸氢盐的固体口服司美替尼胶囊用于治疗癌症晚期患者的Ⅰ期临床试验研究,试验共招募59 例直肠癌、肺癌、食道癌、皮肤癌、胃癌和胰腺癌等患者。MTD 为每天2 次口服给药75 mg,DLTs 为3 级痤疮样皮疹和胸腔积液。两种剂型PK,药效等数据比较结果显示,75 mg 司美替尼胶囊的药峰浓度(Cmax)和给药后24 h 血浆药物浓度时间曲线下面积(AUC0-24)明显高于100 mg 其游离碱悬浮液,安全性和耐受性相似。由美国国立卫生研究院和其他机构资助的司美替尼胶囊用于治疗1 型神经纤维瘤病和不能手术的丛状神经纤维瘤Ⅰ期临床试验研究(NCT01362803)共招募24 例儿童患者,17 例患者被证实部分缓解[24],AEs 包括痤疮样皮疹、胃肠道反应和无症状肌酸激酶升高。研究团队最初采用标准的“3+3”设计方案将每天2 次20 mg/m2(大约成人推荐剂量75 mg 的50%)司美替尼定为儿童患者MTD。然而根据儿童脑肿瘤协会同时进行的一项司美替尼胶囊用于治疗低级别胶质瘤的Ⅰ期临床试验中,使用改进的连续面积评估方法MTD 被确定为25 mg/m2(大约成人推荐剂量75 mg 的60%)[25]。为了协调儿童用药剂量,团队对该剂量进行评估,最后确定25 mg/m2被认为是可以接受的,所观察到的反应与20 mg/m2相似,最后选择了25 mg/m2作为MTD。
在已上市的MEK 抑制剂临床试验中研究团队大都通过常规的“3+3”设计确定MTD 如考比替尼、比美替尼和司美替尼,其各剂量水平在试验前均已被确定,但往往暴露在有效剂量之下的患者相对较少;曲美替尼的MTD 采用加速滴定设计方案确定,该方法是由常规“3+3”设计和参数设计结合,可以保证患者接受更高、更有效的剂量但会掩盖药物治疗的累积效应,同时大规模的Ⅱ期临床试验会放大Ⅰ期临床试验所提供的方案,Conaway 等[6]表示在成功的Ⅲ期临床中使用“3+3”设计确定给药剂量的相对较少,这就需要研究人员探索更准确、安全的试验设计确定更合理的给药方案。试验显示,MEK 抑制剂的AEs 通常为恶心、疲劳、皮疹、腹泻或眼毒性,对于这种预期毒性研究团队需尽早制订风控措施。同时Ⅰ期临床试验招募的患者往往是不同癌症类型,这就需要注意不同临床科室之间患者管理及协调的问题,从而进一步提高Ⅰ期临床试验质量水平。
