线虫效应子MgMO237及互作蛋白OsCRRSP55在水稻中的共响应基因鉴定
2021-08-22李治文刘培燕陈建松廖金铃林柏荣卓侃
李治文 刘培燕 陈建松,2 廖金铃.2,3 林柏荣,2 卓侃,2
(1. 华南农业大学植物保护学院植物线虫研究室,广州 510642;2. 广东省微生物信号与作物病害防控重点实验室,广州 510642;3. 广东生态工程职业学院,广州 510520)
拟禾本科根结线虫(Meloidogynegraminicola)是水稻重要的病原之一,该线虫引起的水稻根结线虫病广泛分布于热带和亚热带国家,包括中国、美国、孟加拉国、缅甸、老挝、印度、泰国、越南和菲律宾 等[1-2]。在我国,拟禾本科根结线虫首先在海南省发现,其后在福建、广东、广西和安徽等多个省份均有报道,近年危害愈加严重[3-5]。该线虫在水田通常可造成17%-32%的水稻产量损失,在旱地水稻田可造成更严重的危害,严重时导致高达80%的损失甚至水稻失收[6]。
近年来研究发现拟禾本科根结线虫可分泌效应子至寄主植物中,这些效应子具有抑制植物防卫反应、改变植物信号通路等功能,有利于线虫寄生。如Chen等[7]报道定位在线虫亚腹食道腺的效应子MgGPP被线虫分泌到寄主植物细胞质外体中,在效应子C端帮助下进入内质网,在内质网中N端发生糖基化且C端被水解,然后被运输至细胞核中抑制植物防卫反应,促进线虫寄生。另两个效应子Mg16820和Mg01965同样定位在线虫亚腹食道腺并促进线虫寄生。Mg16820在线虫侵入水稻后的迁移阶段被分泌到水稻细胞质外体,当线虫进入固着性寄生阶段时则被分泌到水稻细胞内,定位于细胞质和细胞核;Mg01965在线虫迁移和固着寄生阶段均被分泌到水稻细胞质外体[8-9]。其中Mg16820在植物细胞质外体和细胞内分别抑制病原相关分子模式促发的免疫反应(PAMP-triggered immunity,PTI)和效应子促发的免疫反应(effector-triggered immunity,ETI)[8];而Mg01965在质外体时可抑制PTI,但在细胞内则无抑制植物免疫的作用[9]。进一步研究表明Mg16820与一个脱落酸响应基因蛋白:脱水应 激诱导蛋白(dehydration-stress inducible protein 1,DIP1)相互作用,推测其可能参与植物应激反应[8]。
本课题组前期构建了一个拟禾本科根结线虫抑制差减文库,从中克隆获得MgMO237效应子,研究表明该效应子具有抑制植物PTI、促进线虫寄生的功能。进一步研究发现MgMO237与3个水稻防卫相关蛋白相互作用,其中之一是水稻富含半胱氨酸重复序列分泌蛋白(Cys-rich repeat secretory proteins,CRRSPs)OsCRRSP55[10]。由于转录因子OsWRKY47能绑定OsCRRSP55启动子区并启动其转录,而WRKY家族基因通常受到水杨酸和茉莉酸调控,因此推测OsCRRSP55基因可能参与植物激素通路相关的防卫反应,MgMO237可能通过与OsCRRSP55互作干扰了植物激素信号通路,从而抑制植物防卫反应[10-14]。因此本研究进一步通过RT-qPCR技术检测OsCRRSP55的表达特性,并通过RNA-seq(RNA sequencing)Illumina测 序 及RT-qPCR技 术 寻 找MgMO237与OsCRRSP55的植物激素通路共响应基因,为了解OsCRRSP55基因在线虫寄生中的作用及寻找防控根结线虫的靶标基因奠定基础。
1 材料与方法
1.1 材料
野生型日本晴水稻(Oryza sativacv. ‘Nipponbare’)、MgMO237转基因水稻、pCAMBIA1305.1载 体、pUbi载体和经单卵囊纯化后的拟禾本科根结线虫种群均保存于华南农业大学植物线虫研究室。
1.2 方法
1.2.1OsCRRSP55基因扩增及序列分析 用天根生化科技(北京)有限公司的植物总RNA提取试剂盒提取水稻根总RNA。取2 μg RNA,用北京全式金生物技术有限公司反转录试剂盒合成cDNA第一链,以该cDNA为模板,设计一对覆盖基因开放阅读框的引物(本研究所用引物见表1)扩增OsCRRSP55基因全长。PCR反应体系(50 μL)为:cDNA 1 μL,KOD FX 1 μL,2 × KOD FX Buffer 25 μL,dNTPs 10 μL,上下游引物各1.5 μL,ddH2O 10 μL。PCR反应程序为:94℃预变性5 min;98℃变性10 s,55℃退火30 s,68℃延伸1 min,30个循环;68℃延伸5 min。扩增产物用1%琼脂糖凝胶电泳检测。PCR产物纯化回收,连接到北京全式金生物技术有限公司的pEASY-Blunt Simple载体上,最后转化克隆送广州天一辉远基因科技有限公司测序。
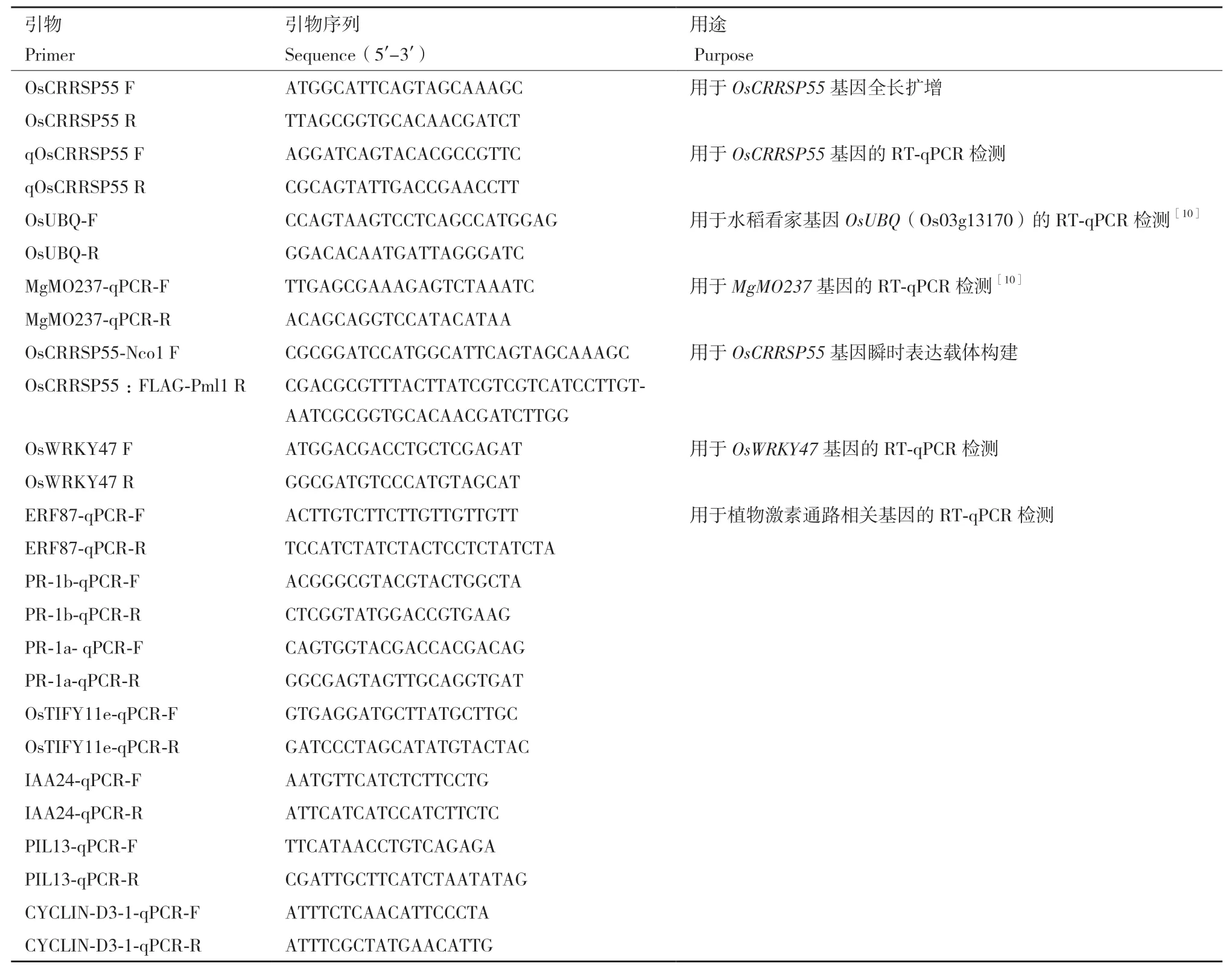
表1 本研究所用的引物Table 1 Primers used in this study
通过NCBI进行OsCRRSP55同源序列检索,使 用ClustalW(https://www.genome.jp/tools-bin/clustalw)和Boxshade(http://sourceforge.net/projects/boxshade/)软件进行序列比对及作图。用SignalP 5.0(http://www.cbs.dtu.dk/services/SignalP/)和TMHMM(http://www.cbs.dtu.dk/services/TMHMM/)分别预测信号肽序列和跨膜结构域。
1.2.2OsCRRSP55基因在水稻不同器官的表达分析 分别提取水稻种子及14日龄水稻根、茎、叶RNA并反转录获得cDNA。以该cDNA为模板,用实时荧光定量PCR(RT-qPCR)扩增OsCRRSP55基因和水稻内参基因OsUBQ(Os03g13170),检测OsCRRSP55基因在水稻各器官的相对表达量。RTqPCR反 应 体 系(20 μL)为:2 ×GoTaq® qPCR Master Mix 10 μL;上下游引物各0.4 μL;cDNA 1 μL;RNase-free Water 8.2 μL。扩增程序为:95℃预变性2 min;95℃变性10 s,60℃扩增30 s,40个循环。所有实验取3次生物学重复处理的样品,每个样品设置3个技术重复,用2-ΔΔct方法计算基因的相对表达量。
1.2.3OsCRRSP55基因响应线虫侵染的表达分析 将200条拟禾本科根结线虫侵染前2龄幼虫接种至14日龄水稻根部,7 d后分别取根结及健康水稻的相应根部位,提取RNA并反转录获得cDNA。以该cDNA为模板,用RT-qPCR检测OsCRRSP55基因的相对表达量。
1.2.4OsCRRSP55基因响应水杨酸和茉莉酸甲酯的表达分析 用8 mmol/L水杨酸(salicylic acid,SA)和100 μmol/L茉莉酸甲酯(methyl jasmonate,MeJA)水溶液(含0.02%(V/V)吐温20)喷施14日龄水稻叶片,直至形成细密水膜。以含0.02%(V/V)吐温20的清水为对照,置于28℃培养24 h[15-16]。提取上述水稻根部RNA并反转录获得cDNA。以该cDNA为模板,用RT-qPCR检测OsCRRSP55基因的相对表达量。
1.2.5 响应MgMO237的植物激素通路基因筛选与验证 分别提取14日龄MgMO237转基因水稻OE26、OE61株系和野生型水稻叶片RNA,反转 录 获 得cDNA。以 该cDNA为 模 板,用RTqPCR扩增MgMO237基因和水稻内参基因OsUBQ(Os03g13170),检测MgMO237基因的表达,确认阳性MgMO237转基因水稻植株。
分别提取14日龄MgMO237转基因水稻OE26、OE61和野生型水稻的根部总RNA,构建转录组文库并用Illumina HiSeqTM 进行测序。通过 FDR(false discovery rate)与log2FC(FDR<0.05且 |log2FC|>1)筛选转基因水稻和野生型水稻的差异表达基因。采用FPKM(Fragments Per Kilobase of transcript per Million mapped reads)法进行基因表达量计算。用EdgeR软件进行基因表达差异分析,并对差异基因进行GO分析和KEGG分析。用RT-qPCR技术进行植物激素通路差异表达基因的验证。
1.2.6 响应OsCRRSP55的植物激素通路基因分析 设计特异引物扩增带有FLAG标签的OsCRRSP55全长序列,将获得的扩增片段和pUbi载体用NcoI和PmlI(赛默飞世尔科技公司)双酶切,用东洋纺生物科技有限公司的Ligation High Ver.2连接酶连接获得 pUbi∶OsCRRSP55∶FLAG瞬时表达载体。通过polyethylene glycol(PEG)介导原生质体转化法将该载体转化水稻原生质体[17]。基于Western blot技术,使用FLAG标签抗体检测OsCRRSP55蛋白的表达。水稻原生质体的制备、蛋白提取和Western blot分析按Chen等[10]描述的方法进行。提取过表达OsCRRSP55水稻和野生型水稻原生质体RNA并反转录获得cDNA。以该cDNA为模板,用RTqPCR检测响应OsCRRSP55的植物激素通路基因的表达量,获得线虫效应子MgMO237及互作蛋白OsCRRSP55在水稻中的共响应基因。
2 结果
2.1 水稻OsCRRSP55基因的序列分析
水稻OsCRRSP55基因cDNA编码区全长798 bp,预测氨基酸长265 aa,蛋白分子量大小28.19 kD,具N端信号肽,不含跨膜结构域,含有两个Unknown Function 26(DUF26)结构域,保守基序为C-X8-C-X2-C(图1)。氨基酸序列相似性比对结果显示,OsCRRSP55与多种植物CRRSP55氨基酸序列相似,其中与扫帚黍(Dichanthelium oligosanthes)的DoCRRSP55同源性最高,相似性为79.8%。

图1 植物CRRSP55蛋白多序列比对和保守结构域分析Fig.1 Multiple sequence alignment and conserved motif analysis of plant CRRSP55 proteins
2.2 OsCRRSP55基因在水稻不同器官及响应线虫侵染的表达分析
RT-qPCR检测结果表明,OsCRRSP55在水稻的种子、14天龄的根、茎和叶中均有表达,其中在叶与根中表达量较高,分别为种子中表达量的24.35和5.39倍(图2-A)。
与健康水稻根中的OsCRRSP55基因表达相比,拟禾本科根结线虫侵染7 d后的根结中OsCRRSP55基因表达量显著提高,提高约12倍(图2-B)。
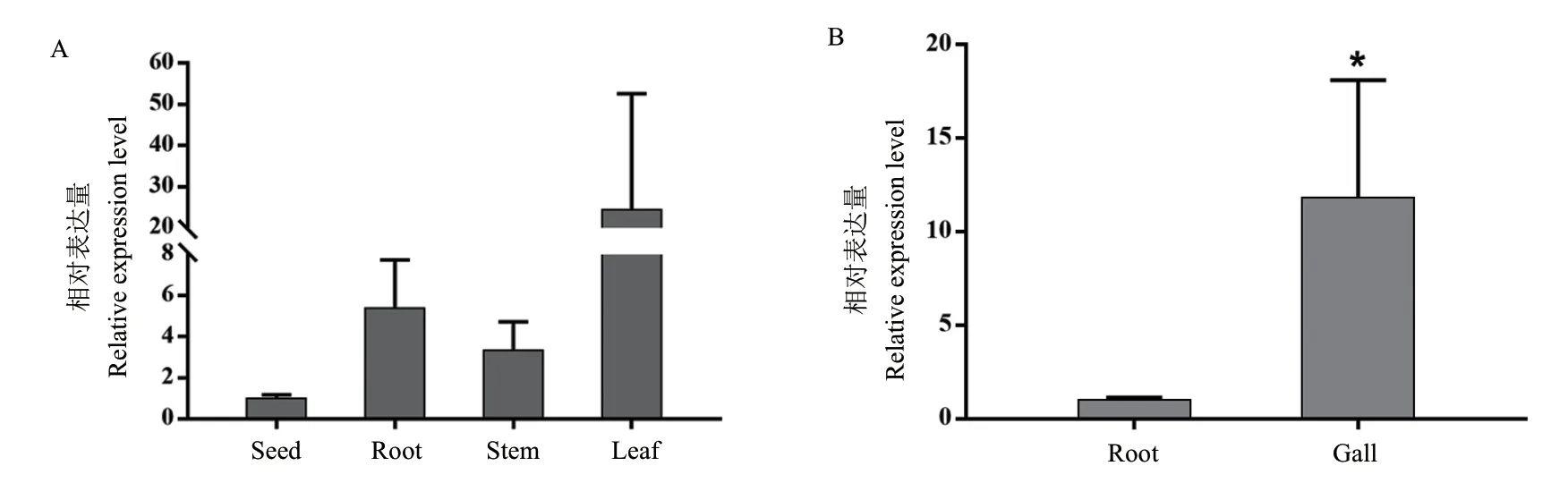
图2 水稻OsCRRSP55基因的表达Fig. 2 Expression levels of OsCRRSP55 gene in rice
2.3 OsCRRSP55是水杨酸和茉莉酸响应基因
RT-qPCR检测结果显示,OsCRRSP55在外源水杨酸处理的水稻中转录水平显著上调,其表达量是未经水杨酸处理水稻的2.52倍;结合OsCRRSP55基因启动子区域的转录因子WRKY47表达水平也显著上调,约为未经水杨酸处理水稻的7.73倍(图3-A)。OsCRRSP55和WRKY47在茉莉酸甲酯处理的水稻中转录水平也显著上调,与未经茉莉酸甲酯处理的水稻相比,分别上调1.97倍和2.45倍(图3-B)。
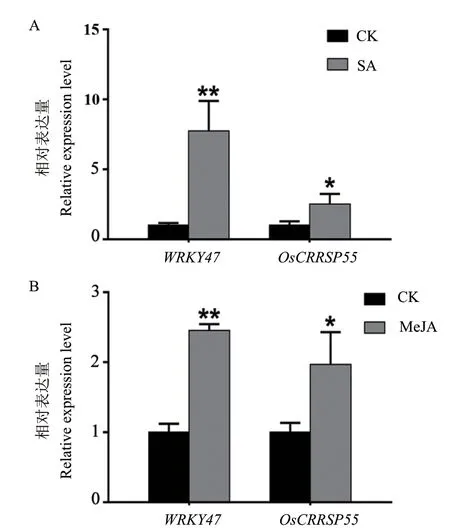
图3 水杨酸和茉莉酸甲酯处理水稻后OsCRRSP55和WRKY47基因的表达变化Fig. 3 Expression variations of OsCRRSP55 and WRKY47 genes in the rice treated with salicylic acid and methyl jasmonate
2.4 响应MgMO237的植物激素通路基因筛选与 验证
RT-qPCR检测结果显示在野生型水稻中没有检测到MgMO237基因表达,而在两个MgMO237转基因水稻株系OE61和OE26中均能检测到MgMO237基因表达(图4),表明OE61和OE26为MgMO237转基因水稻。
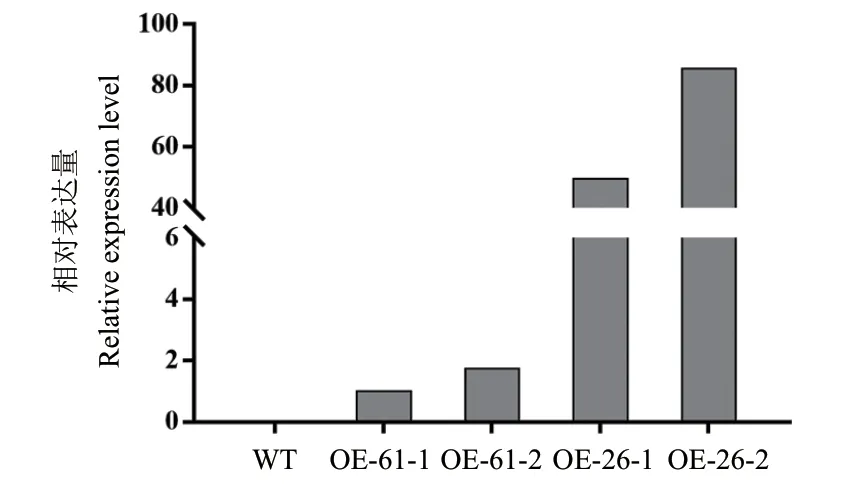
图4 MgMO237转基因水稻的鉴定Fig. 4 Identification of MgMO237-transgenic rice
对MgMO237转 基 因 水 稻OE26、OE61株 系与野生型水稻进行转录组测序,利用EdgeR对转录组数据进行基因差异表达分析,统计结果显示,OE26植株相对野生型植株有1 059个基因显著上调,1 412个基因显著下调。OE61植株相对野生型植株有740个基因显著上调,2 290个基因显著下调(图5-A)。OE26和OE61植株相对野生型植株共同上调的基因有239个,共同下调的基因有782个(图5-B),其中富集在植物激素信号转导功能的基因共有10个,包括9个下调基因和1个上调基因。显著下调的基因为IAA24(Os07g0182400)、IAA20(Os06g0166500)、IAA7(Os02g0228900)、PIL13(Os03g0782500)、b-ZIP TRANSCRIPTION FACTOR 62(Os07g0686100)、OsERF87(Os09g0572000)、CYCLIN-D3-1(Os09g0111100)、PR-1a(Os07g0129300)和PR-1b(Os01g0382000);显著上调的基因是TIFY11e(Os10g0391400),表明这些基因可能是MgMO237的植物激素通路响应基因。
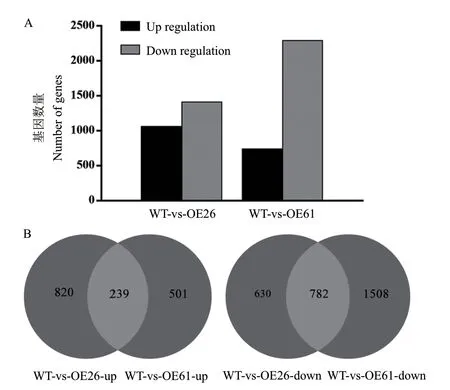
图5 MgMO237转基因水稻与野生型水稻差异表达基因 统计Fig. 5 Statistics of differentially expressed genes between MgMO237-transgenic rice and wild-type rice
随机选取5个上述植物激素信号通路差异表达基因,用RT-qPCR进行验证,结果显示MgMO237转 基 因植株中的PR-1a、PR-1b、CYCLIN-D3-1和OsERF87基因发生明显下调,TIFY11e基因发生显著上调(图6),与转录组测序的表达趋势一致,表明转录组测序结果可靠。
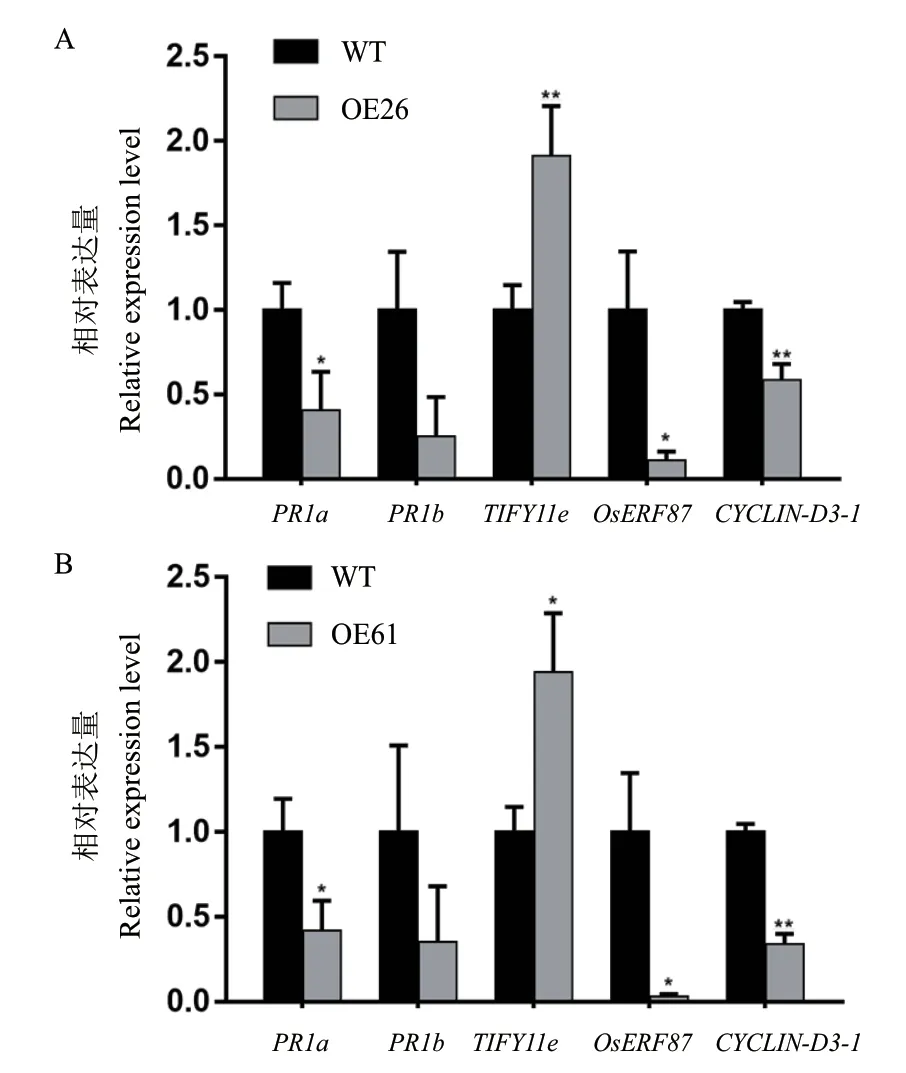
图6 RT-qPCR验证MgMO237转基因水稻与野生型水稻差异表达的植物激素通路基因Fig. 6 Confirmation of differentially expressed genes within plant hormone pathways in MgMO237-transgenic rice and wild-type rice by RT-qPCR
2.5 响应OsCRRSP55的植物激素通路基因分析
用FLAG标签抗体检测OsCRRSP55转化水稻原生质体中的OsCRRSP55表达,Western blot结果显示在OsCRRSP55转化水稻原生质体蛋白中检测到约28 kD特异条带(图7-A),条带符合预期大小,表明OsCRRSP55蛋白瞬时表达成功。用RTqPCR技术对上述MgMO237的植物激素通路响应基因OsERF87、IAA24、PIL13、CYCLIN-D3-1、PR-1b和TIFY11e在OsCRRSP55转化水稻原生质体中的表达进行分析,结果发现OsERF87基因表达显著高于在野生型水稻原生质体中的表达,上调约3倍,其余基因均未发现显著变化(图7-B),表明OsERF87基因是MgMO237和OsCRRSP55的植物激素通路共响应基因。
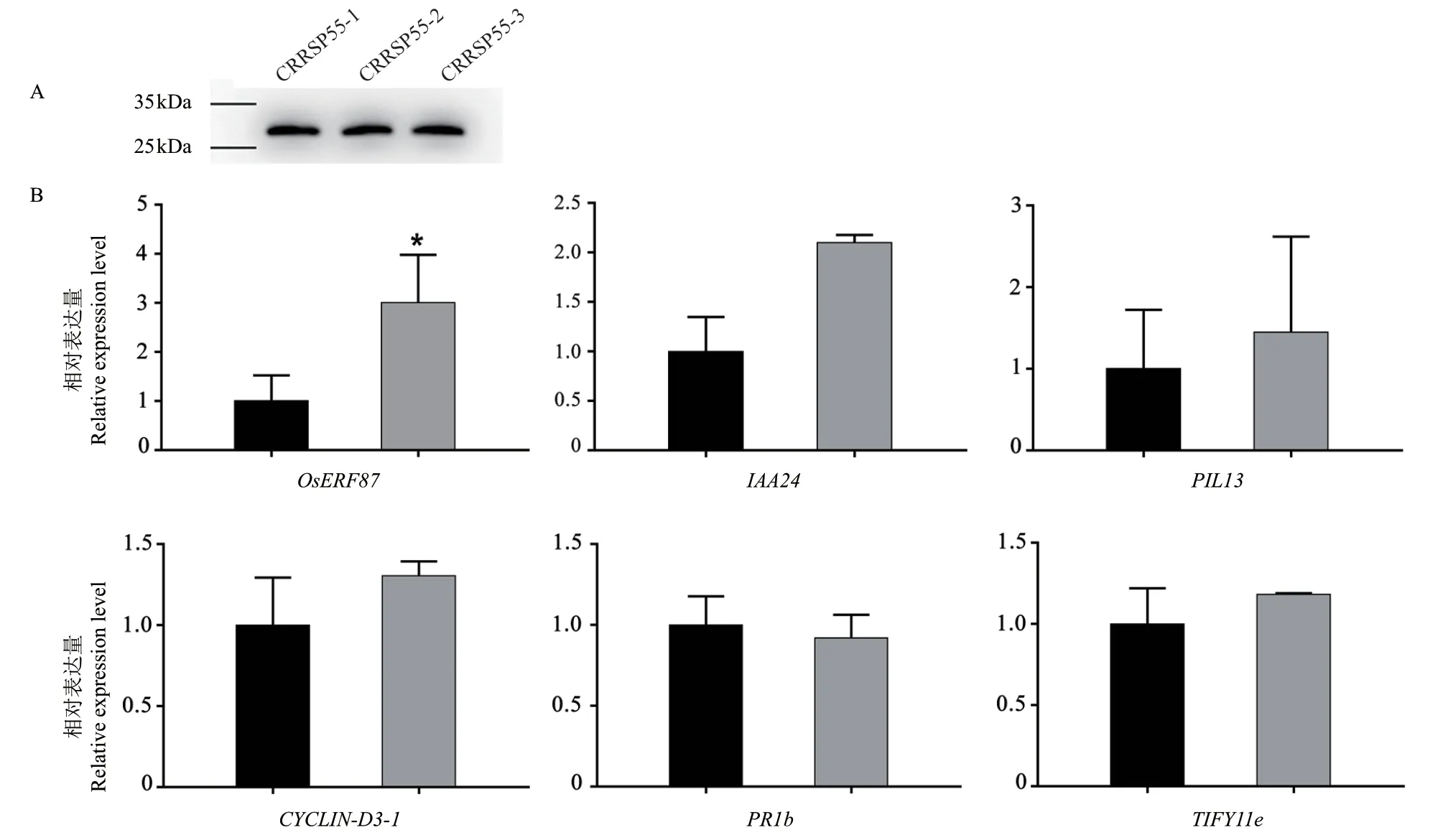
图7 OsCRRSP55影响水稻植物激素通路基因的表达Fig. 7 Expression levels of genes within rice hormone pathways responding to OsCRRSP55
3 讨论
前期研究发现拟禾本科根结线虫背食道腺表达效应子MgMO237在线虫侵染7 d后表达显著上调,与3个水稻蛋白:OsCRRSP55、OsGSC和OsBetvI相互作用,抑制水稻活性氧爆发、胼胝质积累和防卫基因表达,提高了水稻的感病性[10],其中OsCRRSP55属于DUF26蛋白超家族[18]。DUF26蛋白是有胚植物(embryophyte)特有的一类蛋白,根据蛋白含有的DUF26结构域数量、是否具信号肽、跨膜结构域和蛋白激酶结构域划分为四类蛋白家族[18]。第一类是富含半胱氨酸类受体细胞质激酶(Cysteine-rich receptor-like cytoplasmic kinases,CRCKs),只含有两个DUF26结构域,但没有信号肽、跨膜结构域和蛋白激酶结构域;第二类是富含半胱氨酸类受体蛋白激酶(cysteine-rich receptor-like protein kinases,CRKs),具有两个DUF26结构域及信号肽、跨膜结构域和蛋白激酶结构域;第三类是胞间连丝定位蛋白(plasmodesmata-localized proteins,PDLPs),具有两个DUF26结构域及信号肽和跨膜结构域,但胞内缺少蛋白激酶结构域;第四类是CRRSPs蛋白,含有单个或多个DUF26结构域和信号肽,但不具有跨膜结构域和蛋白激酶结构域[18]。DUF26蛋白对植物的抗生物和非生物胁迫具有重要作用,包括干旱、高温、盐胁迫、真菌和细菌胁迫等[19]。例如水稻CRK10基因的激活表达能增强对白叶枯病的抗性[20];拟南芥CRK家族基因,包括CRK4,CRK6和CRK36过表达均可增强拟南芥的免疫应答及对丁香假单胞菌(Pseudomonas syringae)的抗性[19-20]。DUF26还可结合糖,具有凝集素活性。如银杏中纯化出的CRRSPs蛋白Ginkbilobin2(Gnk2)含一个DUF26结构域,作为甘露糖结合的凝集素在体外发挥抗真菌作用[21-23]。玉米中两种CRRSPs蛋白AFP1和AFP2可与甘露糖结合,参与对玉米黑粉菌的抗性[24]。然而,该超家族蛋白在植物与线虫互作中的作用尚未见报道。本研究发现OsCRRSP55具信号肽和两个DUF26结构域,但不含跨膜结构域和蛋白激酶结构域,属于CRRSPs蛋白家族。RTqPCR结果显示OsCRRSP55在水稻根中表达,且在根结线虫侵染后表达量显著升高,表明OsCRRSP55在线虫寄生中发挥作用。
OsCRRSP55基因的启动子具有OsWRKY47转录因子的结合区域[11],之前研究发现水杨酸和茉莉酸可诱导一些WRKY转录因子表达[11-14]。本研究发现水杨酸和茉莉酸不仅显著提高水稻OsWRKY47基因的表达,同时也显著提高OsCRRSP55的表达,表明OsWRKY47和OsCRRSP55为水杨酸和茉莉酸响应基因。近年研究发现水杨酸和茉莉酸信号途径在水稻抗拟禾本科根结线虫中发挥作用,尤其是茉莉酸信号途径[16]。因此我们推测MgMO237可能通过与OsCRRSP55的互作影响了寄主中水杨酸和茉莉酸等激素信号的传递,抑制了水稻的防卫反应,促进线虫对水稻的寄生。为证明该推测,本研究进一步探索在水稻中是否存在MgMO237和OsCRRSP55的水杨酸和茉莉酸信号共响应基因。RNA-seq测序结果显示与野生型水稻相比,包括OsERF87在内的9个植物激素通路相关基因在MgMO237转基因水稻中转录下调,1个植物激素通路相关基因转录上调。同时RT-qPCR检测发现在OsCRRSP55转化水稻原生质体中,响应MgMO237的植物激素通路相关基因仅OsERF87基因显著上调,其余基因表达没有显著变化,表明OsERF87受到OsCRRSP55和MgMO237的共调控。据报道,水稻OsERF87可被茉莉酸诱导表达,从而引起病程相关蛋白基因RSOsPR10显著上调[25]。综上,我们认为拟禾本科根结线侵染水稻后分泌效应子MgMO237,MgMO237通过与OsCRRSP55的互作抑制了茉莉酸响应基因OsERF87表达,从而影响了茉莉酸信号的传递,进而抑制了植物的防卫反应并降低了寄主对线虫的抗性。
4 结论
水稻OsCRRSP55基因属于DUF26蛋白超家族,能响应拟禾本科根结线虫的侵染,同时能响应水杨酸和茉莉酸甲酯胁迫。线虫效应子MgMO237与OsCRRSP55均能调控茉莉酸响应基因OsERF87的表达。前期研究已表明MgMO237与OsCRRSP55相互作用,且MgMO237可抑制植物免疫反应并增强植物感病性。综上,推测MgMO237通过OsCRRSP55调控茉莉酸激素信号传导,抑制植物防卫反应,促进线虫寄生。
