β-乳球蛋白与丙烯酰胺的相互作用研究*
2021-08-21邱韵洁项雷文吴承燕陈文韬陈盛
邱韵洁,项雷文,,吴承燕,陈文韬,陈盛,
(1.福建师范大学 生命科学学院,福建 福州 350117;2.福建技术师范学院 食品与生物工程学院,福建 福清 350300)
丙烯酰胺是一种不饱和羧基化合物,有极强的水溶性,是公认的“人类可能致癌物”[1]。丙烯酰胺存在于许多常见食品中[2,3],如何降低其含量一直是国内外研究的热点问题[4-6]。
β-乳球蛋白是牛奶等乳制品中主要的乳清蛋白之一,占其含量的50%~55%。β-乳球蛋白单体上具有多个可结合疏水性配体的结合位点[7],可以与小分子结合,包括脂肪酸、视黄醇、多酚和其他小分子[8,9]。
使用计算机进行分子对接有助于了解蛋白质与小分子结合时的构象变化以及蛋白质-配体复合物的稳定性。本文将采用分子对接手段,探究β-乳球蛋白与丙烯酰胺可能的具体作用方式,并结合液质联用仪验证β-乳球蛋白对丙烯酰胺的抑制情况,为将来探究二者同时被摄入时降低丙烯酰胺对人体的影响的可能性提供了理论基础。
1 材料与模型
1.1 材料与试剂
丙烯酰胺,标准品(上海阿拉丁生化科技股份有限公司);β-乳球蛋白,90%(上海源叶生物科技有限公司);甲醇、甲酸,色谱纯(国药集团化学试剂有限公司);L-亮氨酸(L-Leu)、L-缬氨酸(L-Val)、L-异亮氨酸(L-Ile)、L-苯丙氨酸(L-Phe),纯度均为99%(上海麦克林生化科技有限公司);水系针筒式微孔滤膜过滤器,0.22 μm(天津市津腾实验设备有限公司)。
1.2 仪器与设备
液质联用仪,Aglient1290/6460(安捷伦科技有限公司);电子分析天平(厦门精艺兴业有限公司);数显恒温水浴锅(厦门一恒科学仪器有限公司);微型旋涡混合器(上海沪西分析仪器厂有限公司)。
1.3 溶液的配制
丙烯酰胺溶液:将丙烯酰胺配制成1000 ng/mL的样品溶液,涡旋混匀后,置于4 ℃冰箱冷藏备用。
β-乳球蛋白溶液:将β-乳球蛋白配制成4 mg/mL的样品溶液,涡旋混匀后,置于4 ℃冰箱冷藏备用。
氨基酸样品溶液:将L-Leu、L-Val、L-Ile、L-Phe配制成2 mg/mL的样品溶液,涡旋混匀后,置于4 ℃冰箱冷藏备用。
1.4 色谱和质谱参数[10]
1.4.1 HPLC条件
色谱柱:Agilent SB-C18 RRHD,2.1×100 mm,粒径2.7 μm;流动相:甲醇:0.1 %甲酸(1∶9,体积比);流速:0.2 mL/min;柱温:26 ℃;进样量:25 μL。
1.4.2 MS/MS条件
检测方式:多反应离子检测(MRM);电离方式:阳离子电喷雾电离源(ESI);毛细管电压:3500 V;锥孔电压:40 V;射频透镜1电压:30.8 V;离子源温度:80 ℃;脱溶剂气温:300 ℃;离子碰撞能量:6 eV;丙烯酰胺离子条件:母离子m/z 72、子离子m/z 55、子离子m/z 44;丙烯酰胺定量离子:m/z 55。
1.5 数据处理
使用SPSS 23.0软件对数据进行处理分析,运用多重比较字母标记法。p<0.05表示存在显著性差异,用小写字母表示;p<0.01表示存在极显著性差异,用大写字母表示。
1.6 分子模型
1.6.1 丙烯酰胺分子模型
丙烯酰胺的分子模型获取自ZINC[11]数据库,ZINC ID为ZINC000000901075。
1.6.2 β-乳球蛋白分子模型
β-乳球蛋白的分子模型来源于RCSB PDB数据库,其PDB ID为2Q2M[12]。本文所使用的2Q2M采用X-ray衍射方法获得,实验环境的pH值为7.4,温度为293 K,分辨率为0.21 nm。
1.7 分子对接工具
分子对接软件使用AutoDock Vina[13],可以有效利用多核心处理器的核心计算单元,使得对接速度达到比较理想的状态。
由于本文所使用的蛋白质模型2Q2M出现了缺失氨基酸残基的情况,因此将使用UCSF Chimera[14]的Modeller模块补全其氨基酸残基。除此之外,UCSF Chimera、PyMol[14]和LigPlot[15]将用于分子模型的预处理及对接模型结构的分析,以及蛋白质与配体的相互作用情况,此外也作为采集部分图片的工具。
2 实验方法与结果
2.1 不同浓度β-乳球蛋白对丙烯酰胺的抑制
将β-乳球蛋白样品溶液按不同体积比例稀释后与丙烯酰胺样品溶液1∶1混合,配制成丙烯酰胺浓度为500 ng/mL、β-乳球蛋白浓度分别为0(对照组)、0.5、1、2 mg/mL的混合溶液,常温下涡旋混匀后送入液质联用仪中检测。不同浓度β-乳球蛋白对丙烯酰胺的抑制情况如图1所示。
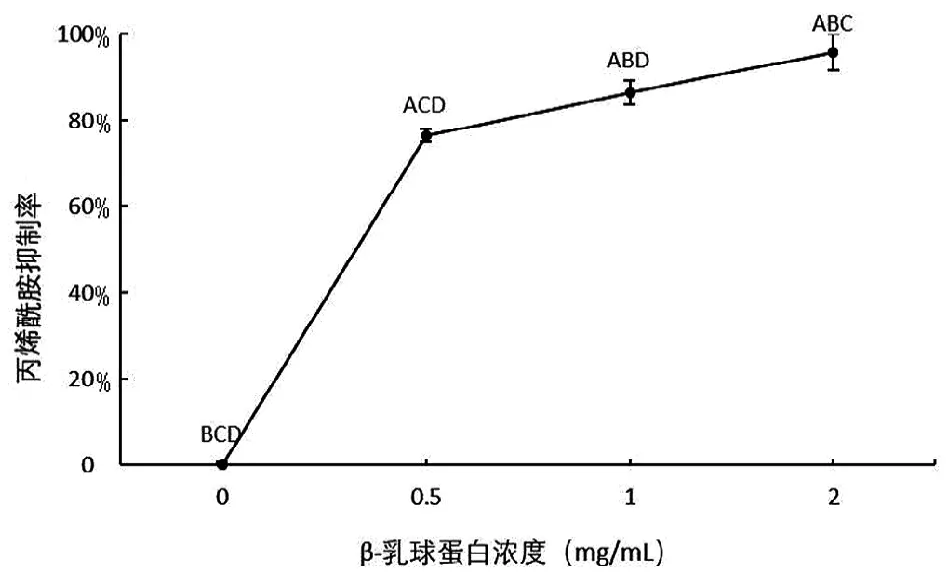
图1 不同浓度β-乳球蛋白对丙烯酰胺的抑制
从图1可以看出,添加β-乳球蛋白后的丙烯酰胺浓度有所降低,且随β-乳球蛋白浓度增加,抑制率也增加。当β-乳球蛋白浓度为2 mg/mL时,抑制率达到96%。说明β-乳球蛋白与丙烯酰胺之间发生了某种结合作用,从而使得丙烯酰胺检测值降低,且此种结合效果会随β-乳球蛋白浓度增加而变大。
2.2 β-乳球蛋白与丙烯酰胺分子对接
为了进一步研究β-乳球蛋白与丙烯酰胺之间的具体作用方式,首先使用UCSF Chimera的Modeller模块为2Q2M补全缺失的氨基酸残基,然后去除水分、添加极性氢原子,并用Dock Prep模块为β-乳球蛋白进行对接前准备。将丙烯酰胺进行能量最小化处理。接下来为AutoDock Vina配置参数文件,需要的参数有:蛋白质和配体的PDBQT文件路径、盒子中心坐标及其大小,盒子中心坐标为(41.539,54.407,26.375),盒子大小为2.0 nm×2.0 nm×2.0 nm。最后使用AutoDock Vina进行半柔性对接模拟,采用Lamarckian遗传算法,得到对接结果和与之相对应的打分成绩。β-乳球蛋白与丙烯酰胺分子对接的结果如表1所示,列举了10个能量最低的对接模型及打分情况,并分别计算出结合常数。
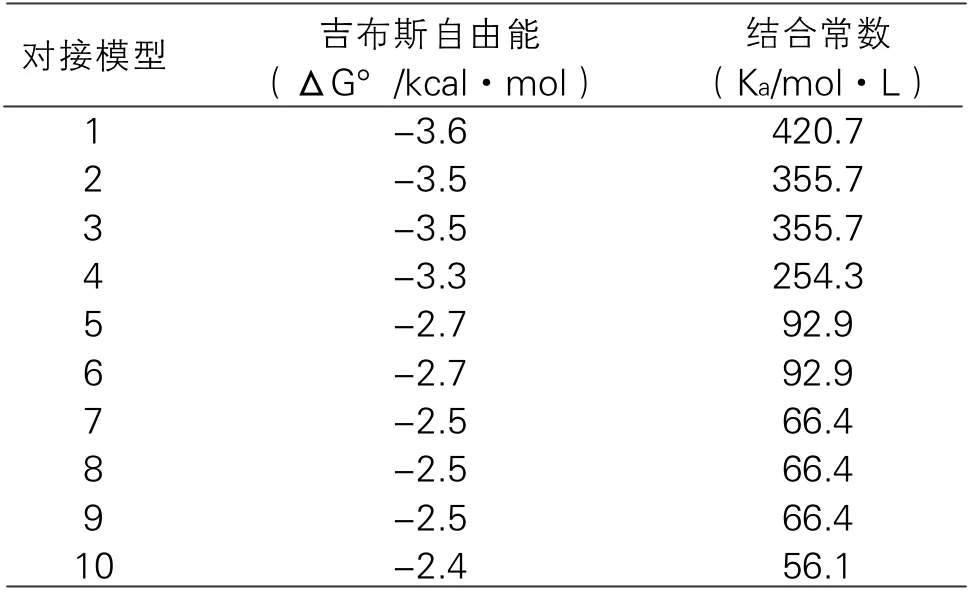
表1 β-乳球蛋白与丙烯酰胺对接模型的打分情况
从表1可以看出,所有对接模型的吉布斯自由能均小于零,表明β-乳球蛋白与丙烯酰胺可以自发地进行相互作用。但是能量最低也只有-3.6 kcal/mol,其结合常数也不高,表明β-乳球蛋白与丙烯酰胺有结合的可能性,但是相互作用不强。图2显示了上述10个对接模型在三维空间上的排布,其中大部分对接模型显示丙烯酰胺位于β-乳球蛋白空腔内部。图3表示上述10个对接结果中表现最佳的对接模型的相互作用。

图2 β-乳球蛋白与丙烯酰胺分子对接结果示意图

图3 能量最低的对接模型中β-乳球蛋白与丙烯酰胺的相互作用
如图3所示,β-乳球蛋白空腔内部结合位点中的氨基酸残基Leu46、Leu54、Ile56、Val92、Val94、Leu103、Phe105和Leu122共同形成了柱状疏水空腔,且这8个氨基酸残基对丙烯酰胺具有疏水作用,为β-乳球蛋白能与丙烯酰胺相互作用提供了证据。
2.3 不同氨基酸对丙烯酰胺的抑制
将图3(c)中的四种氨基酸(Leu、Val、Ile、 Phe)样品溶液按不同体积比例稀释后与丙烯酰胺样品溶液1∶1混合,配制成丙烯酰胺浓度为500 ng/mL、四种氨基酸浓度分别为0(对照组)、1 mg/mL的混合溶液,常温下涡旋混匀后送入液质联用仪中检测。
由图4结果可知,四种氨基酸均对丙烯酰胺有抑制作用,其中Leu、Phe的抑制率最高,均在95%以上;其次是Ile,抑制率为90%;Val对丙烯酰胺抑制率最低,20 ℃下仅为29%。
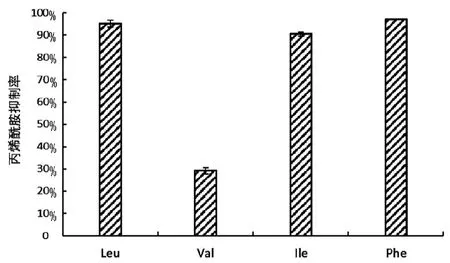
图4 不同种氨基酸对丙烯酰胺的抑制
3 结论
本文使用液质联用仪检验了不同浓度β-乳球蛋白对丙烯酰胺的抑制情况,并运用分子对接方法探究β-乳球蛋白与丙烯酰胺相互作用可能的结合位点与结合方式,为探究β-乳球蛋白与丙烯酰胺同时摄入时降低丙烯酰胺对人体负面影响的可能性提供了理论基础。
