磷脂酰肌醇-3激酶和组蛋白去乙酰化酶双靶点抑制剂CUDC-907对急性髓系白血病细胞体内、体外活性的影响
2021-08-20王月莉
王月莉,董 曼
(铜川市人民医院血液科,陕西 铜川 727100)
急性髓系白血病(Acute myeloid leukemia,AML)是一种起源于血液系统造血干细胞的恶性增殖性疾病,表现为干细胞出现异常增殖、分化受阻、积聚,抑制机体正常造血功能,导致贫血、出血、淋巴结肿大等症状,病因多为基因突变、染色体异常等,且具有病死率高、预后不良等特点[1]。2009年我国肿瘤地区登记白血病发病率占全部恶性肿瘤发病的2.02%,病死率占全部恶性肿瘤死亡例数的2.40%[2],每10万人中有3~5人患有该病,且呈逐年上升趋势[3]。白血病一般分为四大类,分别是急、慢性髓系白血病(AML/CML)和急、慢性淋巴细胞白血病(ALL/CLL),其中AML占急性白血病的80%以上[4],若不进行干预患者的生存期少于10个月,目前的治疗方式一般为阶段性化疗和造血干细胞移植。研究[5-6]表明,约2/3老年人对化疗耐受性差且并发症多,长期生存率不足50%。目前治疗药物多为小分子靶向抑制剂,如Bcl-2、FLT-3 等,但仍存在耐药性问题。因此,寻找治疗AML的新靶点、新药物是临床研究的主要方向。PI3K/AKT 和 Ras/Raf/MEK/ERK 是研究较广泛的肿瘤细胞活性相关的两条通路,可通过下调Mcl-1且上调Bim抑制肿瘤细胞的活性[7]。本实验分别考察磷脂酰肌醇3激酶(Phosphatidylinositol 3-kinase,PI3K)和组蛋白去乙酰化酶(Histone deacetylases,HDAC)的共同抑制剂CUDC-907在体内和体外两种情况下作用于AML细胞时细胞活性的变化情况,为临床开发新的AML治疗靶点、药物提供实验依据。
1 材料与方法
1.1 实验材料 急性髓系白血病AML细胞株Kasumi-1、HL-60及正常人骨髓细胞购于中国医学科学院基础医学研究所基础医学细胞中心,NSG-SGM3免疫缺陷小鼠(32只,雌雄各半,杰克森实验室)。胎牛血清(125 ml,美国Gibco公司),CUDC-907试剂(5 mg,美国Selleck Chemicals公司),Trizol试剂(100 ml,北京Solarbio科技有限公司),Luciferase (10 mg/50 mg,上海甄准生物科技有限公司)。实时定量基因扩增荧光检测Q-PCR仪(QuantStudio 5,德国赛默飞公司),高速离心机(TD-5M,山东博科科学仪器有限公司),酶标仪(Multiskan FC,德国赛默飞公司),流式细胞仪(Cyto-FLEX,贝克曼库尔特),反转录试剂盒、细胞凋亡检测试剂盒均购自德国赛默飞公司。
1.2 细胞培养 将急性髓系白血病AML细胞株Kasumi-1、HL-60及正常人骨髓细胞从液氮罐中取出,置于37 ℃水浴箱中解冻。完全融化后,吸取冻存液于含15%胎牛血清的培养液中,于37 ℃、含氧量95%、湿度饱和的培养箱中培养,每2~3 d更换1次培养液,显微镜下观察细胞处于对数生长期时可开展实验。
1.3 RNA逆转录和Q-PCR扩增 取上述对数生长期培养的Kasumi-1、HL-60细胞株以及正常人骨髓细胞,铺满整个96孔培养板[(3~5)×103个/孔],进行转染,每孔100 μl培养液,分别加入0、2 μmol/L的CUDC-907,将所有培养板分成五组,每组平行3孔,置于37 ℃、含氧量95%、湿度饱和的培养箱中培养48 h后每孔避光加人10 μl的荧光素底物Lueiferin,酶标仪测定各孔悬液荧光强度。同时,另取上述细胞转染于24孔培养板上,加入上述浓度CUDC-907抑制剂,48 h后,用Trizol试剂提取RNA进行反转录,Mcl-1上游引物5’- CACGCCGAGTTCTCGATCGT-3’;下游引物 5’-CTACGGCATCCATGTATCCA-3’;Bim上游引物5’-GCTACCCTGATGTGAAGTCT-3’;下游引物5’-GCTCAGCATACGTCTAGCTG-3’;Q-PCR扩增仪检测PI3K、HDAC表达水平的变化情况。
1.4 CUDC-907对细胞凋亡的影响 取上述对数生长期培养的Kasumi-1、HL-60细胞株以及正常人骨髓细胞,铺满整个96孔培养板,加入0、2 μmol/L的CUDC-907,于48 h后收集细胞,Annexin V/PI染色法处理,用流式细胞仪进行分析,记录双阴性细胞的比例。
1.5 AML小鼠模型的建立[8-9]选取8周龄NSG-SGM3免疫缺陷小鼠32只,雌雄各半,随机分为两组,16只/组。取对数生长期的Kasumi-1,按照1∶5的剂量制成细胞悬液,每组小鼠经尾静脉注射Kasumi-1细胞悬液125 μl,建立AML小鼠模型。各组每天分别灌胃0、2 μmol/L的CUDC-907,每天观察小鼠毛色、活动情况、二便等状况。
1.6 CUDC-907对AML小鼠体内细胞活性的影响 待上述AML小鼠出现饮食不良、活动受限、贫血等癌症转移症状时,对小鼠进行安乐死处理,收集小鼠骨髓细胞,测定小鼠细胞活性变化及相关蛋白的表达情况。
1.7 统计学方法 应用SPSS 24.0统计学软件分析实验数据,计量资料采用均数±标准差表示,行t检验,P<0.05表明差异具有统计学意义。
2 结 果
2.1 CUDC-907对体外AML细胞增殖的影响 采用Q-PCR法比较AML细胞的增殖情况,结果表明,Kasumi-1和HL-60细胞株的荧光强度、Mcl-1表达量高于正常人骨髓细胞,Bim低于正常人骨髓细胞,差异均具有统计学意义(均P<0.05);使用2 μmol/L CUDC-907与未使用CUDC-907相比能降低Kasumi-1、HL-60 细胞的荧光强度、Mcl-1的表达水平,升高Bim表达水平,差异均具有统计学意义(均P<0.01)。见表1。

表1 CUDC-907对体外AML细胞增殖的影响
2.2 CUDC-907对体外AML细胞凋亡的影响 采用Annexin V/PI双染色法测定CUDC-907对Kasumi-1和HL-60细胞凋亡的影响,结果表明,使用2 μmol/L CUDC-907处理AML细胞株Kasumi-1和HL-60与未使用CUDC-907相比双阴性细胞比例明显降低,差异均具有统计学意义(均P<0.01),见表2。
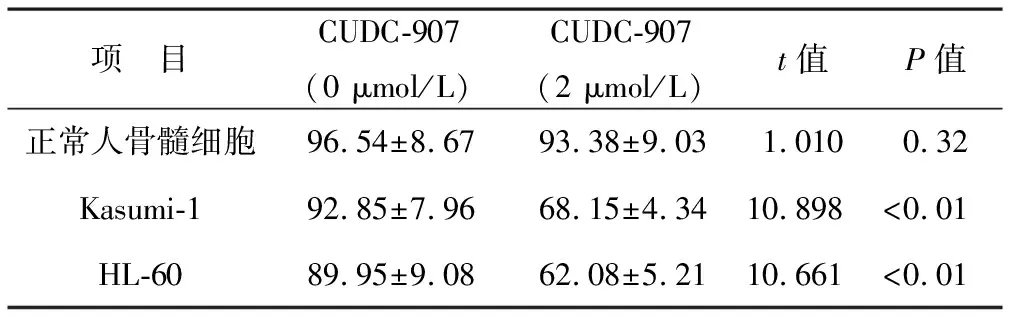
表2 CUDC-907对体外AML细胞凋亡的影响(%)
2.3 CUDC-907对AML小鼠体内骨髓细胞增殖的影响 采用Q-PCR法比较正常小鼠骨髓细胞、AML小鼠细胞的增殖情况,结果表明,AML小鼠细胞荧光强度、Mcl-1表达量高于正常小鼠骨髓细胞,Bim低于正常小鼠骨髓细胞,差异均具有统计学意义(P<0.05);使用2 μmol/L CUDC-907与未使用CUDC-907相比能降低小鼠AML细胞的荧光强度、Mcl-1的表达水平,提升Bim表达水平,差异均具有统计学意义(P<0.01)。见表3。

表3 CUDC-907对AML小鼠体内骨髓细胞增殖的影响
2.4 CUDC-907对AML小鼠体内骨髓细胞凋亡的影响 采用Annexin V/PI双染色法测定AML小鼠骨髓细胞在2 μmol/L CUDC-907下培养48 h后双阴性细胞的比例发现,结果表明,2 μmol/L CUDC-907处理AML小鼠细胞与未使用CUDC-907组相比双阴性细胞比例显著降低,差异均具有统计学意义(P<0.01),见表4。

表4 CUDC-907对AML小鼠体内骨髓细胞凋亡的影响(%)
3 讨 论
AML约占成人白血病发病率的80%,是对人类健康威胁最为严重的恶性血液系统疾病。目前治疗方式以化疗为主,60%~80%患者可缓解病情,但复发率仍高达30%~40%,且多数化疗药物存在耐药性机制治疗效果并不理想。白血病治疗药物的耐药性是多种机制综合作用的结果,主要涉及的耐药机制有药物外排、药物解毒、细胞凋亡抵抗、DNA 损伤修复等多个方面[10]。PI3K/AKT 和Ras/Raf/MEK/ERK是目前为探索AML治疗药物研究较多的信号通路[11-13],且PI3K和HDAC在多种癌组织中表达较高,CUDC-907作为PI3K和HDAC的双抑制剂治疗AML的具体作用机制有待研究,AML相关的小分子靶点如Bcl-2、FLT-3、Mcl-1和Bim[14-15],在CUDC-907治疗AML过程中扮演的角色以及是否存在耐药性的风险尚不清楚[16]。因此,本研究考察CUDC-907对体外、体内AML细胞活性的影响及其作用机制,为寻找新的AML作用靶点、治疗药物延长患者生命周期、提高存活率提供实验依据。
首先体外Q-PCR结果发现,Kasumi-1和HL-60细胞与正常人骨髓细胞相比荧光强度、Mcl-1表达量明显升高,而Bim的表达水平降低,提示两种AML细胞株与正常人骨髓细胞相比增殖能力强、凋亡能力弱,表明Mcl-1、Bim是骨髓细胞增殖、凋亡的关键因子。2 μmol/L CUDC-907下培养Kasumi-1和HL-60细胞48 h后发现使用2 μmol/L CUDC-907与未使用CUDC-907相比能显著降低Kasumi-1、HL-60 AML细胞的荧光强度、Mcl-1的表达水平,而使得Bim表达水平显著升高。Ferro等[17]研究发现PI3K/AKT和Ras/Raf/MEK/ERK信号通路中,AKT可促进细胞凋亡蛋白Mcl-1发生转录,当PI3K过表达时,促使Mcl-1上调从而抑制细胞凋亡、促进肿瘤的生长;Crysandt等[18]研究发现PI3K和HDAC抑制剂对人乳腺癌细胞的杀伤作用与下调Mcl-1和上调Bim有关,说明CUDC-907通过下调Mcl-1、上调Bim抑制Kasumi-1和HL-60细胞增殖。Annexin V/PI双染色结果发现CUDC-907作用于AML细胞使得AML双阴性细胞的比例显著降低,诱导AML细胞株凋亡。Stefan等[19]发现62%的神经胶质瘤细胞中Bim的表达水平低于正常细胞,HAT通过使CoA中的乙酰基发生转移,DNA聚集促进基因转录,癌细胞异常增殖导致HDAC过表达,使得组蛋白去乙酰化水平升高、促细胞凋亡因子Bim表达受到抑制。说明CUDC-907诱导AML细胞(Kasumi-1和HL-60)的凋亡的作用与上调Bim明显相关。
AML小鼠模型体内试验结果表明,AML能显著降低AML小鼠骨髓细胞的荧光强度,Mcl-1水平与对照组相比大幅降低,Bim水平较对照组提升,Annexin V/PI双染色结果显示AML小鼠细胞凋亡水平显著增加,差异有统计学意义。Courtney等[20]发现CUDC-907在胰腺癌细胞凋亡过程中参与Ras/Raf/MEK/ERK下游因子Bim的表达,诱导细胞凋亡。Katherine等[21]通过考察PI3K/AKT通路抑制剂对AML小鼠体内药代动力学特点发现,该抑制剂在抑制肿瘤生长方面表现出良好的药代动力学特点,该研究结果从侧面印证了体内作用机制的准确性。由此可见,CUDC-907对AML小鼠细胞增殖、凋亡的生理作用与体外情况一致,均能通过下调Mcl-1和上调Bim抑制AML细胞增殖,诱导其凋亡。
综上所述,通过考察CUDC-907在体内和体外条件下对AML细胞株Kasumi-1和HL-60增殖、凋亡的影响,结果表明CUDC-907对细胞的抑制增殖、诱导凋亡的作用与PI3K/AKT 和Ras/Raf/MEK/ERK信号通路密切相关,其作用机制可能与抑制Mcl-1蛋白和促进Bim表达有关。因此,PI3K和HDAC的双抑制剂CUDC-907可用于临床治疗AML的药物,其作用机制仍有待进一步探索。
