适用于生物人工肝的3种不同肝细胞的增殖能力及代谢功能的比较研究
2021-08-19李建州李晓青李兰娟
李建州 李晓青 杨 英 李兰娟
肝衰竭病情危重,病死率高,常规内科治疗效果很不理想[1,2]。人工肝支持系统是目前临床治疗肝衰竭的最重要手段之一,而以培养肝细胞为基础的生物人工肝(bioartificial liver,BAL)由于结构和功能更接近正常肝脏,完全替代肝脏的合成、代谢解毒等功能,成为近年来研究的热点,有望为肝衰竭的临床治疗提供新的途径[3,4]。
目前国外已有多个BAL系统进入临床试验阶段,但达到真正的大规模临床应用仍有很多问题需要解决,其中最关键的是如何获得足够数量、高活性且功能良好的肝细胞[5,6]。本研究以Huh7细胞、永生化人源性HepLi3细胞为研究对象,以C3A细胞为对照,比较3种细胞的增殖能力及合成、代谢功能,评估其作为生物人工肝细胞源的潜力。
材料与方法
1.细胞系及主要试剂:C3A细胞系和Huh7细胞系购自美国标准生物品收藏中心;HepLi3细胞系由传染病国家重点实验室建立并提供;高糖DMEM培养基、胎牛血清购自美国英杰生命技术有限公司;MTT试剂盒购自瑞士Roche公司;白蛋白检测试剂盒购自美国Bethyl Laboratories公司;尿素检测试剂盒购自美国BioAssay System公司;CYP3A4检测试剂盒、CYP1A2检测试剂盒购自美国Promega公司;Trizol试剂购自美国英杰生命技术有限公司;荧光定量PCR试剂盒购自日本TaKaRa生物株式会社;CYP1A2、CYP2E1、CYP3A4一抗抗体购自上海艾博抗贸易有限公司;荧光二抗购自美国R&D Systems公司。
2.细胞培养及生长曲线实验:3种肝细胞均用DMEM(含10%胎牛血清)培养基于37℃、5% CO2培养箱培养。将3种细胞以每孔2000个细胞接种于96孔板上,各设置3个副孔,分别在第0、24、48、72h进行MTT检测。在各孔加入10μl的MTT溶液,于培养箱中孵育4h,加入溶解液后孵育过夜,用酶联检测仪检测595nm波长下的吸光度值,绘制生长曲线。
3.荧光定量PCR分析:在同样的培养条件下,用胰酶消化细胞,离心获取细胞,采用Trizol法提取3种肝细胞的总RNA,反转录成cDNA,应用ABI7500荧光定量PCR仪进行反应,数据以2-ΔΔCt进行分析。PCR引物详见表1。

表1 PCR引物序列
4.免疫荧光蛋白分析:用4%的多聚甲醛室温固定细胞20min,PBS洗涤后用0.25% TritonX-100室温处理细胞30min,PBS洗涤后用2.5% BSA封闭1h,稀释的一抗4℃孵育过夜,PBS洗涤后用稀释的二抗避光孵育60min,PBS洗涤后在荧光显微镜下拍照,目标蛋白显示为胞质的绿色荧光,细胞核为红色荧光,用Image J软件进行荧光吸光度分析。
5.肝细胞合成与代谢功能的检测:将3种细胞接种于12孔板上,设置3个复孔,适应性培养24h后更换培养基继续培养24h,留取上清按试剂盒说明书分别进行白蛋白、尿素含量的检测。按试剂盒说明书采用荧光底物法分别进行CYP1A2、CYP3A4代谢活性的检测,最终结果以培养孔细胞总蛋白标准化。
6.肝衰竭血浆对3种肝细胞活性的影响:取笔者医院住院乙肝相关慢加急性肝衰竭患者血浆置换时分离的血浆(相关检测指标如下:总胆红素388μmol/L,直接胆红素胆红素320μmol/L,凝血酶原活动度25%,血氨106μmol/L,HBV-DNA 3.85E+007IU/ml),将3种细胞以每孔2000个细胞接种于96孔板上,各设置3个副孔,培养24h后更换培养基为肝衰竭血浆,以正常培养基为对照,继续培养24h后用MTT法检测细胞活性。

结 果
1.3种肝细胞的形态及生长曲线:3种肝细胞形态虽略有不同,但均呈多边形或不规则形,边界清楚,细胞核较大,核膜清楚,胞质丰富,与正常肝细胞类似。3种肝细胞均具有良好的增殖能力,生长曲线均呈S型,24~48h开始进入对数生长期。在24h后,HepLi3细胞的增殖能力明显强于C3A细胞和Huh7细胞(P<0.05,图1)。

图1 3种肝细胞的形态(×200)及生长曲线A.C3A细胞;B.Huh7细胞;C.HepLi3细胞;D.3种肝细胞的生长曲线;与C3A细胞比较,*P<0.05;与Huh7细胞比较,#P<0.05
2.3种肝细胞的功能基因mRNA的表达:在mRNA表达层面,3种肝细胞比较,C3A细胞CYP2E1的表达水平最高(P<0.05);Huh7细胞GST、CYP1A2、CYP3A4的表达水平最高,ALB的表达水平最低(P<0.05);HepLi3细胞ALB、GST的表达水平与C3A细胞相当,但CYP1A2、CYP2E1、CYP3A4的表达水平最低(P<0.05,图2)。

图2 3种肝细胞功能基因mRNA的表达水平与C3A细胞比较,*P<0.05;与Huh7细胞比较,#P<0.05
3.3种肝细胞代谢功能基因蛋白的表达:在蛋白表达层面,3种肝细胞比较,C3A细胞CYP2E1的表达水平最高(P<0.05);Huh7细胞CYP3A4的表达水平最高。HepLi3细胞CYP2E1、CYP3A4的表达水平与C3A细胞相当;3种肝细胞CYP1A2的表达水平比较,差异无统计学意义(P>0.05,图3)。
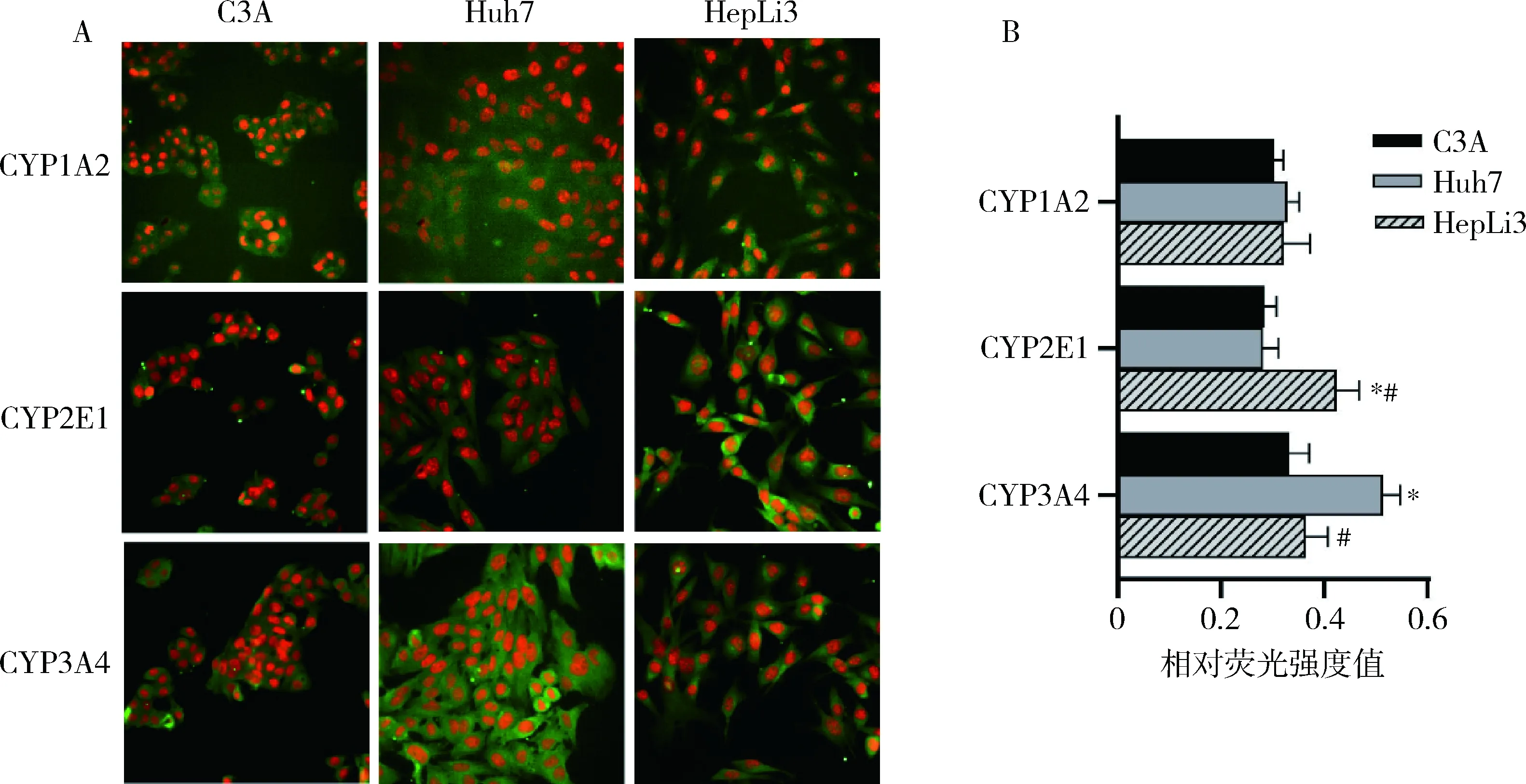
图3 3种肝细胞功能基因蛋白的表达水平A.免疫荧光染色图(×200),目标蛋白显示为胞质绿色荧光,细胞核红色荧光;B.相对荧光强度值的比较;与C3A细胞比较,*P<0.05;与Huh7细胞比较,#P<0.05
4.3种肝细胞的合成及代谢功能的比较:3种肝细胞比较,C3A细胞白蛋白合成功能最强(P<0.05);Huh7细胞的CYP1A2代谢活性最高;HepLi3细胞的CYP3A4代谢活性最高(P>0.05);3种肝细胞尿素的合成功能比较差异无统计学意义(P>0.05,图4)。
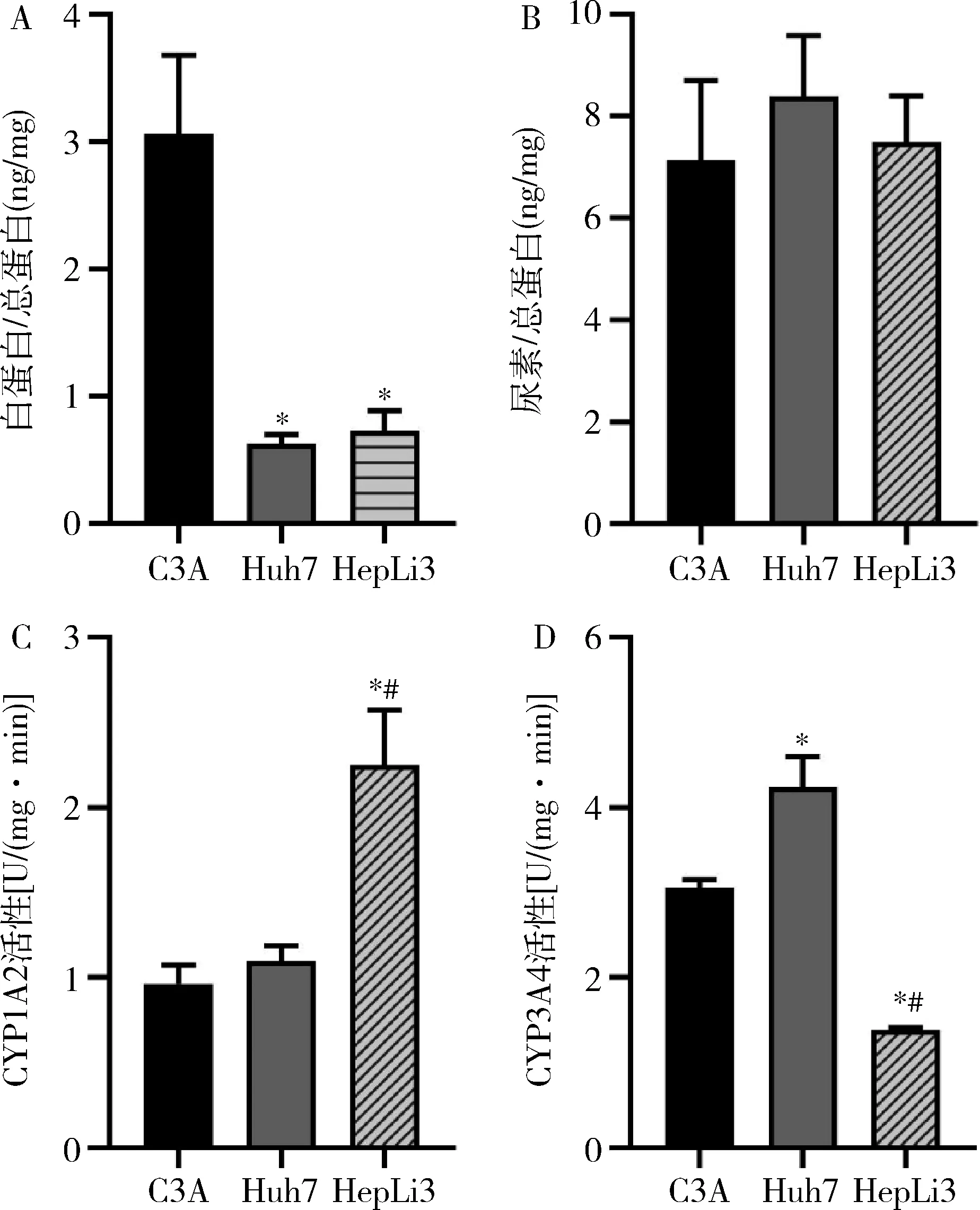
图4 3种肝细胞的合成及代谢能力的比较A.白蛋白合成功能;B.尿素合成功能;C.CYP1A2代谢活性;D.CYP3A4代谢活性;与C3A细胞比较,*P<0.05;与Huh7细胞比较,#P<0.05
5.肝衰竭血浆对3种肝细胞活性的影响:在培养24h后,与培养基组比较,肝衰竭血浆组肝细胞的活性无明显下降(P>0.05,图5)。

图5 肝衰竭血浆对3种肝细胞活性的影响
讨 论
BAL发挥治疗作用主要依赖于反应器中的肝细胞,肝细胞源是目前制约BAL研发的关键环节。理想的肝细胞源应具有以下特点:①易于获取且能够体外培养条件下扩增;②具有良好的正常人肝细胞生理功能;③具有良好的生物安全性。理论上,正常人原代肝细胞生理功能及安全性最好,但是肝脏来源短缺及原代肝细胞无法长期体外培养及增殖限制了其临床应用。为了寻找易于扩增的高活性、功能良好的肝细胞源,国内外研究者进行了积极的探索,其中以人肝肿瘤源性C3A细胞研究最多,该细胞不仅具有较好的增殖能力,而且能够较好地保持肝细胞合成及代谢、解毒功能[7~13]。以该细胞为基础的体外肝脏支持系统(extracorporeal liver assist device,ELAD)经过多年的研发,已在欧美多个国家开展三期临床试验,是目前最成功的BAL系统[14,15]。本研究选用的Huh7细胞也是一种人肝肿瘤源性细胞,目前在BAL研究中尚未见报道。李兰娟团队前期应用SV40大T抗原基因的反转录病毒感染原代人肝细胞,成功构建了多株永生化人源性肝细胞系,既保持了人肝细胞的生物特性和功能,且增殖能力强,为BAL提供了更多的细胞源选择[16]。本研究选用的HepLi3细胞为其中的一株细胞系。
本研究通过比较发现,3种肝细胞在常规的培养条件下均具有良好的增殖能力,72h能够扩增3~4倍。其中HepLi3的增殖能力优于C3A细胞、Huh7细胞,更加适合大规模培养,在短时间内为BAL治疗提供足够数量的肝细胞。在功能基因的表达上,本研究从mRNA、蛋白表达两个层面进行检测,结果显示白蛋白合成及多种细胞色素P450(cytochromeP450,CYP450)家族相关基因在3种肝细胞中均有一定程度的表达。虽然部分基因的表达差异与功能的差异并不完全一致,但也在一定层面体现了3种细胞部分保持了肝细胞原有的生物学特性。在功能评估上,本研究发现C3A细胞的白蛋白合成能力最好,这与既往的研究报道一致。而Huh7细胞的CYP1A2代谢活性最高,HepLi3细胞的CYP3A4代谢活性最高。
CYP450是主要分布于肝微粒体的药物主要代谢酶,参与脂肪酸、类花生四烯酸等多种内源性物质及药物、毒物、致癌物等外源性化合物的代谢,与肝脏的代谢解毒功能密切相关[17,18]。在临床治疗上,BAL的合成功能可以通过外源性补充白蛋白、血浆等来解决,代谢解毒功能才是BAL发挥作用的关键。本研究通过多个层面的评估发现,Huh7细胞、HepLi3细胞在代谢解毒方面相较于C3A细胞可能更具优势,但还需要进一步系统全面的评估。
肝衰竭患者体内存在大量毒性物质积聚,可能会在BAL治疗过程对反应器中肝细胞活性产生不利影响[19]。本研究发现在肝衰竭血浆中培养24h后,3种肝细胞的活性均没有显著下降,为其功能发挥提供的基本保证。综上所述,Huh7细胞、HepLi3细胞具有良好的增殖能力及合成、代谢功能,有望为BAL提供良好的细胞源。
