泛素连接酶Cul7调控人滋养层细胞Notch1蛋白稳定性
2021-08-19范冰凌林欣欣付杰军
焦 寒 徐 阳 范冰凌 林欣欣 付杰军
胎盘发育和功能障碍可导致子痫前期、胎儿生长受限、复发流产等妊娠相关疾病[1,2]。3M综合征(OMIM#273750)是一种罕见的以严重宫内发育迟缓和出生后生长迟缓为主要特征的一种常染色体隐性遗传病[3]。目前已报道的3M综合征的突变基因是定位在常染色体p21.1上的Cul7基因,含有26个外显子,编码1698个氨基酸[4]。泛素连接酶Cul7基因敲除小鼠的主要表型是胎儿宫内发育迟缓,胎盘发育和结构异常[5]。已报道3M综合征患者Cul7基因存在40多个不同位点的错义突变或无义突变[6]。近年来还发现3M综合征患者有常染色体2q35~36.1上的OBSL1(ob-scurin-like 1)基因突变和19q13.2~q13.32上的CCDC8(coiled-coil domain-containing protein 8)基因突变[7,8]。而Cul7是主要致病基因,已报道3M综合征中67%有Cul7基因突变,28%是OBSL1基因突变,5%是CCDC8突变。3M突变基因可以形成3M复合体(FBXW8-Cul7-OBSL1-CCDC8)调控基因组稳定性[6]。然而,Cul7对小鼠和人胎盘发育的调控机制还不清楚。
Notch信号通路与胚胎发育和成人器官组织稳态密切相关,尤其对于上皮干细胞和细胞分化起重要作用[9]。Notch受体是单一跨膜蛋白,由功能性胞外(NECD)、跨膜(TM)和胞内(NICD)结构域组成,NICD为Notch受体的活化形式[10]。哺乳动物有4种Notch受体(Notch1、Notch2、Notch3、Notch4)。在妊娠早期,Notch1主要表达在增殖活跃的近端滋养层柱细胞,并在绒毛外滋养层细胞(EVT)形成过程中表达迅速降低,在妊娠12周的胎盘绒毛滋养层细胞滋养层柱几乎检测不到Notch1的表达[11]。Notch1抑制滋养层细胞的侵袭和迁移,在滋养层细胞自发融合过程中维持E-cadherin的表达,抑制人绒毛膜促性腺激素β(hCGβ)表达及滋养层细胞融合[9]。笔者前期报道了Cul7在细胞滋养层柱高表达,过表达Cul7能引起绒毛癌细胞JEG3上皮-间质转化(EMT)类似的变化[5]。本研究通过探索Cul7对Notch1蛋白稳定性的影响,揭示Cul7在胎盘发育中的可能调控作用。
材料与方法
1.细胞株:小鼠胚胎成纤维细胞(MEF)由美国哈佛医学院贝斯以色列女执事医疗中心病理系魏文毅教授惠赠。人绒毛外滋养层细胞HTR8/SVneo由中国科学院动物研究所干细胞与生殖生物学国家重点实验室王红梅研究员惠赠。
2.主要试剂:胎牛血清购自维森特生物技术(南京)有限公司,RPMI1640高糖培养基、DMEM高糖培养基、opti-MEM减血清培养基购自美国Gibco公司;青霉素链霉素混合液100×购自北京索莱宝科技有限公司;慢病毒干扰载体PGLV3/H1/GFP+Puro穿梭质粒和包装质粒pGag/Pol、pRev、pVSV-G,慢病毒包装系统干扰Cul7表达及空载病毒液购自上海吉玛制药技术有限公司;BCA试剂盒购自上海碧云天生物技术有限公司,RIPA buffer购自美国Sigma公司;转染试剂LipofectAMINE3000、TRIzol Reagent、PierceTMPhosphatase Inhibitor Mini Tablets和PierceTMProtase Inhibitor Mini Tablets、EDTA-free购自美国Invitrogen公司;High Capacity cDNA Reverse Transcription Kits反转录试剂盒、PowerUpTMSYBRTMGreen Master Mix试剂盒、anti-HA Magnetic Beads购自美国Thermo公司。
3.抗体:兔抗人Notch1(3439)、兔抗人Notch3(5276)、鼠抗人Myc(2276)、兔抗人Jagged1(2620)、兔抗人IRS-1(3407)、兔抗人survivin(5875)、兔抗人β-catenin(8480)、兔抗人HES1(11988)、兔抗人cyclinD3(2936)、兔抗人P21(2947)、兔抗人Notch4(2423)、兔抗人β-tubulin(2128)、鼠抗人β-actin(3700)、鼠抗人HA(2367)和羊抗鼠IgG(7076)、羊抗兔IgG(7074)购自美国Cell Signaling Technology公司;兔抗人Cul7(C1743)、兔抗人Flag(SAB4301135)购自美国Sigma公司;鼠抗人TRIM24(ab70560)购自艾博抗(上海)贸易有限公司。
4.细胞培养:HTR8/SVneo细胞培养条件为含10%胎牛血清、100U/ml青霉素和0.1mg/ml链霉素的RPMI1640培养基;MEF细胞和293T细胞培养条件为含10%胎牛血清、100U/ml青霉素和0.1mg/ml链霉素的DMEM培养基,细胞在37℃、5% CO2培养箱中恒温培养。
5.质粒构建:根据pNL-IRES2-EGFP-NICD1的功能编码区序列和载体p3×FLAG-CMV-10序列特点,选择EcoRⅠ和BamHⅠ作为双酶切位点,设计PCR扩增引物序列,Notch1上游引物:5′-CGAATTCAGTGCTGCTGTCCCGCAAGCGCCGGCG-3′,下游引物:5′-TAGCGGATCCTCACTTGAAGGCCTCCGGAATGCGGGCGATC-3′。通过PCR法扩增目的序列,采用1%的琼脂糖凝胶对PCR最终产物电泳,在紫外线灯下切取含目的片段的凝胶,回收并纯化目的片段。将连接产物转化至感受态细胞DH5α,选取7个单克隆菌落,取少量行PCR鉴定,取阳性克隆的菌落接种于LB液体培养基中,提取质粒,送上海生工生物工程公司测序。HA-Cul7全长及不同长短的质粒、各Cullin蛋白家族成员Myc-Cul1、Myc-Cul2、Myc-Cul3、Myc-Cul4A、Myc-Cul4B、Myc-Cul5、Myc-Cul7质粒及HA-FBXW7质粒由美国哈佛医学院贝斯以色列女执事医疗中心病理系魏文毅教授惠赠。
6.脂质体转染:取对数生长期细胞接种到60mm培养皿中,待皿中细胞生长到90%以上汇合度时,按照LipofectAMINE 3000操作说明书进行转染。将10μl P3000TM加入300μl opti-MEM中混匀,将DNA预混液加入稀释的P3000TM孵育15min形成DNA-脂质体复合物,均匀滴入培养皿后在37℃、5%CO2培养箱中孵育48h收集蛋白。
7.慢病毒介导shRNA干扰HTR8/SVneo细胞Cul7的表达:构建慢病毒载体shRNA序列为:Cul7shRNA 5′-GCACATGTTGAGTAGTCCTGATTAT-3′和Cul7shRNA 5′-ATAATCAGGACTACTCAACATGTGC-3′,同时构建阴性对照shRNA序列为5′-TTCTCCGAACGTGTCACGT-3′。将上海吉玛生物有限公司构建的慢病毒表达载体shCul7和PGLV3/H1/GFP+Puro穿梭质粒、包装质粒pGag/Pol、pRev、pVSV-G导入293T细胞中培养48h和72h后收集上清进行病毒液浓缩并检测病毒的滴度达到1×109TU/ml。嘌呤霉素筛选稳定敲低Cul7的HTR8/SVneo细胞。
8.real-time PCR检测目的基因mRNA的表达:使用Trizol提取细胞总RNA并反转录获取cDNA。根据PowerUpTMSYBRTMGreen Master Mix试剂盒说明操作,引物序列如表1所示,总反应体系为25μl,反应条件为 50℃ 2min; 95℃预变性 2min,95℃变性 15s、60℃ 1min,40个循环。
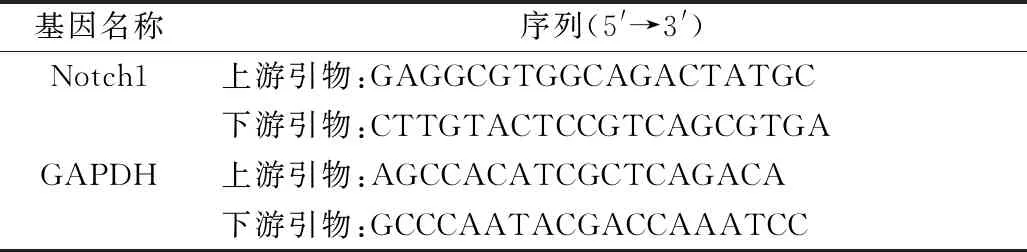
表1 引物序列
8.Western blot法检测目的基因蛋白的表达:使用RIPA裂解液提取细胞总蛋白,BCA蛋白定量法测蛋白浓度,蛋白裂解液与上样缓冲液按2∶1混合煮沸5min,上样50μg,进行SDS-PAGE电泳后转至PVDF膜,用含5%脱脂奶粉的TBST室温封闭1.5h后加入1∶1000稀释的一抗4℃孵育过夜,用TBST洗涤后加入1∶5000稀释的二抗室温孵育1h。TBST洗膜,加入ECL发光试剂利用化学发光成像系统显示结果。
9.免疫共沉淀检测蛋白相互作用情况:将Flag-Notch1重组质粒、HA-Cul7真核表达质粒和HA-FBXW7真核表达质粒通过脂质体转染导入HTR8/SVneo细胞,48h后使用温和蛋白裂解液裂解细胞,测定蛋白浓度,取1mg蛋白进行免疫共沉淀实验。将蛋白样品加入含蛋白酶抑制剂的细胞裂解液至500μl,并加入20μl anti-HA Magnetic Beads磁珠,在4℃旋转孵育4h,形成免疫复合物。用NETN缓冲液将磁珠洗涤3次,弃去缓冲液并加入50μl 2×SDS上样缓冲液,摇匀煮沸5min后7500r/min离心2min,将上清移入新试管中用于免疫印迹分析。免疫沉淀检测使用1∶1000稀释的兔抗人Flag和鼠抗人HA。

结 果
1.Notch1重组质粒的构建及鉴定:将含有人Notch1胞内段基因的重组质粒p3×FLAG-CMV-Notch1送上海生工生物工程公司进行测序鉴定,将得到的测序结果在NCBI提供的数据库进行序列比对,结果与预期一致,表明已克隆人全长Notch1基因,并成功构建重组真核表达质粒p3×FLAG-CMV-Notch1(图1中A、B)。将HA-Cul7全长及不同长截短片段的质粒、各Cullin蛋白家族成员Myc-Cul1、Myc-Cul2、Myc-Cul3、Myc-Cul4A、Myc-Cul4B、Myc-Cul5、Myc-Cul7及Flag-Notch1(NICD)真核表达质粒转染至HTR8/SVneo后收集细胞蛋白,Western blot法检测结果显示转染效率显著(图1中C、D)。

图1 p3×FLAG-CMV-Notch1质粒构建及测序鉴定A.质粒图谱;B.重组质粒测序图(部分);C. 转染pcDNA3-HA-Cul7全长及Cul7不同长短的截短质粒;D.转染各Cullin蛋白家族成员质粒
2.Cul7基因敲除小鼠胚胎成纤维细胞(MEF)Notch1蛋白表达升高:首先在MEF细胞中确定Cul7对Notch1的调控作用。Western blot法检测野生型MEF细胞和Cul7基因敲除MEF细胞中Notch受体Notch1、Notch3、Notch4及配体Jagged1的蛋白表达,结果显示敲除Cul7后Notch1蛋白(图2)及其下游靶基因HES1和P21蛋白表达增加。
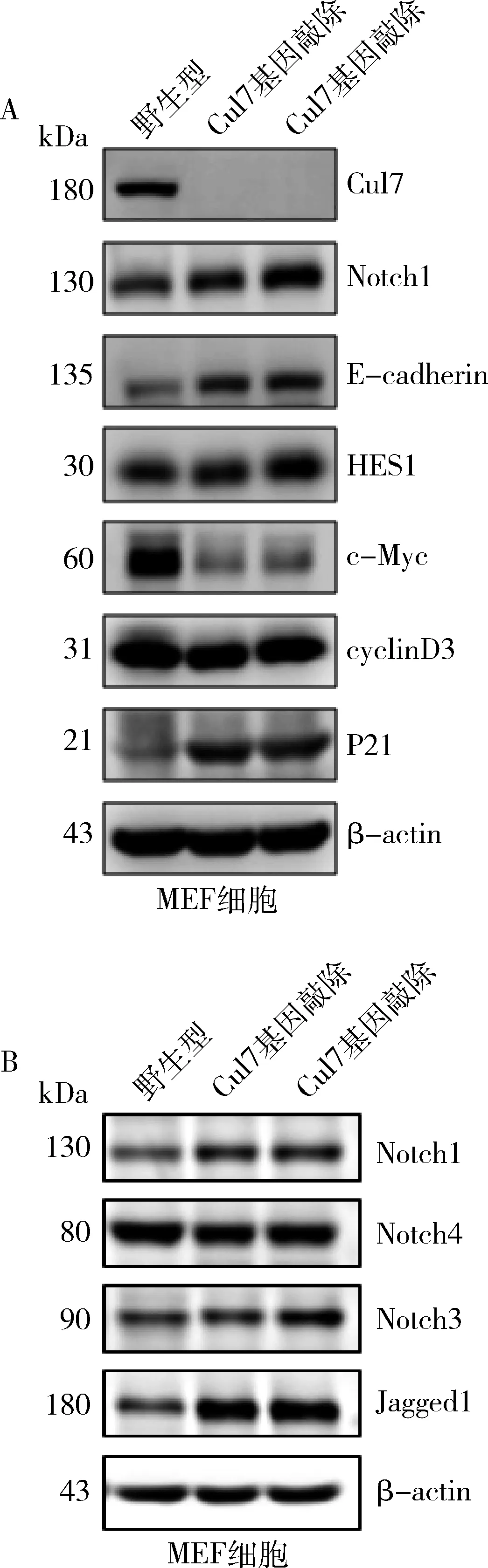
图2 Cul7基因敲除MEF细胞Notch1蛋白表达升高A.Notch1、HES1及P21蛋白表达增加;B.Notch1、Notch3及Notch4蛋白表达增加
3.Cul7负调控细胞滋养层细胞Notch1蛋白表达:使用Western blot法检测干扰及过表达Cul7的HTR8/SVneo细胞Notch1及其下游靶基因的蛋白表达。结果显示Cul7干扰效率显著,干扰Cul7后Notch1蛋白表达升高,其主要下游靶基因HES1和P21蛋白水平同样升高(图3A),而过表达Cul7使Notch1蛋白表达降低(图3中B、C)。通过real-time PCR方法进一步确定Cul7是否在转录水平调控Notch1表达。结果显示,与对照组比较,干扰Cul7的HTR8/SVneo细胞Notch1 mRNA水平差异无统计学意义(P=0.129,图3D)。

图3 Cul7抑制HTR8/SVneo细胞Notch1蛋白的表达A.干扰Cul7后Notch1蛋白表达;B、C.过表达Cul7后Notch1蛋白表达;D.干扰Cul7后Notch1 mRNA的表达水平
4.Cul7对Notch1蛋白稳定性的调控:通过使用蛋白酶体抑制剂MG132确定HTR8/SVneo细胞Notch1蛋白的泛素-蛋白酶体通路介导降解。不同浓度的MG132(0、0.1、0.5、1、2、4μmol/L)处理HTR8/SVneo细胞12h后收集蛋白,Western blot法检测结果显示,Notch1蛋白水平随MG132浓度增加而升高(图4A)。为了确定Cul7对Notch1蛋白的调控作用,将稳定干扰Cul7的HTR8/SVneo细胞使用终浓度为20μg/ml的放线菌酮(CHX)处理,收集不同处理时间的细胞蛋白(0、2、4、8、12h)。Western blot法检测结果显示,与对照组比较,干扰Cul7表达后Notch1蛋白降解半衰期延长(图4B)。Close 等[12]研究发现FBXW7可直接调控Notch1蛋白稳定性,笔者通过脂质体转染将Flag-Notch1、HA-Cul7和HA-FBXW7真核表达质粒导入细胞后使用Co-IP方法检测蛋白结合情况。Western blot法检测结果显示,FBXW7与Notch1结合,但Cul7蛋白与Notch1蛋白在人滋养层细胞中无结合(图4C)。

图4 Cul7对Notch1蛋白稳定性的影响A.蛋白酶体抑制剂MG132处理;B.放线菌酮处理,箭头所示为指向Notch1是位于下方的条带;C.Co-IP检测蛋白结合情况
讨 论
Cullin-RING泛素连接酶如Cul1、Cul3、Cul4B和Cul7在小鼠和人胎盘发育中具有重要调控作用[13,14]。Chabrun等[15]报道Cul7 mRNA在宫内迟缓发育(intrauterine growth retardation, IUGR)胎盘组织表达升高约10倍,在与子痫前期合并的IUGR组织表达升高约15倍。
Notch通路的异常可能是导致胎盘和滋养层功能异常妊娠疾病的发病机制[16]。Notch是绒毛外滋养层细胞(EVT)祖细胞标志物,在体外EVT形成过程中,检测到Notch活性降低,表明Notch可能与滋养层前体的维持和分化有关[9]。Notch1水平的精确调节对于成功着床和蜕膜化是至关重要的,人绒毛膜促性腺激素介导的Notch1诱导可促进子宫基质细胞的存活并启动蜕膜化,其中Notch1下调和NUMB上调是完成分化所必需的[17]。
本研究首先观察到Cul7基因敲除MEF细胞的Notch1蛋白表达升高,同样观察到干扰Cul7的HTR8/SVneo细胞中Notch1蛋白表达水平升高,而过表达Cul7后Notch1蛋白表达水平降低,提示Cul7在人滋养层细胞中负调控Notch1以及Notch1激活信号通路下游基因,是胎盘绒毛外滋养层细胞分化过程中新的Notch1负调控的关键因子。为了确定Cul7和Notch1的调控关系,笔者使用real-time PCR技术观察到,与阴性对照比较,干扰Cul7后Notch1 mRNA表达水平变化不显著,表明此机制非转录水平调控。在使用蛋白酶体抑制剂MG132处理后,发现Cullin蛋白表达水平受到抑制时,Notch1及其下游靶基因分子表达显著升高,提示Notch1在人滋养层细胞中可能受Cullin蛋白泛素化降解调控从而影响滋养层细胞的增殖和分化。使用放线菌酮处理后发现干扰Cul7使Notch1降解速率明显降低,提示干扰Cul7导致Notch1泛素化降解受阻,从而延长其蛋白降解的半衰期。
本研究在HTR8/SVneo细胞中导入Flag-Notch1质粒、HA-Cul7质粒和HA-FBXW7质粒,使用免疫共沉淀技术检测结果显示,外源性Cul7与Notch1无结合,提示Cul7在HTR8/SVneo细胞中可能通过协同其他泛素连接酶等间接作用抑制Notch1的蛋白表达。目前仍不清楚Cul7是泛素化降解Notch1还是抑制Notch1蛋白合成。Sun等[13]研究发现,Cul1异常介导Neddylation导致P21积累从而调节滋养层细胞增殖分化并导致复发性自然流产,表明NEDD8-Cul1介导的P21降解在滋养层的正常发育中起重要调控作用,那么Cul7有可能通过Cul1间接泛素化降解Notch1,此机制还需进行更深入的探索。
综上所述,本研究通过人滋养层细胞系采用蛋白质相互作用等分子生物学手段,研究Cul7泛素化修饰和降解Notch1的分子机制,明确了Cul7在人滋养层细胞通过调控Notch1蛋白半衰期从而影响其稳定性,进一步阐明了Cul7与Notch1的相互作用对滋养层细胞发育的调控和可能机制,可为胎儿生长受限及子痫前期和自然流产等妊娠疾病的研究提供新的思路和理论依据。
