lncRNA VIM-AS1靶向miR-126-5p调控肺癌细胞放射敏感性分子机制研究
2021-08-18马莉莎王嵘柴丽霞
马莉莎 王嵘 柴丽霞
肺癌(lung cancer)是世界上发病率最高的癌症,患者5年生存率<15%,放疗是其重要治疗手段之一,患者后期产生的放射耐受是影响临床治疗效果的主要原因之一[1,2]。越来越多的研究证实,lncRNA(long non-coding RNA)和miRNA(micro RNA)在肺癌组织、细胞或体液中表达异常,通过EMT等途径参与肺癌的发生发展、放化疗耐受、预后及靶向治疗等[3-5]。报道显示,lncRNA VIM-AS1(VIM antisense RNA 1,VIM-AS1) 在前列腺癌和结直肠癌中高表达,下调其表达可抑制癌细胞的增殖等过程[6,7]。本研究通过startBase预测发现,miR-126-5p可能是VIM-AS1的靶基因。miR-126-5p在肺腺癌组织和患者外周血中含量降低,与患者预后有关[8]。细胞凋亡是放疗诱导肿瘤细胞死亡的主要机制,细胞凋亡的增加利于增强放疗敏感性[9]。而VIM-AS1和miR-126-5p在提高肺癌放射敏感性中的作用及相互关系目前尚不清楚。本课题主要研究lncRNA VIM-AS1对A549细胞放射敏感性的影响,以及miR-126-5p在其中的作用,为肺癌临床放疗敏感性研究提供新的数据。
1 材料与方法
1.1 试剂与仪器 人正常肺上皮细胞BEAS-2B及人肺癌细胞A549、SPCA1和HCI-H596细胞购自中科院上海细胞库;胎牛血清(fetal bovine serum,FBS)和DMEM高糖培养基购自美国Gibco公司,牛血清白蛋白(Bovine Serum Albumin,BSA)、胰蛋白酶Trypsin购自Sigma-Aldrich公司;双荧光素酶报告系统(Dual-Luciferase Reporter Assay System)购自美国Promega公司;引物、miR-126-5p mimics(miR-126-5p)、miR-126-5p抑制剂(anti-miR-126-5p)、VIM-AS1干扰物(si-VIM-AS1)、空载体和对照物(miR-con、anti-NC和si-NC)及VIM-AS1突变型和野生型双荧光素酶载体购自上海吉玛制药技术有限公司;Lipofectamine 2000转染试剂、Total RNA提取试剂盒、real-time PCR 试剂盒、反转录试剂盒(RT-PCR)购自宝生物工程(大连)有限公司;Real-time PCR仪购自美国Bio-Rad公司;BCA蛋白试剂盒购自江苏凯基生物技术股份有限公司。
1.2 方法
1.2.1 细胞培养:将人正常肺上皮细胞BEAS-2B及人肺癌细胞A549、SPCA1和HCI-H596培养在含10% FBS的DMEM高糖培养液(添加100 U/ml青霉素和100 μg/ml链霉素)中,37℃ 5% CO2培养箱中培养,湿度95%,将细胞培养至对数生长期,消化传代。
1.2.2 细胞转染:收集对数生长期的A549细胞,用培养液将细胞稀释至1×106个/ml,以200 μl细胞/孔的密度接种于6孔板中,细胞培养至基本融合为一层时进行转染。根据Lipofectamine 2000转染试剂说明书进行转染操作,将不同的载体转染入培养好的A549细胞中,培养6 h后换成DMEM高糖完全培养基,转染48 h后收集细胞进行实验。根据转染载体进行分组:si-NC组和si-VIM-AS1组、miR-con组和miR-126-5p组、si-VIM-AS1+anti-NC组和si-VIM-AS1+anti-miR-126-5p组。qRT-PCR检测VIM-AS1和miR-126-5p的表达收集培养好的BEAS-2B、A549、SPC A1和HCI-H596细胞,用试剂盒提取细胞总RNA,测定浓度和纯度,然后按照反转录试剂盒说明书合成cDNA,以cDNA为模板按照 real-time PCR的说明书进行反应合成miR-126-5p和VIM-AS1,反应程序为:95℃ 2 min;95℃ 15 s、55℃ 40 s、72℃ 30 s,35个循环,用2-ΔΔCt方法进行数据分析。
1.2.3 克隆形成实验:测定放射处理后细胞存活分数收集转染后的对数生长期各组A549细胞,消化并计数,然后接种于6孔板,过夜培养。然后将细胞暴露于不同辐射剂量下(0、2、4、6、8 Gy)进行照射处理。辐射处理后细胞以500个/皿接种于细胞培养皿中,加入10 ml培养液混匀,培养10~14 d至出现肉眼清晰可见的细胞克隆,洗涤细胞2次,甲醛固定细胞,结晶紫染色,计数,细胞克隆数>50个为有效。根据单击多靶模型拟合细胞存活曲线,计算放射增敏比(SER)。细胞克隆形成率 = (克隆数平均值/铺板细胞总数)×100%,细胞存活分数(survival fraction,SF) = 受照射细胞克隆形成率/对照细胞克隆形成率)×100%。
1.3 流式细胞术测定细胞凋亡率 手机转染和(或)放射处理后培养48 h的各组A549细胞,接种于6孔板,培养72 h后弃去培养液,洗涤细胞并胰酶消化,离心收集细胞,按照 Annexin V/PI 凋亡试剂盒说明书进行操作,用流式细胞仪检测细胞凋亡率。
1.4 双荧光素酶报告实验 按照方法1.2.2培养A549细胞和转染,分别将构建好的VIM-AS1的野生型(WT-VIM-AS1)和突变型(MUT-VIM-AS1)双荧光素酶报告载体与miR-con或miR-126-5p共转染A549细胞,转染后培养48 h,收集细胞,将细胞裂解,离心收集裂解上清。发光仪检测荧光素酶活性,以海肾荧光素酶活性为内参照,计算相对萤火虫荧光素酶活性。

2 结果
2.1 肺癌细胞中VIM-AS1高表达miR-126-5p低表达 与正常肺上皮细胞BEAS-2B组比较,肺癌细胞A549、SPC A1和HCI-H596组中VIM-AS1含量均显著升高(P<0.05),miR-126-5p的含量均显著降低(P<0.05)。根据实验结果,选择A549进行后续实验。见表1。

表1 VIM-AS1 和miR-126-5p 在肺癌细胞中的表达
2.2 沉默VIM-AS1对肺癌细胞A549的放射敏感性的影响 沉默lncRNA VIM-AS1后,克隆形成实验结果表明,随着照射剂量的增加,与si-NC组比较,si-VIM-AS1组A549的细胞存活分数逐渐下降,且差异有统计学意义(P<0.05),放射增敏比为1.776。选择具有显著差异且对细胞伤害小的照射剂量2Gy进行后续实验。见表2、3,图1。

表2 沉默VIM-AS1 对A549 细胞的存活分数(% )的影响

表3 沉默VIM-AS1 后单击多靶模型的参数值

图1 沉默VIM-AS1对肺癌细胞A549的放射敏感性的影响
2.3 沉默VIM-AS1对辐射照射诱导的A549细胞凋亡的影响 与Control组和si-NC组比较,2 Gy处理后,si-VIM-AS1组的肺癌A549细胞凋亡率显著上升(P<0.05);与Control+Gy和si-NC+Gy组比较,si-VIM-AS1+Gy组A549细胞凋亡率也显著升高(P<0.05)。表明沉默VIM-AS1可增加肺癌A549细胞的放射敏感性并促进细胞凋亡。见图2,表4。

图2 沉默VIM-AS1对2 Gy辐射处理后HCT116细胞凋亡的影响
2.4 VIM-AS1负调控miR-126-5p的表达 startBase预测结果显示,miR-126-5p的序列中含有与VIM-AS1互补的核苷酸位点。双荧光素酶报告显示,与miR-con组比较,过表达miR-126-5p可下调野生型WT-

表4 沉默VIM-AS1 后6 组A549 细胞的凋亡率
VIM-AS1的萤火虫荧光素酶相对活性(P<0.05);而突变型MUT-VIM-AS1的萤火虫荧光素酶相对活性没有明显变化。qRT-PCR结果显示,下调VIM-AS1表达可上调miR-126-5p含量(P<0.05)。说明VIM-AS1靶向负调控miR-126-5p的表达。见图3,表5、6。

图3 VIM-AS1与miR-126-5p互补结合的核苷酸位点

表5 双荧光素酶试验验证VIM-AS1 与miR-126-5p 靶向结合

表6 lncRNA VIM-AS1 负调控miR-126-5p 的表达
2.5 VIM-AS1对miR-126-5p调控结肺癌细胞A549的放射敏感性的影响 为确认lncRNA VIM-AS1调控miR-126-5p,在沉默VIM-AS1的同时抑制miR-126-5p,结果表明,2Gy放射处理后,与si-VIM-AS1+anti-NC组比较,si-VIM-AS1+ anti-miR-126-5p+Gy组的A549细胞存活分数显著升高(P<0.05),细胞增敏比为0.598,细胞凋亡率显著降低(P<0.05),与2.2和2.3结果相反。说明抑制miR-126-5p表达可逆转沉默VIM-AS1对A549细胞放射敏感性和凋亡的作用。见表7、8,图4、5。
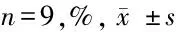
表7 抑制miR-126-5p 逆转了沉默VIM-AS1 对A549细胞放射敏感性的影响
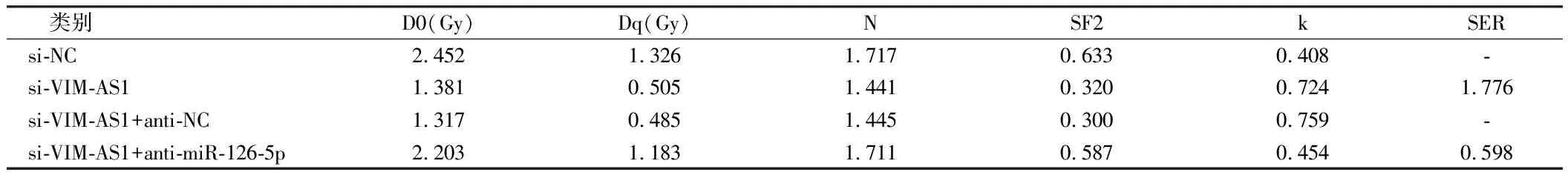
表8 抑制miR-126-5p 联合沉默VIM-AS1 后单击多靶模型的参数值
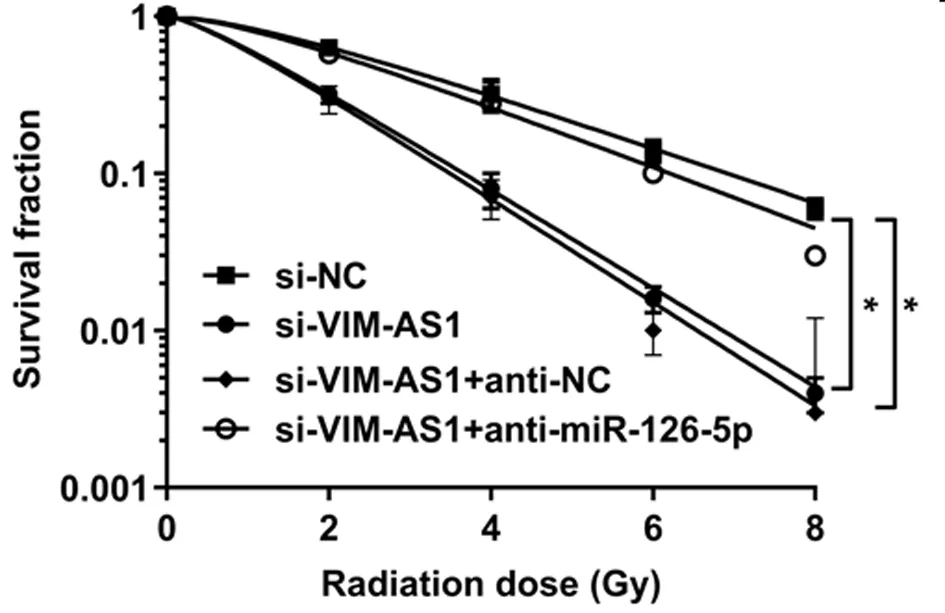
图4 沉默VIM-AS1增加肺癌细胞A549的放射敏感性
图5 抑制miR-126-5p逆转了沉默VIM-AS1对辐射照射A549细胞凋亡率的影响
3 讨论
多项研究表明,lncRNA可通过miRNA在肺癌的放射敏感性中发挥重要作用[10-12]。有研究发现,lncRNA VIM-AS1在前列腺癌中通过EMT调控癌细胞的增殖和侵袭[6],lncRNA VIM-AS1还通过EMT促进结直肠癌的进展和转移[7]。lncRNA VIM-AS1在2型糖尿病和子痫前期也发挥重要作用[13,14],但其在肺癌细胞中的表达及其对肺癌放射敏感性的作用尚不清楚。本研究结果表明,VIM-AS1在肺癌细胞A549、SPC A1和HCI-H596中含量均显著升高,不同放射剂量(0、2、4、6、8 Gy)处理A549细胞,细胞存活分数逐渐下降,用影响较小的2 Gy处理A549细胞,细胞凋亡率也显著升高,放射增敏比为1.776,说明沉默VIM-AS1可增强A549细胞放射敏感性并促进其凋亡,从而抑制肺癌细胞生长。
此外,本研究通过startbase预测发现,miR-126-5p与VIM-AS1存在结合位点,其可能是VIM-AS1的靶基因。因此,本研究假设VIM-AS1通过靶向miR-126-5p影响肺癌细胞的放射敏感性。miR-126-5p是miR-126的成熟形式,位于第9号染色体,是来源于EGFL-7的保守型内含子miRNA,主要在内皮细胞中表达,在多种癌症中异常表达,与肿瘤的发生发展密切相关[15]。miR-126-5p在胃癌细胞SGC-7901中可靶向EZH2增加胃癌细胞的放射敏感性[16]。miR-126-5p在非小细胞肺癌(NSCLC)中低表达,其过表达可抑制细胞中苹果酸脱氢酶1(MDH1)的酶活性、线粒体呼吸并导致细胞死亡[17]。且有研究表明,在NSCLC患者放疗敏感组中miR-126表达上调[18],miR-126通过PI3K-Akt途径促进辐射诱导的NSCLC细胞凋亡[19]。以上结果均说明miR-126-5p对癌细胞的放疗敏感性具有重要作用。本研究结果发现,miR-126-5p在肺癌细胞A549、SPC A1和HCI-H596中含量均显著下调,与上述结果[17]一致;双荧光素酶报告系统和qRT-PCR结果显示,在A549细胞中,VIM-AS1靶向负调控miR-126-5p的表达,本研究还发现,抑制miR-126-5p表达同时沉默VIM-AS1后A549细胞细胞存活分数显著升高,凋亡率显著降低,细胞增敏比为0.598,逆转沉默VIM-AS1对A549细胞凋亡和放射敏感性的影响,间接证实了二者在A549细胞中具有调控过程,并可增强细胞放射敏感性。
综上所述,本研究阐述了在肺癌细胞A549、SPC A1和HCI-H596中lncRNA VIM-AS1上调,miR-126-5p下调,在肺癌A549细胞中lncRNA VIM-AS1靶向miR-126-5p调控A549细胞凋亡和放射敏感性。lncRNA VIM-AS1可能是肺癌的放射增敏靶点。
