干扰miR-130b表达增强宫颈癌细胞顺铂敏感性的研究
2021-08-18南文庆王勤学方彩霞
南文庆 王勤学 方彩霞
宫颈癌是一种常见的妇科恶性肿瘤,在全球范围内影响着女性的生命健康,癌症统计学数据显示2017年在美国估计有61 380例新发宫颈癌病例,死亡病例约有10 920例[1]。尽管在预防、筛查、诊断和治疗方面取得了较大的进步,但是宫颈癌仍是全球女性最常见的肿瘤相关死亡原因,预后较差[2]。化疗药物顺铂是晚期宫颈癌患者的标准治疗方法,但未能使患者获得完全缓解[3]。晚期宫颈癌患者对化疗的耐药性迅速发展是患者预后不良的重要原因之一[4]。最近的研究表明,microRNA(miRNA/miRs)与肿瘤化疗治疗抵抗相关[5]。研究报道miR-130b是与肿瘤耐药密切相关的miRNA,miR-130b过表达与肾透明细胞癌细胞的舒尼替尼耐药相关[6],在肺癌中miR-130b促进顺铂的耐药[7]。研究发现肿瘤坏死因子α(TNF-α)处理宫颈癌细胞后,miR-130b的表达升高,并参与保护宫颈癌细胞免受TNF-α的细胞毒性作用[8]。另一项研究中发现miR-130b通过促进DNA修复促进宫颈癌细胞增殖[9]。但miR-130b在宫颈癌中的作用未完全明确,其是否在宫颈癌顺铂耐药过程中发挥重要作用未有报道,因此本文对此进行研究,旨在获得miR-130b作为调控宫颈癌细胞化疗敏感性潜在分子靶点的重要依据。
1 资料与方法
1.1 一般资料 选择我院2017年4月到2019年4月经病理确诊的宫颈癌患者,共收集经手术切除治疗并在术前未接受过任何形式治疗的宫颈癌组织和癌旁组织98对。其中年龄≤55岁56例,>55岁42例;腺癌22例,鳞癌76例;高分化34例,中分化26例,低分化38例;临床分期FIGO分期:Ⅰ期26例,Ⅱ期23例,Ⅲ期21例,Ⅳ期28例;淋巴结转移:N0 27例,N1 40例,N2 31例;远处转移:有37例,无61例。
1.2 试剂与材料 Trizol试剂和RNA提取试剂盒,北京百奥莱博科技有限公司;AMV One-step RT-PCR试剂盒,上海生工生物工程有限公司;miR-130b引物和U6引物,上海捷瑞生物工程有限公司;高糖细胞培养基,北京清大天一生物技术有限公司;胎牛血清和胰蛋白酶,美国Hyclone公司;HeLa宫颈癌细胞系,中国科学院细胞库;miR-130b inhibitor,百奥迈科生物技术有限公司;MTS试剂,美国Sigma公司;Annexin V-FITC/PI凋亡检测试剂盒,南京凯基生物技术有限公司;RIPA裂解液,上海贝博生物科技公司;BCA蛋白浓度检测试剂盒,上海炎熙生物科技有限公司;PVDF膜,美国millipore公司;ECL化学发光试剂盒,美国Thermo公司;cleave-caspase 9、cleave-caspase 3、Bcl-2和Bax抗体,美国cell signaling公司。
1.3 化疗与疗效 患者术后进行铂类为主的一线化疗。治疗方案为顺铂70 mg/m2(静脉滴注),吉西他滨1 g/m2(静脉滴注),d1、8,21 d为1个疗程,共4~5个疗程,并根据 WHO 实体瘤疗效评价标准进行评价疗效。CR(完全缓解):肿瘤完全消失;PR(部分缓解):肿瘤最大直径及最大垂直直径之积缩小一半;SD(疾病稳定):病变两径之积缩小不超过一半,增大≤1/4;PD(疾病进展):病变两径之积增大>1/4。肿瘤大小变化持续>1个月。化疗有效率=(CR+PR)患者例数/患者总例数×100%。
1.4 qRT-PCR 手术切除的宫颈癌和癌旁组织经Trizol试剂裂解,采用RNA提取试剂盒提取组织总RNA。采用AMV One-step RT-PCR试剂盒配制PCR扩增反应体系:10X One Step RT-PCR Buffer 5 μl、上下游引物各2 μl、RNA 1 μg、AMV RT 0.5 μl、RNase inhibitor 0.5 μl、Taq DNA polymerase和无RNA酶的双蒸水补足50 μl。扩增条件为45℃逆转录20 min、PCR预变性94℃ 5 min,(变性94℃ 30 s,退火60℃ 30 s,延伸72℃ 30 s,共30个循环),终延伸72℃ 10 min。miR-130b引物F:5’-GCCGCCAGTGCAATGATGAA-3’,R:5’-GTGCAGGGTCCGAGGT-3’;U6引物F:5’-CGCTTCGGCAGCACATATACTA-3’,R:5’-CGCTTCACGAATTTGCGTGTCA-3’。按照2-ΔΔCt公式以U6为内参计算miR-130b的相对表达量。
1.5 细胞培养与转染 宫颈癌细胞系HeLa的培养基为含有10%胎牛血清的高糖培养基,放置在含有5%CO2的37℃全湿度培养箱中。细胞长至98%左右时,采用胰酶消化按照1∶3的比例进行细胞传代。以2×105个HeLa细胞接种至6孔板中,分为NC组和miR-130b inhibitor组细胞,培养12 h,采用脂质体2000进行细胞转染,NC组转染对照,miR-130b inhibitor组转染miR-130b inhibitor,培养8 h后更换新鲜培养基。继续培养48 h后采用qRT-PCR检测各组细胞中miR-130b的表达。
1.6 MTS实验检测细胞存活率 以2 000个HeLa细胞接种至96孔板中,分为NC组和miR-130b inhibitor组细胞,每组设置6个重复孔,细胞转染后NC组和miR-130b inhibitor组细胞分别加入不同剂量的顺铂(0、1、2、4、8、16、32、64 μmol/L)处理细胞48 h。每孔更换100 μl培养基和20 μl MTS试剂,设置空白对照组,并在培养箱中培养2 h后,采用酶标仪检测细胞在490 nm处吸光度(OD值)。细胞存活率=(miR-130b inhibitor组平均OD值-空白对照组平均OD值/NC组平均OD值-空白对照组平均OD值)×100%。计算细胞存活率为50%时所对应的顺铂作用剂量(IC50)。
1.7 流式细胞仪检测细胞凋亡率 NC组和miR-130b inhibitor组细胞转染后,经IC50值的顺铂浓度处理48 h后,采用无EDTA的胰酶消化各组细胞,每组设置3个重复管。PBS洗3次,要求每管细胞≥5×105个。弃掉PBS后,按照凋亡染色试剂盒说明书,每管细胞中依次加入500 μl染色缓冲液、5 μl Annexin V-FITC 和5 μl PI细胞重悬混匀。常温孵育染色10 min,流式细胞仪上机检测各组细胞凋亡率。
1.8 Western blotting NC组和miR-130b inhibitor组细胞转染后,经IC50值的顺铂浓度处理48 h后,采用胰酶消化收集各组细胞。加入RIPA冰上裂解细胞,移至EP管中,高速4℃离心30 min后,得到的上清液即为细胞总蛋白。BCA试剂盒检测蛋白浓度后加入上样缓冲液,并煮沸变性。变性的蛋白上样凝胶电泳、湿转、8%脱脂牛奶室温封闭1 h,cleave-caspase 9、cleave-caspase 3、Bcl-2和Bax一抗(稀释度均为1∶500)4℃孵育过夜,二抗室温孵育2 h,采用ECL化学发光试剂盒进行蛋白条带曝光。

2 结果
2.1 qRT-PCR检测宫颈癌组织中miR-130b的表达 qRT-PCR检测结果显示miR-130b在宫颈癌组织和癌旁组织中的表达分别(1.22±0.54)和(0.96±0.52),与癌旁组织相比,miR-130b在宫颈癌组织中的表达显著上调(t=3.344,P=0.001)。见图1。
2.2 miR-130b的表达与宫颈癌患者临床病理参数的关系 miR-130b的表达与宫颈癌患者的年龄、组织类型和分化程度无关(P>0.05)。与临床分期早期、无淋巴结转移和无远处转移患者相比,miR-130b分别在临床分期晚期、有淋巴结转移和有远处转移的宫颈癌患者组织中的表达显著增加(P<0.05)。见表1。
2.3 miR-130b的表达与宫颈癌患者化疗疗效的关系 miR-130b在宫颈癌组织中的表达高于其配对的癌旁组织中的表达为miR-130b高表达组(59例),miR-130b在宫颈癌组织中的表达低于其配对的癌旁组织中的表达为miR-130b低表达组(39例),miR-130b高表达组患者的化疗有效率低于miR-130b低表达组(P<0.05)。见表2。

图1 qRT-PCR检测miR-130b 在宫颈癌和癌旁组织中的表达水平,*P<0.05
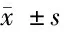
表1 miR-130b 表达与宫颈癌患者临床病理参数之间的关系
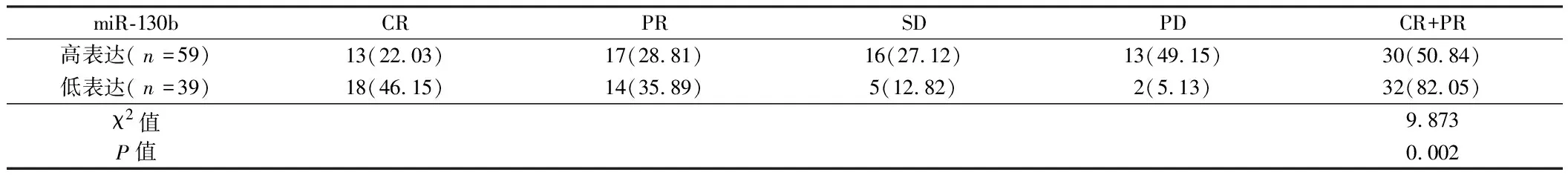
表2 miR-130b 表达水平与宫颈癌换化疗疗效的关系 例(%)
2.4 miR-130b inhibitor的干扰效果 miR-130b inhibitor转染宫颈癌细胞HeLa,qRT-PCR检测结果显示miR-130b在NC组和miR-130b inhibitor组细胞中miR-130b的表达量分别为(1.00±0.01)和(0.51±0.06),与NC比较,miR-130b inhibitor组细胞中miR-130b的表达降低(t=13.80,P=0.000)。见图2。
2.5 miR-130b inhibitor对HeLa细胞化疗敏感性的影响 NC组和miR-130b inhibitor组HeLa细胞经不同浓度的顺铂处理,培养48 h后MTS结果显示在同一顺铂浓度处理下,miR-130b inhibitor组细胞的存活率显

图2 qRT-PCR检测miR-130b inhibitor干扰效果,*P<0.05
著低于NC组细胞的存活率(P<0.05),NC组Hela细胞顺铂IC50为(7.98±0.21)μmol/L,miR-130b inhibitor组Hela细胞顺铂IC50剂量为(6.04±0.15)μmol/L,与NC组比较,miR-130b inhibitor组Hela细胞的顺铂IC50剂量降低(P<0.05)。见图3。

图3 MTS检测miR-130b inhibitor对HeLa细胞化疗敏感性的影响,*P<0.05
2.6 miR-130b inhibitor对顺铂处理的HeLa细胞凋亡率的影响 NC组和miR-130b组inhibitor组HeLa细胞经3 μmol/L的顺铂处理,培养48 h后流式细胞实验结果显示NC组细胞凋亡率为(2.30±0.36)%,miR-130b inhibitor组细胞凋亡率为(24.60±0.98)%,与NC组比较,miR-130b inhibitor组细胞的凋亡率降低(t=36.831,P=0.000)。见图4。
2.7 miR-130binhibitor对顺铂处理的HeLa细胞凋亡相关蛋白影响 NC组和miR-130b组inhibitor组HeLa细胞经3μmol/L的顺铂处理,培养48 h后western blotting结果显示与NC组比较,miR-130b inhibitor组细胞中ABCG2和Bcl-2蛋白表达降低,cleave-caspase-9和cleave-caspase-3蛋白的表达表达增加(P<0.015)。见图5,表3。

图4 miR-130b inhibitor对顺铂处理的HeLa细胞凋亡率的影响,*P<0.05

图5 miR-130b inhibitor对顺铂处理的HeLa细胞凋亡相关蛋白的影响
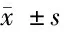
表3 miR-130b 表达与宫颈癌患者临床病理参数之间的关系
3 讨论
宫颈癌在女性相关肿瘤中发病率占第二位,其病死率占第四位,长期人乳头瘤病毒(HPV)感染是宫颈癌发病的主要原因,目前宫颈癌的发病仍处于上升状态[10]。宫颈癌的治疗主要包括手术切除治疗、化疗治疗、放射治疗和分子靶向等治疗,其中大多数早期宫颈癌患者可以通过手术和放化疗的联合治疗取得较好的临床疗效,但是对于晚期宫颈癌患者,经常会产生化学耐药性,不能从化学治疗中受益[2]。由于肿瘤的侵袭转移,早期宫颈癌患者容易进展为晚期或者复发,目前针对晚期和复发性宫颈癌的标准化治疗是基于顺铂的化学治疗,肿瘤细胞对顺铂的不敏感性阻碍患者临床疗效[3]。顺铂耐药性的分子机制很复杂而且不完善,因此研究调控宫颈癌细胞顺铂耐药的关键分子,对增强宫颈癌细胞敏感性以改善患者预后具有重要意义。
miRNA属于小RNA家族,不具备蛋白质编码作用,但可以通过与靶基因的3’-UTR结合调控靶基因的降解和翻译。大量研究表明,miRNA参与了包括细胞增殖、凋亡、侵袭转移和细胞耐药等各种肿瘤恶性生物学过程[11]。miRNA的失调促进肿瘤顺铂化学耐药性的作用引起了越来越多的关注[5]。miR-130b在肝细胞肝癌、胃癌、前列腺和骨肉瘤等多种肿瘤中表达异常,但其在肿瘤中发挥的作用并不一致[12-15]。miR-130b在肝细胞肝癌和胃癌中促进肿瘤细胞侵袭和转移能力,发挥促癌基因的作用[12,13],miR-130b在前列腺和骨肉瘤中低表达抑制肿瘤细胞的增殖和转移,发挥抑癌基因的作用[14,15]。目前miR-130b在宫颈癌中报道为促癌因子,Yang等[8]研究发现miR-130b在TNF-α处理的宫颈癌细胞中表达增加,并通过靶向抑制PTEN基因保护宫颈癌细胞免受TNF-α的杀伤作用,促使宫颈癌细胞存活。在Yang等[9]的另一篇报道中,过表达miR-130b通过修复TNF-α引起的肿瘤细胞DNA损伤而增强细胞的活力。但miR-130b在宫颈癌组织中的表达水平未知,本文采用qRT-PCR检测发现miR-130b在宫颈癌组织中的表达显著高于在其配对的癌旁组织中的表达,并且统计分析显示miR-130b的表达水平与宫颈癌患者的临床分期、淋巴结转移和远处转移相关,表明miR-130b促进宫颈癌的恶性进展,与Yang等[8,9]的研究报道相符。
宫颈癌患者,尤其是宫颈癌晚期对化学治疗反应性较低,是导致患者预后不良的重要原因[4]。miR-130b的高表达与宫颈癌晚期相关,研究报道miR-130b与多种肿瘤化学药物耐药相关,miR-130b在肾透明细胞癌组织中的表达高于其在正常肾脏组织中的表达,并通过负调控PTEN促进舒尼替尼的耐药[6]。肺癌中,miR-130b通过Wnt/β-catenin途径靶向PTEN介导顺铂化学耐药性、细胞增殖和凋亡[7]。顺铂是治疗宫颈癌的一线化学药物,本文通过分析宫颈癌患者术后进行以顺铂为主化学治疗的疗效,结果显示miR-130b高表达组患者的化疗有效率低于miR-130b低表达组,表明miR-130b与宫颈癌化疗耐药相关。采用miR-130b inhibitor转染宫颈癌细胞HeLa,在细胞水平研究miR-130b对宫颈癌细胞顺铂敏感性的影响,MTS检测结果显示干扰miR-130b的表达促进顺铂对宫颈癌细胞的抑制作用,干扰miR-130b表达的宫颈癌细胞对顺铂的敏感性增加。化学抗性的分子机制非常复杂,包括耐药相关蛋白和凋亡相关蛋白的异常表达,ABCG2属于乳腺癌细胞耐药ABC超家族,表达于ATP结合转运体细胞膜上,是介导肿瘤耐药的重要蛋白,研究报道ABCG2过表达在宫颈癌耐药中发挥重要作用[16]。化疗药物诱导肿瘤细胞发生凋亡是抗肿瘤细胞存活的重要途径,在受到外界刺激,凋亡信号促使凋亡蛋白caspase-9活化为cleave-caspase-9,并促进下游凋亡蛋白caspase-3的活化,发生级联反应,促进凋亡的发生[17]。抗凋亡蛋白Bcl-2过表达在促进宫颈癌顺铂耐药中发挥重要[18]。本文干扰miR-130b的表达后发现顺铂处理的细胞凋亡增加,ABCG2和Bcl-2蛋白的表达降低,cleave-caspase-9和cleave-caspase-3蛋白的表达增加,表明干扰miR-130b的表达可能通过调控耐药相关蛋白和凋亡相关蛋白增强宫颈癌细胞顺铂敏感性。
综上所述,miR-130b在宫颈癌组织中高表达,与宫颈癌的恶性进展相关,并与患者化疗有效率差相关。干扰miR-130b的表达促进宫颈癌细胞对顺铂的敏感性,其分子机制可能是通过调控耐药蛋白和凋亡蛋白发挥作用。miR-130b可能是增加宫颈癌化疗敏感性的潜在分子,是治疗宫颈癌的候选靶点。
