靶向干预Sestrin 1对动脉粥样硬化小鼠斑块内巨噬细胞极化和血管内皮损伤的影响
2021-08-18肖彭卓杨克平
肖彭卓 杨克平,2
(1 长江大学医学院,湖北省荆州市 434023,电子邮箱:305642859@qq.com;2 湖北省荆州市中心医院/长江大学第二临床医学院,荆州市 434000)
动脉粥样硬化引发的心脑血管病是世界范围内老年人群致残和致死的首位因素,其病理机制复杂,从多个角度深入挖掘动脉粥样硬化的分子生物学机制,寻找更好的防治方法是未来十几年的一个重要研究方向[1]。巨噬细胞起源于骨髓造血干细胞,可根据所处内环境的不同分化为M1和M2两种亚型,M1型巨噬细胞的功能以抗肿瘤、抗感染为主,而M2型巨噬细胞则以启动创伤修复和血管新生为主[2-3]。近年来,越来越多的研究证实单核巨噬细胞在动脉粥样斑块的发生和进展中起关键作用,动脉粥样硬化发生过程中,巨噬细胞的数量和表型对斑块的形成和炎症状态有重要影响[4]。有研究发现,小鼠动脉粥样硬化病变早期斑块内巨噬细胞以M2型为主,晚期M1型增多从而使得M1型和M2型巨噬细胞数量相当[5],因此,通过调控巨噬细胞极化类型改善血管炎症,也是改善动脉粥样硬化患者预后的途径之一。Sestrin蛋白属于应激反应蛋白家族,包括Sestrin 1、Sestrin 2和Sestrin 3 3种亚型,在氧化应激、内质网应激盒缺氧应激的情况下均可能被激活。既往研究显示,Sestrin家族成员能够影响巨噬细胞的功能[6],我们的前期研究也证实Sestrin 2对心肌梗死急性期巨噬细胞介导的炎性反应具有调节作用[7]。但是,动脉粥样硬化斑块内的巨噬细胞是否表达Sestrin蛋白,这些Sestrin蛋白对巨噬细胞的极化是否有影响,目前尚未见研究报告。故本研究分析Sestrin 1蛋白对动脉粥样硬化小鼠巨噬细胞分化的调控作用及对血管内皮炎性损伤的影响。
1 材料与方法
1.1 实验动物与细胞 无特定病原体级雄性8周龄ApoE基因敲除(ApoE-/-)小鼠60只,体质量35~40 g,购自北京维通利华实验动物技术有限公司,生产许可证号:SCXK(京)2018-0011。实验前适应性喂养1周,自由进食进水,饲养环境为室温25℃左右、湿度50%~60%、昼夜12 h/12 h交替。小鼠巨噬细胞株RAW 264.7细胞购自中国典型培养物保藏中心。
1.2 主要仪器和试剂 (1)主要仪器:细胞培养箱(HF90/240)和生物安全柜(HFsafe-1200LC)购自上海力康生物医疗科技控股有限公司;倒置显微镜(DMi8)购自德国莱卡;高速冷冻离心机(GTR16-2)购自北京时代北利离心机有限公司;垂直电泳(Mini-PROTEIN Tetra System)和电转印(Trans-Blot Turbo Blotting System)装置购自伯乐生命医学产品(上海)有限公司;实时荧光定量PCR仪(LightCycle@480)购自罗氏诊断产品(上海)有限公司。(2)主要试剂:重组对照慢病毒载体质粒(si-NC)和重组Sestrin 1过表达慢病毒载体质粒(si-Sestrin 1)均委托上海吉凯基因科技有限公司合成(批号:201909075);杜氏改良伊格尔培养基(Dulbecco′s modified Eagle medium,DMEM;批号:1973546)、胎牛血清(批号:1967839)、胰酶(批号:2001132)等细胞培养试剂购自美国Gibco公司;阴离子氯弗松-氯膦酸二钠脂质体购自上海桥星贸易有限公司(批号:20200103);油红O染色液(批号:20190607)、苏木素染液(批号:20181217)、结晶紫染色液(批号:20181114)、磷酸盐缓冲液(phosphate buffered saline,PBS;批号:20200228)、活性氧定量试剂盒(批号:20200107)均购自北京索莱宝科技有限公司;Sestrin 1及内参甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)的一抗(批号:GR190316-3、 GR190803-1)以及二抗(山羊抗兔抗体,批号:GR181105-2)均购自Abcam中国官网;蛋白提取试剂盒(批号:20180605)和蛋白定量试剂盒(批号:20192023)购自北京碧云天;总RNA抽提试剂盒(批号:202001011)、反转录试剂盒(批号:202001005)、实时荧光定量PCR扩增试剂盒(批号:202002077)购自上海生工生物科技有限公司;引物委托上海生工生物科技有限公司合成;F4/80-PE(批号:202014104)、CD64-PerCP-Cy5.5(批号:201905144)、CD197-PerCP-Cy5.5(批号:201903003)、CD163-Alexa 647(批号:202003015)、CD206-Alexa 647(批号:201912033)等荧光标记抗体均购自武汉艾美捷科技有限公司。
1.3 冠状动脉粥样硬化模型制备方法 按照体重由小到大编号,采用区组随机化法将ApoE-/-小鼠分为对照组、模型组、si-NC组和si-Sestrin 1组,每组15只。对照组正常饲养,模型组、si-NC组和si-Sestrin 1组小鼠均采用高脂饮食法制备冠状动脉粥样硬化模型,即使用含有21%脂肪和0.15%胆固醇的高脂饲料。连续饲养14周后,各组随机抽取5只小鼠用于观察模型制备情况:采用3.0%的戊巴比妥钠(80 mg/kg)腹腔注射处死小鼠,分离胸主动脉,并浸泡于4%的多聚甲醛溶液中过夜,制备常规石蜡病理切片;经苏木精-伊红染色后观察胸主动脉形态,出现冠状动脉粥样硬化的病理特征者,例如血管内膜有大片斑块、泡沫细胞堆积、部分斑块破裂等,视为模型制备成功。确定模型制备成功后,继续饲养2周,并进行下一步的RAW 264.7细胞干预。
1.4 RAW 264.7细胞培养与模型干预方法 采用24孔板培养RAW 264.7细胞,培养基为含10%的新生小牛血清及100 U/mL青霉素、链霉素的DMEM高糖培养基,置于5% CO2、37℃培养箱内培养,隔天换液。培养至对数生长期,加入0.25%胰酶消化1 min,更换培养基。调整细胞密度为5×106个/mL,将慢病毒载体质粒si-NC或si-Sestrin 1(按8 μg:1 mL的比例)分别与si-NC组和si-Sestrin 1组细胞共培养,37℃、5% CO2培养箱内孵育24 h。次日更换新鲜培养基继续培养48 h,0.25%胰酶消化后收集细胞,PBS清洗,荧光显微镜(日本奥林巴斯株式会社,型号:BX41)下观察转染情况,荧光显微镜下呈现绿色荧光为转染成功。转染率达到90%以上时,可对si-NC组和si-Sestrin 1组小鼠进行细胞干预。首先清除si-NC组和si-Sestrin 1组小鼠体内原有的巨噬细胞,即经尾静脉注射0.1 mL的阴离子氯弗松-氯膦酸二钠脂质体,对照组和模型组经尾静脉注射等体积的生理盐水,3 d后重复注射1次;末次注射3 d后,si-NC组和si-Sestrin 1组小鼠经眼球后静脉丛注射转染后的RAW 264.7细胞,浓度为5×106个/mL,注射体积为0.2 mL,对照组和模型组小鼠仅注射0.2 mL DMEM,24 h后重复输注1次,并于第2次输注24 h后处死小鼠进行取样和相关指标检测。
1.5 指标测定方法
1.5.1 斑块定量和斑块内活性氧活性测定:分离腹主动脉,剔除其周围结缔组织和脂肪组织,4%的多聚甲醛浸泡过夜,剪开血管内壁,采用0.3%的油红O溶液避光染色2 h,PBS清洗,75%乙醇浸泡。斑块呈红色、动脉壁底色呈白色时,显微镜下观察并拍照,采用图像分析软件Image J计算总斑块面积。剥离斑块,经PBS溶解后置于离心管,4℃下1 000 r/min离心5 min,收集上清,采用活性氧定量试剂盒测定斑块内活性氧活性,按说明书中的步骤进行操作。将所得下层细胞再次用PBS重悬,离心(每次均1 000 r/min,5 min)洗涤两次,分离细胞,洗涤后用DMEM培养基重悬细胞,用于巨噬细胞的分离及极化。
1.5.2 斑块巨噬细胞的分离及极化:(1)采用DMEM培养基重悬下层细胞后,调整细胞密度为1×106个/mL,接种于6孔板中培养,2 mL/孔,于5% CO2、37℃的细胞培养箱中培养,贴壁细胞为斑块巨噬细胞。(2)向巨噬细胞中加入终浓度为10 ng/mL的γ-干扰素(北京索莱宝,批号:20200106),5% CO2、37℃培养6 d,诱导巨噬细胞向M1型分化,并采用流式细胞仪测定M1型巨噬细胞表型CD64、CD197阳性率;采用实时荧光定量PCR法测定M1型巨噬细胞标志物肿瘤坏死因子α(tumor necrosis factor α,TNF-α)、白细胞介素(interleukin,IL)-6、IL-1β及诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)的mRNA表达量。(3)向巨噬细胞中加入终浓度为10 ng/mL的IL-4,5% CO2、37℃培养6 d,诱导巨噬细胞向M2型分化,并采用流式细胞仪测定M2型巨噬细胞表型CD163、CD206阳性率;实时荧光定量PCR法测定M2型巨噬细胞标志物IL-10及转化生长因子β(transforming growth factor β,TGF-β)的mRNA表达量。
1.5.3 流式细胞仪测定巨噬细胞表型:巨噬细胞与相应的诱导剂共培养6 d后,重悬于DMEM,1 200 r/min离心10 min,弃上清,再次重悬于DMEM,调整细胞数至1×105个/mL,取2 mL置于流式管中,300 r/min离心5 min,弃上清,重悬于100 μL PBS,依次加入相应的荧光标记抗体(F4/80-PE、CD64-PerCP-Cy5.5、CD197-PerCP-Cy5.5、CD163-Alexa 647、CD206-Alexa 647等),于4℃避光孵育30 min后,加入2 mL PBS洗涤细胞,300 r/min离心10 min,弃上清,再加入0.2 mL PBS重悬细胞,200目滤网过滤细胞后上机检测。
1.5.4 实时荧光定量PCR实验测定巨噬细胞标志物表达:无菌操作台上工作,采用TRIzol法提取巨噬细胞的总RNA,蛋白核酸分析仪分析RNA质量。质量合格者纳入反转录实验,根据试剂盒配置反转录体系,将反应管置入PCR仪中,设置反应条件,37℃×15 min,85℃×5 s,4℃存储。根据实时荧光定量 PCR 试剂盒配置扩增体系,包括ddH2O 15 μL、10×Taq 2.5 μL、dNTP Mix 2.5 μL、上游引物1.0 μL、下游引物1.0 μL、MgCl2(25 mmol/L)1.5 μL、Taq DNA Polymerase 0.3 μL、DNA模板1.0 μL。管家基因为GAPDH,引物序列见表1。PCR反应步骤为95℃×30 s预变性,95℃×5 s、60℃×30 s共40个循环,扩增,50℃×30 s退火。采用2-ΔΔCt法分析目的基因的相对表达量。

表1 引物序列
1.5.5 蛋白质免疫印迹实验测定Sestrin 1蛋白表达:采用蛋白抽提试剂盒提取巨噬细胞的总蛋白,二喹啉甲酸法进行蛋白定量,并采用buffer缓冲液将蛋白配置为1 μg/μL的溶液。以10 μL/孔为上样量进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,电泳后将凝胶中的蛋白条带转印至羟甲基纤维素膜。5%脱脂牛奶于37℃封闭纤维素膜1 h。采用3%的脱脂牛奶配置抗体,根据说明书及预实验结果,Sestrin 1与GAPDH的一抗浓度均为1 ∶2 000,孵育条件为4℃过夜;二抗浓度为1 ∶2 500,孵育条件为37℃×1 h。电化学发光液显色,暗室显影,Image J软件分析灰度值,以目的蛋白灰度值/GAPDH灰度值作为该蛋白的表达量。
2 结 果
2.1 各组大鼠胸主动脉斑块测定结果 与对照组相比,其他3组的斑块面积增加,斑块内活性氧活性也升高(均P<0.05);与模型组相比,si-Sestrin 1组的斑块面积增加,斑块内活性氧活性升高(均P<0.05),但si-NC组的指标与模型组比较差异无统计学意义(均P>0.05)。见表2。
表2 各组小鼠胸主动脉斑块面积和活性氧活性的比较(±s)
2.2 各组大鼠Sestrin 1蛋白相对表达量的比较 与对照组相比,其他3组Sestrin 1蛋白表达量降低(P<0.05);与模型组相比,si-Sestrin 1组Sestrin 1蛋白表达量降低(P<0.05),但si-NC组的蛋白表达量与模型组比较差异无统计学意义(P>0.05)。见图1、表3。
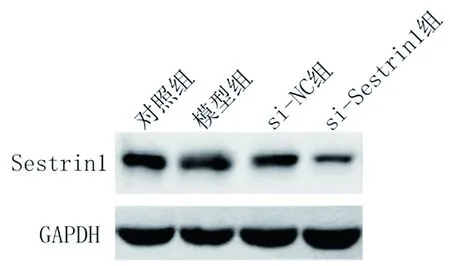
图1 4组小鼠胸主动脉斑块Sestrin 1蛋白表达情况
表3 各组小鼠胸主动脉斑块Sestrin 1蛋白相对表达量的比较(±s)
2.3 各组巨噬细胞表面标志物测定结果 与对照组相比,其他3组M1型巨噬细胞表面标志物CD64和CD197的阳性表达率升高,M2型巨噬细胞表面标志物CD163和CD206的阳性表达率降低(均P<0.05);与模型组比较,si-Sestrin 1组的CD64和CD197阳性表达量升高,CD163和CD206阳性表达率降低(均P<0.05),但si-NC组的巨噬细胞表面标志物与模型组比较,差异均无统计学意义(均P>0.05)。见表4。
表4 各组小鼠巨噬细胞表面标志物阳性率的比较(±s,%)
2.4 各组细胞因子mRNA相对表达量的比较 与对照组相比,其他3组iNOS的mRNA表达量升高,TGF-β和IL-10的mRNA表达量降低(均P<0.05);与模型组比较,si-Sestrin 1组iNOS的mRNA表达量升高,TGF-β和IL-10 mRNA表达量降低(均P<0.05),但si-NC组的上述指标的mRNA表达量与模型组比较,差异均无统计学意义(均P>0.05)。见表5。
表5 各组细胞因子mRNA相对表达量的比较(±s)
3 讨 论
Sestrin家族属于抗氧化蛋白,在进化方面高度保守,普遍分布于哺乳动物的组织、器官及外周循环系统。Sestrin 1也称p53调控蛋白26(PA26),Sestrin 2是Sestrin 1的同源异构体,Sestrin 3是后来发现的一种PA26结构相关基因,三者在功能上并不完全相同[8]。例如,在滤泡性淋巴瘤中,Sestrin 1表达明显偏低且被鉴定为一种抑癌基因,而Sestrin 2和Sestrin 3表达却无明显变化[9]。在肿瘤性疾病中,缺氧刺激可同时激活Sestrin 1与Sestrin 2,而在能量匮乏导致的缺氧条件下往往只有Sestrin 2被激活[10]。 Keping等[11]研究发现,动脉粥样硬化小鼠的巨噬细胞中Sestrin 1与Sestrin 2表达均明显升高,且采用慢病毒转染技术上调Sestrin 1表达后,对氧化修饰的LDL诱导的炎性反应有明显的抑制效果,这表明Sestrin 1在动脉粥样硬化中可能发挥抗血管炎性损伤的作用。本研究结果显示动脉粥样硬化小鼠的斑块中巨噬细胞Sestrin 1蛋白表达明显降低,这与Keping等[11]报告的结果有所不同。这可能是因为:Keping等[11]是在模型制备成功后立即检测Sestrin 1表达水平,而本研究是在模型制备成功后14 d测定Sestrin 1表达水平;作为一种应激蛋白,Sestrin 1在应激早期被激活,表达量上调,但随着疾病进展,其表达水平达到峰值后开始降低。我们对小鼠斑块的相关指标进行检测,结果显示,模型组的斑块面积增加,且斑块内活性氧的活性也升高,采用干扰技术降低Sestrin 1表达后斑块面积及斑块内活性氧活性进一步升高,这提示下调Sestrin 1表达利于控制氧化应激反应,从而减少斑块形成。
既往研究已证实,巨噬细胞极化类型与动脉粥样硬化的病理状态息息相关,在动脉粥样硬化病变早期斑块内巨噬细胞以M2型细胞为主,其主要作用是促进血管内皮损伤后修复,随着病情加重,到疾病的晚期M1型巨噬细胞增多,血管内皮出现炎性损伤[12-13]。目前,如何鉴别巨噬细胞的极化类型并无统一标准,部分研究采用M1型与M2型巨噬细胞的常见细胞表面标志物,也有部分研究采用其分泌的细胞因子,其中前者侧重于细胞表型鉴定,后者侧重于功能考察[14-15]。CD64和CD197是M1型巨噬细胞的表面标志物;CD163和CD206是M2型巨噬细胞的表面标志物,其中CD163被认为是巨噬细胞由M1型向M2型转化的典型标志[16]。为考察巨噬细胞的极化能力,本研究以γ-干扰素诱导巨噬细胞向M1型分化,测定M1型巨噬细胞的表面标志物,再以IL-4诱导巨噬细胞M2型分化,测定M2型巨噬细胞的标志物。结果显示,与对照组相比,模型组CD64和CD197的阳性表达率升高,CD163和CD206的阳性表达率降低;与模型组比较,si-Sestrin 1组的CD64和CD197阳性表达率升高,CD163和CD206阳性表达率降低。该结果从细胞表型方面证实了动脉粥样硬化小鼠斑块中的巨噬细胞向M1型的极化能力增强,且沉默Sestrin 1蛋白表达后,这一病理现象更加严重。既往有学者指出,在炎症调节方面,M1型巨噬细胞能够分泌iNOS、TNF-α等促炎因子,从而激活获得性免疫系统;而M2型巨噬细胞则以分泌IL-10为主,以抑制免疫炎性反应,从而给组织创伤后修复提供良好的环境[17-18]。本研究结果还显示,与对照组相比,模型组iNOS mRNA表达水平升高,TGF-β和IL-10的mRNA表达水平降低,沉默Sestrin 1表达后,这一变化也进一步加剧。该结果从功能方面证实了动脉粥样硬化小鼠斑块中的巨噬细胞向M1型的极化能力增强,且沉默Sestrin 1蛋白表达后,这一病理现象加重。
结合在病情进展后期动脉粥样硬化小鼠体内Sestrin 1表达低下的情况,本研究推测Sestrin 1不足可能是造成动脉粥样硬化血管内炎性反应的一个重要原因,且巨噬细胞的极化作用可能参与其中。巨噬细胞向M1型还是向M2型分化,主要是受到局部免疫微环境的影响。作为一种应激反应蛋白,Sestrin 1在机体受到氧化应激损伤或者炎性损伤时能够迅速作出反应,并激活一系列应激相关信号来抵抗这种损伤,Sestrin 1功能的缺失可能导致促炎细胞因子的持续产生,从而影响到巨噬细胞的极化,其具体调控机制有待进一步研究加以证实。
综上所述,Sestrin 1蛋白表达下调可促进动脉粥样硬化斑块内巨噬细胞的极化,并由此参与内皮细胞的炎性损伤,这可能是其参与动脉粥样硬化进展的重要机制之一。
