具有α, β-不饱和酮的2-吲哚酮衍生物的设计、合成及抗肿瘤活性
2021-08-17何茂飞邓璐璐范艳华穆淑珍
何茂飞, 邓璐璐, 范艳华, 李 江, 穆淑珍,*
(1.贵州大学 药学院,贵州 贵阳 550025; 2. 贵州医科大学 天然产物化学重点实验室 药用植物功效与利用国家重点实验室,贵州 贵阳 550014)
活性天然产物在药物发现中具有非常重要的作用[1]。值得关注的是2-吲哚酮骨架是许多具有重要生物活性的天然产物的核心结构[2-7],尤其是2-吲哚酮骨架在抗肿瘤药物设计中起到重要作用[8-13],例如舒尼替尼(sunitinib)和司马沙尼(semaxanib),前者已被广泛用于治疗胃肠道间质瘤和转移性肾细胞癌[14-15],后者正在进行治疗结直肠癌的临床试验[16]。

Chart 1
α,β-不饱和酮(Michael受体)的结构单元是天然产物中常见的模块[17-20],例如姜黄素(curcumin)和查尔酮(chalcones)中都具有此单元,它们均具有多种重要的生物活性。在抗肿瘤方面,以其为母核设计合成的衍生物对多种肿瘤细胞表现出了显著的抑制活性[21-25],例如查尔酮衍生物,对人前列腺癌细胞(PC-3)细胞周期G2/M期具有阻滞作用,通过调节Bax和Bcl-2转录及增加caspase 3/7激活来诱导线粒体的凋亡[26]。从化学结构上看,它们的抗肿瘤活性主要源于α,β-不饱和酮的存在,若没有这一结构片段的存在,它们的抗肿瘤活性将消失[27-28]。因此,α,β-不饱和酮可作为开发抗肿瘤药物的核心结构模块。近年来,分子杂交(Molecular Hybridization)的策略广泛应用于药物化学领域,它能提高组成杂交分子的已知药物或活性组分的活性或药理作用[29-30]。
基于上述发现和分子杂交策略,本文以2-吲哚酮衍生物(1a~1c)与醛(2a~2n)为原料,通过克脑文格尔反应得到中间体3a~3p,此中间体再经过酰化反应最终合成了17个含α,β-不饱和酮结构的2-吲哚酮类衍生物1~17(Scheme 2),其结构经1HNMR、13CNMR和MS(ESI)表征。1~17的E构象是以化合物2为例通过分析其2D-NOEY谱及结合文献来确定的。采用Cell Titer-Glo(CTG)法首次评价了1~17对人非小细胞肺癌细胞(A-549),人乳腺癌细胞(MCF-7)和人胃腺癌细胞(BGC-823)增殖的抑制活性,并进一步探讨了其初步的构效关系。

Scheme 1

Scheme 2
1 实验部分
1.1 仪器与试剂
WRX-4型微量熔点仪;Bruker AVANCE NEO 600 MHz型核磁共振仪(CDCl3为溶剂,TMS为内标);Bruker microTOF-Q型高分辨质谱仪。
2p按照文献[31]方法合成;其余所用试剂均为分析纯。
1.2 合成
(1)2n的合成
取2p1.0 g(4.2 mmol)溶解于20 mL二氯甲烷中,加入活性二氧化锰3.6 g(42 mmol),室温反应24 h。过滤除去二氧化锰,滤液减压除去溶剂,残余物经硅胶柱层析(洗脱剂:石油醚/乙酸乙酯=10/1,V/V) 纯化得2n和2o,通过分析2D-NOEY谱图对2n和2o进行区分。
2n: 白色固体422 mg,产率60%;1H NMR(600 MHz, CDCl3)δ: 9.78(s, 1H), 7.48(s, 1H), 6.98(dd,J=2.4 Hz, 4.2 Hz, 1H), 5.30(d,J=4.2 Hz, 1H), 3.74(s, 3H), 3.49(s, 3H), 3.35(td,J=4.2 Hz, 7.8 Hz, 1H), 3.27~3.30(m, 1H), 3.02~3.12(m, 1H), 2.54~2.62(m, 1H);13C NMR(150 MHz, CDCl3)δ: 189.22, 167.43, 154.92, 152.26, 144.47, 110.59, 98.80, 56.63, 51.26, 45.14, 39.62, 33.44; MS(ESI)m/z: 261.0{[M+Na]+}。
2o: 白色固体136 mg,产率20%;1H NMR(600 MHz, CDCl3)δ: 9.77(s, 1H), 7.47(d,J=1.2 Hz, 1H), 7.10~7.03(m, 1H), 5.28(d,J=3.6 Hz, 1H), 3.76(s, 3H), 3.29(s, 3H), 3.25(dt,J=2.4 Hz, 5.4 Hz, 1H), 3.04~3.14(m, 2H), 2.44~2.54(m, 1H);13C NMR(150 MHz, CDCl3)δ: 189.33, 167.71, 155.77, 150.70, 145.29, 110.45, 98.14, 56.29, 51.26, 42.15, 40.52, 32.66; MS(ESI)m/z: 261.3{[M+Na]+}。
(2)1~15的合成通法
在25 mL圆底烧瓶中加入1a~1c(3 mmol),2a~2m(3.3 mmol)和8 mL无水乙醇,再加入25.0 mg(0.3 mmol)哌啶,在80 ℃加热4 h。有沉淀生成,沉淀过滤后用乙醇洗涤,得中间体3a~3o。将3a~3o(3 mmol)溶于5 mL四氢呋喃中,加入乙酸酐1.5 g(15 mmol)和碳酸钠1.6 g(15 mmol),在室温下搅拌24 h,加水稀释,用乙酸乙酯萃取(3×50 mL)。有机层用饱和氯化钠溶液洗涤(2×100 mL),然后用无水MgSO4干燥,减压除去溶剂,残余物经硅胶柱层析(洗脱剂:石油醚/乙酸乙酯=60/1~2/1,V/V) 纯化得目标化合物1~15。
(E)-1-乙酰基-3-亚苄基吲哚-2-酮(1): 黄色固体542 mg,产率54%,m.p.145~146 ℃;1H NMR(600 MHz, CDCl3)δ: 8.34(d,J=8.4 Hz, 1H), 7.91(s, 1H), 7.72(d,J=7.2 Hz, 1H), 7.66(d,J=7.2 Hz, 2H), 7.50(ddd,J=8.4 Hz, 7.8 Hz, 6.0 Hz, 3H), 7.37~7.32(m, 1H), 7.05(td,J=7.8 Hz, 1.2 Hz, 1H), 2.79(s, 3H);13C NMR(150 MHz, CDCl3)δ: 170.91, 168.62, 140.28, 138.71, 134.42, 130.28, 130.07, 129.21, 128.81, 124.49, 122.16, 121.88, 116.75, 27.00, 26.93; MS(ESI)m/z: Calcd for C17H13NO2Na{[M+Na]+}286.0838, found 286.0831。
(E)-1-乙酰基-6-氯-3-(3(三氟甲基)亚苄基)吲哚-2-酮(2): 黄色固体321 mg,产率31%,m.p.142~143 ℃;1H NMR(600 MHz, CDCl3)δ: 8.41(d,J=1.8 Hz, 1H), 7.87(d,J=1.8 Hz, 2H), 7.81(d,J=12.0 Hz, 1H),7.75(d,J=12.0 Hz, 1H), 7.66(t,J=6.0 Hz, 1H), 7.46(d,J=6.0 Hz, 1H), 7.05(dd,J=12.0 Hz, 1.8 Hz, 1H), 2.74(s, 3H);13C NMR(150 MHz, CDCl3)δ: 170.84, 165.69, 139.53, 136.87, 134.59, 133.67, 128.91, 128.81, 128.49, 128.46, 127.32, 127.30, 125.61, 125.16, 122.65, 119.78, 117.32, 26.86. MS(ESI)m/z: Calcd for C18H11NO2F3ClNa{[M+Na]+} 388.0323, found 388.0311。
(E)-1-乙酰基-6-氯-3-(4-(三氟甲基)亚苄基)吲哚-2-酮(3): 黄色固体255 mg,产率25%,m.p.143~145 ℃;1H NMR(600 MHz, CDCl3)δ: 8.43(d,J=1.8 Hz, 1H), 7.84(s, 1H), 7.59~7.51(m, 3H), 7.49(s, 1H), 7.35(d,J=6.6 Hz, 1H), 7.06(dd,J=8.4 Hz, 1.8 Hz, 1H), 2.78(s, 3H);13C NMR(150 MHz, CDCl3)δ: 168.22, 159.84, 140.92, 139.07, 135.88, 135.38, 130.05, 125.32, 124.64, 123.10, 121.49, 117.28, 116.10, 114.23, 77.25, 76.83, 55.42, 26.82; MS(ESI)m/z: Calcd for C18H11NO2F3ClNa{[M+Na]+} 388.0323, found 388.0311。
(E)-1-乙酰基-6-氯-3-(2(三氟甲基)亚苄基)吲哚-2-酮(4): 黄色固体254 mg,产率23%,m.p.131~133 ℃;1H NMR(600 MHz, CDCl3)δ: 8.66(d,J=6.0 Hz, 1H), 7.96(s, 1H), 7.56~7.60(m, 3H), 7.40(d,J=8.4 Hz, 1H), 7.04(dd,J=8.4 Hz, 1.8 Hz, 2H), 2.98(s, 3H);13C NMR(150 MHz, CDCl3)δ: 170.59, 167.51, 141.34, 136.73, 129.50, 127.91, 126.56, 125.25, 124.94, 124.70, 124.50, 124.47, 123.26, 120.31, 119.72, 119.05, 117.47, 26.79; MS(ESI)m/z: Calcd for C18H11NO2FCl3Na+{[M+Na]+} 388.0323, found 388.0311。
(E)-1-乙酰基-6-氯-3-(3-(三氟甲氧基)亚苄基)吲哚-2-酮(5): 黄色固体302 mg,产率26%,m.p.135~136 ℃;1H NMR(600 MHz, CDCl3)δ: 8.41(d,J=1.8 Hz, 1H), 7.84(s, 1H), 7.59~7.51(m, 3H), 7.49(s, 1H), 7.35(d,J=6.6 Hz, 1H), 7.06(dd,J=8.4 Hz, 1.8 Hz, 1H), 2.78(s, 3H);13C NMR(150 MHz, CDCl3)δ: 170.61, 167.89, 141.22, 136.58, 136.53, 136.12, 130.60, 127.48, 126.50, 124.81, 122.94, 122.53, 121.28, 119.74, 117.49, 26.87, 26.80; MS(ESI)m/z: Calcd for C18H12NO3F3Cl{[M+H]+}382.0452, found 382.0441。
(E)-1-乙酰基-6-氯-3-(4-氯-3-(三氟甲基)亚苄基)吲哚-2-酮(6): 黄色固体352 mg,产率29%,m.p.142~144 ℃;1H NMR(600 MHz, CDCl3)δ: 8.41(d,J=1.8 Hz, 1H), 8.36(d,J=1.8 Hz, 1H), 8.33(dd,J=8.4 Hz, 1.8 Hz, 1H), 7.62(d,J=8.4 Hz, 1H), 7.55~7.51(m, 2H), 7.26(dd,J=8.4 Hz, 1.8 Hz, 1H), 2.75(s, 3H);13C NMR(150 MHz, CDCl3)δ: 170.76, 165.76, 139.61, 136.07, 135.48, 132.22, 131.86, 131.56, 130.91, 130.88, 125.95, 125.24, 124.93, 122.48, 121.68, 119.84, 117.38, 26.87; MS(ESI)m/z: Calcd for C18H11NO2F3Cl2{[M+H]+} 400.0113, found 400.0121。
(E)-1-乙酰基-6-氯-3-((2-(三氟甲基)吡啶-4-基)亚甲基)吲哚-2-酮(7): 黄色固体354 mg,产率32%,m.p.143~144 ℃;1H NMR(600 MHz, CDCl3)δ: 8.79(d,J=6.0 Hz, 2H), 8.39(s, 1H), 7.46(d,J=5.4 Hz, 1H), 7.40(d,J=8.4 Hz, 1H), 7.04(dd,J=8.4 Hz, 1.8 Hz, 2H), 2.77(s, 3H);13C NMR(150 MHz, CDCl3)δ: 170.49, 167.51, 150.64, 143.15, 142.16, 141.46, 137.03, 134.59, 128.01, 124.97, 123.30, 122.68, 119.38, 117.59, 26.78; MS(ESI)m/z: Calcd for C17H11N2O2F3Cl{[M+H]+} 367.0456, found 367.0447。
(E)-1-乙酰基-3-(3-(三氟甲基)亚苄基)吲哚-2-酮(8): 黄色固体284 mg,产率29%,m.p.121~123 ℃;1H NMR(600 MHz, CDCl3)δ: 8.36(d,J=8.4 Hz, 1H), 7.92 (s, 1H), 7.87(s, 1H), 7.84(d,J=7.8 Hz, 1H), 7.74(d,J=7.8 Hz, 1H), 7.65(dd,J=18.0 Hz, 8.4 Hz, 1H), 7.56(d,J=7.8 Hz, 1H), 7.38(t,J=7.8 Hz, 1H), 7.07(t,J=7.8 Hz, 1H), 2.80(s, 3H);13C NMR(150 MHz, CDCl3)δ: 170.78, 168.21, 140.66, 136.05, 135.27, 132.19, 130.93, 129.45, 127.61, 126.44, 125.90, 124.68, 122.08, 121.28, 117.00, 26.92; MS(ESI)m/z: Calcd for C18H12NO2F3Na{[M+Na]+} 354.0712, found 354.0705。
(E)-1-乙酰基-6-氯-3-(3-甲氧基-5-(三氟甲基)亚苄基)吲哚-2-酮(9): 黄色固体296 mg,产率25%,m.p.140~142 ℃;1H NMR(600 MHz, CDCl3)δ: 8.40(d,J=1.8 Hz, 1H), 7.83(s, 1H), 7.52~7.49(m, 1H), 7.23(s, 2H), 7.06(dd,J=8.4 Hz, 1.8 Hz, 1H), 3.91(s, 3H), 2.77(s, 3H);13C NMR(150 MHz, CDCl3)δ: 170.74, 167.82, 160.29, 159.66, 141.19, 136.58, 136.26, 126.83, 124.84, 122.99, 119.70, 119.61, 117.91, 117.52, 117.27, 113.49, 112.23, 55.80, 26.79; MS(ESI)m/z: Calcd for C19H14NO3F3Cl {[M+H]+}396.0609, found 396.0616。
(E)-1-乙酰基-6-氯-3-(3-甲氧基亚苄基)吲哚-2-酮(10): 黄色固体311 mg,产率32%,m.p.141~143 ℃;1H NMR(600 MHz, CDCl3)δ: 8.39(d,J=1.8 Hz, 1H), 7.88(s, 1H), 7.67(d,J=8.4 Hz, 1H), 7.42(t,J=7.8 Hz, 1H), 7.21(d,J=7.2 Hz, 1H), 7.13(s, 1H), 7.06~6.99(m, 2H), 3.86(s, 3H), 2.77(s, 3H);13C NMR(150 MHz, CDCl3)δ: 170.73, 168.22, 159.84, 140.92, 139.07, 135.88, 135.38, 135.09, 130.05, 125.32, 124.64, 123.10, 121.49, 117.28, 116.10, 114.23, 55.42, 26.82; MS(ESI)m/z: Calcd for C18H14NO3ClNa{[M+Na]+} 350.0554, found 350.0546。
(E)-1-乙酰基-5-氯-3-(3-氯-2-氟亚苄基)吲哚-2-酮(11): 黄色固体268 mg,产率24%,m.p.141~142 ℃;1H NMR(600 MHz, CDCl3)δ: 8.30(d,J=9.0 Hz, 1H), 7.87(s, 1H), 7.59~7.55(m, 2H), 7.43(d,J=1.8 Hz, 1H), 7.36~7.31(m, 1H), 7.26(t,J=7.8 Hz, 1H), 2.78(s, 3H);13C NMR(150 MHz, CDCl3)δ: 170.58, 167.48, 141.32, 136.71, 132.48, 129.87, 128.15, 127.80, 125.23, 124.92, 124.78, 123.21, 120.28, 119.71, 117.46, 26.78; MS(ESI)m/z: Calcd for C18H11NO2FCl2{[M+H]+} 350.0547, found 350.0422。
(E)-1-乙酰基-6-氯-3-(3-氯-2氟亚苄基)吲哚-2-酮(12): 黄色固体284 mg,产率27%,m.p.135~136 ℃;1H NMR(600 MHz, CDCl3)δ: 8.40(d,J=1.8 Hz, 1H), 7.81(s, 1H), 7.58~7.53(m, 2H), 7.37(d,J=8.4 Hz, 1H), 7.27~7.19(m, 1H), 7.06(dd,J=8.4 Hz, 1.8 Hz, 1H), 2.78(s, 3H);13C NMR(150 MHz, CDCl3)δ: 170.69, 167.48, 139.09, 132.80, 131.16, 130.69, 130.22, 130.13, 128.04, 127.68, 124.88, 124.85, 122.70, 122.40, 119.55, 118.07, 26.79; MS(ESI)m/z: Calcd for C18H10NO2FCl2Na{[M+Na]+}350.0547, found 350.0422。
(E)-1-乙酰基-6-氯-3-(4-氯-3氟亚苄基)吲哚-2-酮(13): 黄色固体275 mg,产率26%,m.p.151~153 ℃;1H NMR(600 MHz, CDCl3)δ: 8.35(d,J=1.8 Hz, 1H), 8.21(dd,J=10.8 Hz, 1.8 Hz, 1H), 7.81~7.71(m, 1H), 7.49(dd,J=15.6 Hz, 7.2 Hz, 3H), 7.24(dd,J=8.4 Hz, 1.8 Hz, 1H), 2.75(s, 3H);13C NMR(150 MHz, CDCl3)δ: 170.80, 165.77, 139.44, 136.24, 136.22, 135.82, 133.24, 130.48, 128.81, 128.78, 125.15, 122.68, 119.69, 119.36, 119.21, 117.31, 26.88, 26.79; MS(ESI)m/z: Calcd for C18H11NO2FCl2{[M+H]+} 350.0547, found 350.0422。
(E)-1-乙酰基-6-氯-3-(2,3-二氟亚苄基)吲哚-2-酮(14): 黄色固体342 mg,产率34%,m.p.136~137 ℃;1H NMR(600 MHz, CDCl3)δ: 8.41(d,J=1.8 Hz, 1H), 7.83(s, 1H), 7.40(d,J=7.8 Hz, 2H), 7.35~7.29(m, 1H), 7.26~7.18(m, 1H), 7.08(dd,J=8.4 Hz, 1.8 Hz, 1H), 2.79(s, 3H);13C NMR(150 MHz, CDCl3)δ: 170.59, 167.51, 141.34, 136.73, 129.50, 127.91,124.91, 124.72, 124.70, 124.47, 123.26, 120.31, 119.72, 119.16, 119.05, 117.47, 26.79; MS(ESI)m/z: Calcd for C17H10NO2F2ClNa{[M+Na]+}356.0260,found 356.0250。
叔丁基(E)-4-((1-乙酰基-6-氯-2-氧吲哚-3-亚丙基)甲基)苯甲酸酯(15): 黄色固体368 mg,产率31%,m.p.138~139 ℃;1H NMR(600 MHz, CDCl3)δ: 8.39(d,J=1.8 Hz, 1H), 8.11(d,J=8.4 Hz, 2H), 7.89(s, 1H), 7.66(d,J=8.4 Hz, 2H), 7.53(d,J=8.4 Hz, 1H), 7.03(dd,J=8.4 Hz, 1.8 Hz, 1H), 2.77(s, 3H), 1.65(s, 9H);13C NMR(150 MHz, CDCl3)δ: 170.63, 167.94, 164.91, 141.15, 138.12, 137.60, 136.37, 133.32, 129.93, 128.87, 126.40, 124.78, 123.04, 119.95, 117.41, 81.72, 28.19, 26.80; MS(ESI)m/z: Calcd for C22H20NO4ClNa{[M+Na]+} 420.0946, found 420.0963。
(3)16的合成
在25 mL圆底烧瓶中加入6-氯-2-吲哚酮1c500 mg(3 mmol),2n785 mg(3.3 mmol)和4 mL 甲醇,缓慢滴加哌啶25 mg(0.3 mmol),在室温下搅拌24 h。有沉淀生成,沉淀过滤后用甲醇洗涤,中间体3p。将3p(3 mmol)溶于5 mL四氢呋喃中,加入乙酸酐 1.5 g(15 mmol)和碳酸钠 1.6 g(15 mmol),在室温下搅拌12 h,加水稀释,用乙酸乙酯萃取(3×50 mL)。有机层用饱和氯化钠溶液洗涤(2×100 mL),然后用无水MgSO4干燥,减压除去溶剂,残余物经硅胶柱层析 (洗脱剂:石油醚/乙酸乙酯=10/1,V/V) 纯化得黄色固体16: 386 mg,产率30%,m.p.136~137 ℃;1H NMR(600 MHz, CDCl3)δ: 8.38(d,J=1.8 Hz, 1H), 7.78(d,J=8.4 Hz, 1H), 7.56(s, 1H), 7.42(s, 1H), 7.12(dd,J=8.4 Hz, 1.8 Hz, 1H), 6.57(s, 1H), 4.65(d,J=7.2 Hz, 1H), 3.78(s, 3H), 3.54(s, 3H), 3.37(q,J=7.8 Hz, 1H), 3.17(dd,J=18.6 Hz, 8.4 Hz, 1H), 2.97(t,J=7.2 Hz, 1H), 2.74(s, 3H), 2.47~2.40(m, 1H);13C NMR(150 MHz, CDCl3)δ: 170.74, 168.06, 167.55, 152.33, 140.70, 138.79, 138.07, 135.53, 134.78, 125.29, 124.70, 122.99, 120.73, 117.29, 110.56, 101.90, 57.25, 51.39, 49.14, 40.43, 34.48, 26.78; MS(ESI)m/z: Calcd for C22H20NO6ClNa{[M+Na]+} 452.0871, found 452.0858。
(4)17的合成
在25 mL圆底烧瓶中加入3b323 mg(1 mmol),加入二氯甲烷溶解,再加入4-二甲基氨基吡啶12 mg(DMAP, 0.1 mmol)和(Boc)2O 327 mg(1.5 mmol)在室温下搅拌6 h,加水稀释,用乙酸乙酯萃取(3×50 mL)。有机层用饱和氯化钠溶液洗涤(2×100 mL),然后用无水MgSO4干燥,减压除去溶剂,残余物经硅胶柱层析 (洗脱剂:石油醚/乙酸乙酯=80/1,V/V) 纯化得黄色固体17: 452 mg,产率36%,m.p.151~152 ℃;1H NMR(600 MHz, CDCl3)δ: 8.03(d,J=1.8 Hz, 1H), 7.86(d,J=4.2 Hz, 2H), 7.78(d,J=7.8 Hz, 1H), 7.73(d,J=7.8 Hz, 1H), 7.64(t,J=7.8 Hz, 1H), 7.43(d,J=8.4 Hz, 1H), 7.01(dd,J=8.4 Hz, 1.8 Hz, 1H), 1.70(s, 9H);13C NMR(150 MHz, CDCl3)δ: 165.79, 150.21, 141.23, 136.46, 136.09, 135.23, 132.16, 129.51, 126.81, 125.78, 125.26, 125.13, 124.05, 122.95, 119.35, 116.18, 85.02, 28.10; MS(ESI)m/z: Calcd for C21H17NO3F3ClNa{[M+Na]+} 446.0741, found 446.0733。
1.3 体外抗肿瘤活性评价
以阿霉素为阳性对照,采用Cell Titer Glo(CTG)法,以A549、 MCF-7和BGC-823为受试细胞,测试化合物1~17在体外对肿瘤细胞株的生长抑制作用。将药物用DMEM培养液稀释成实验设计浓度,按照实验分组,细胞经计数后接种于96孔培养板,2000细胞/100 μL/孔,每孔加入90 μL培养液(含血清)培养过夜,再加入10 μL药物溶液,培养72 h后,每孔加入CTG 100 μL,室温避光孵育10 min,酶标仪测定各孔化学发光值,每孔检测时间为500 ms,重复3次,取平均值,计算得IC50。
2 结果与讨论
2.1 合成
在制备中间体2n时,开始采用了戴斯-马丁氧化剂,但是其产率不高且后处理也比较繁琐,因而改采用二氧化锰氧化,产率有所提高且后处理更简单。
在制备中间体3p时,采用合成3a~3o的方法产物无法沉淀出来,这将增加化合物的纯化步骤,后续经过反应条件优化,将反应溶剂换为甲醇,反应温度为室温,反应时间为24 h,3p能以沉淀形式析出,直接过滤可得到产物,缩短了化合物的纯化步骤。
2.2 抗肿瘤活性
首先测试了目标化合物(1~17)在10 μM浓度下对A-549, MCF-7和BGC-823的抑制率,由表1可知:化合物6、8、9、11~13和16对BGC-823均具有显著的抑制作用,抑制率分别为61.32±0.36%、 80.03±1.90%、 80.03±1.90%、 72.47±1.39%、 71.67±0.78%、 78.22±1.38%和87.46±0.71%,说明这类化合物对BGC-823细胞的选择性更强。

表1 10 μM 时1~17的体外抗肿瘤活性(抑制率/%)
进一步对抑制作用显著的7个化合物(6、8、9、11~13和16)在不同浓度下对A-549, MCF-7和BGC-823的作用进行了进一步的研究,获得了相应的IC50值。由表2可知,所测试的大部分化合物对BGC-823和MCF-7增殖的抑制活性更显著,特别是化合物8和16,对MCF-7的IC50值为0.45±0.08和0.20±0.02 M,尤其是16对MCF-7增殖的抑制活性与阳性对照阿霉素相当,对BGC-823的IC50值为0.38±0.02和0.34±0.04 μM。从化合物8可以看出,在含有三氟甲基的化合物中,R和R1对这类化合物的抗肿瘤活性具有很大的影响,只有当R为H及R1为3-CF3时,才对肿瘤细胞具有抑制作用。化合物16的合成[31-32],发现京尼平苷元在抗肿瘤方面具有重要作用,且发现京尼平苷元的抗肿瘤活性与其结构中α,β-不饱和酮的结构单元密切相关,因此,基于本文的设计思路,引入了京尼平苷元结构并通过分子杂交的手段将其与2-吲哚酮的结构相结合,得到了化合物16,且该化合物对三种肿瘤细胞表现出了显著的抗肿瘤作用。
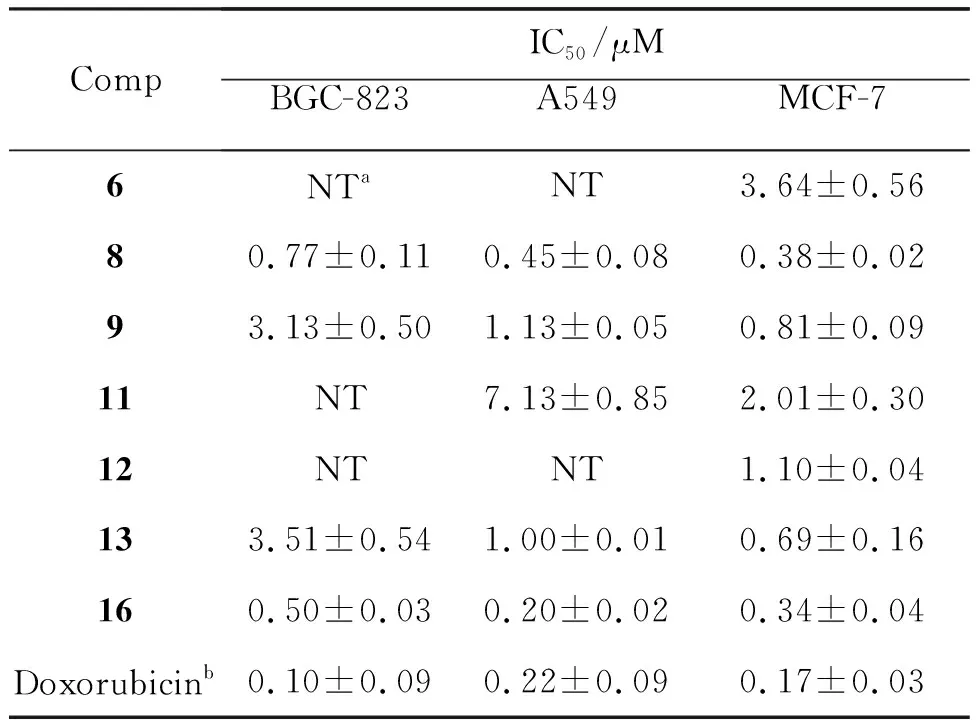
表2 目标化合物的体外抗肿瘤活性
本文以2-吲哚酮和α,β-不饱和酮的结构为核心骨架,通过分子杂交策略,设计并合成了17个目标化合物(1~17)。采用CTG法首次评价了它们对A549、 MCF-7和BGC-823细胞的抑制活性。结果显示大多数化合物对MCF-7和BGC-823细胞增殖的抑制活性更显著,特别是8和16,对MCF-7的IC50值为0.45±0.08和0.20±0.02 μM,尤其是16对MCF-7的抑制活性与阳性对照阿霉素相当,对BGC-823的IC50值为0.38±0.02和0.34±0.04 μM。初步的构效关系分析表明在结构中引入多个含有α,β-不饱和酮结构的片段可能有利于增强这类化合物抗肿瘤活性。
