手性环戊二烯基配体参与的不对称催化C—H活化/环化反应研究进展
2021-08-17严知静程泽生杨子潇陈欣怡
严知静, 程泽生, 杨子潇, 陈欣怡, 董 琳*
(1. 四川大学 a. 华西药学院; b. 生物治疗国家重点实验室,四川 成都 610041)
自从2012年Gramer课题组[1]基于环戊二烯配体发展了一系列的BINOL型C2轴手性铑金属催化剂以来,在过去的十几年中,含有环戊二烯基配位的过渡金属复合物催化的C—H键官能团化反应研究取得了显著的进展[2-6]。目前人们已经制备出大量环戊二烯基配位的过渡金属复合物催化剂来催化各类环化反应构造不同结构的手性环状化合物[7-8],如通过[4+1]环化反应构造异吲哚啉酮类和内酯类化合物,通过[4+2]环化反应构造异喹啉酮类和内酰胺类化合物,以及[2+2]环化反应、螺环化反应等等。
近年来手性环戊二烯基配位的过渡金属络合物在C—H活化取得了较好的成绩,已成为有机合成路线、高效简便、选择性好、原子经济性高等优点。这对于以这类环状化合物结构为主要原料的药物催化合成、工业化大规模生产投放有着重要意义。
然而在实际的药物合成生产中,关于环状化合物类原料及前体药物催化合成中的对映选择性的研究仍然较少。因此,本文对近年来关于手性环戊二烯基配体催化的环化反应研究进行了归纳、总结,以期能帮助此类环状化合物及相关药物化学合成的研究,特别是对各类手性环戊二烯基配位过渡金属催化剂的催化原理及设计合成思路给予新的启发。
1 手性金属催化剂参与的[4+1]环化反应
1.1 手性异吲哚啉酮类化合物的合成
2019年,Gramer等[9]报道了手性CpxRhIII催化的丙烯酰胺类化合物的对映选择性C—H活化/[4+1]环化反应,以构建一系列含有手性季碳中心的ɑ,β-不饱和γ-内酰胺类化合物(Scheme 1),其对映选择性高达97/3。
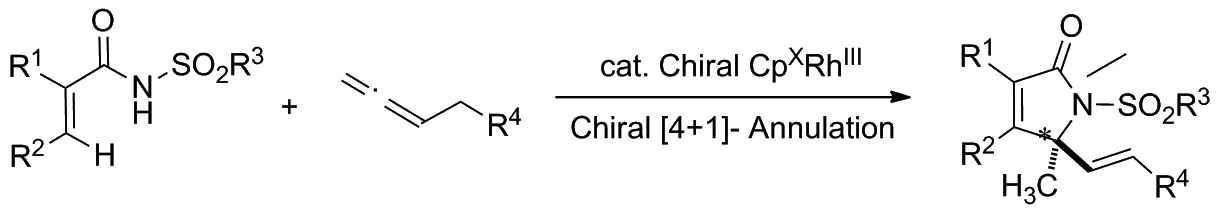
Scheme 1
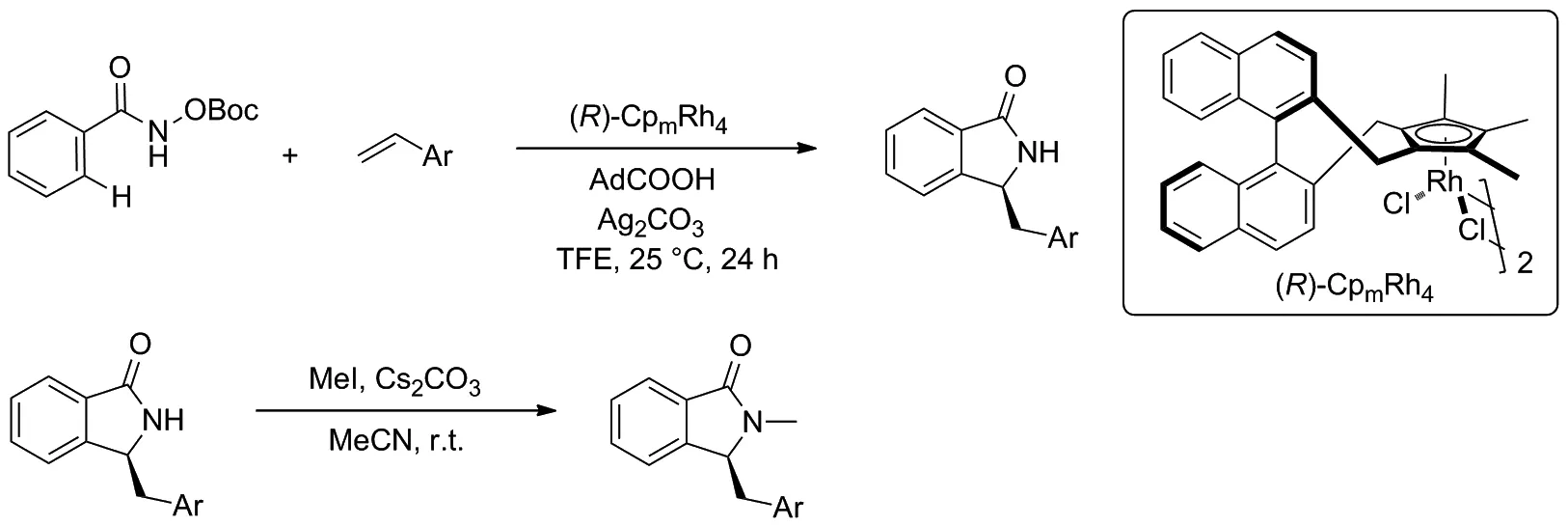
Scheme 2
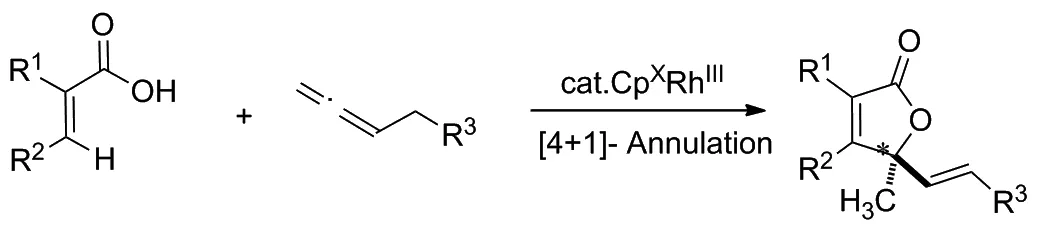
Scheme 3
2020年,You等[10]实现了CpxRhIII催化的苯甲羟肟酸衍生物与苯乙烯之间的环化反应(Scheme 2)。该反应在温和的反应条件下,经过C—H活化/[4+1]环化串联反应,以84%的产率得到3-取代异吲哚酮化合物,对映选择性高达96/4。 然后,标准产物在碳酸铯存在下,与碘甲烷进行取代反应,得到N-甲基取代产物的产率为96%,而对映选择性没有明显降低。
1.2 手性γ-内酯类化合物的合成
2020年,Gramer等[11]以部分氢化的联二萘酚为基本骨架,设计了一种新颖的手性Cpx配体。该反应的底物适用性广泛,通过不同结构的丙烯酸类衍生物和联烯类化合物反应,得到了一系列具有烯丙基立体中心的不饱和γ-内酯类化合物,其对映选择性可高达99/1(Scheme 3)。
2 手性金属催化剂参与的[4+2]环化反应
2.1 手性异喹啉酮类化合物的合成
在以往的C—H活化/[4+2]环化的相关报道中,手性化合物的合成往往采用分子间合成的方式,而分子内的[4+2]环化合成更具有挑战性。2018年,Antonchick和Waldmann课题组[12]以不同取代的哌啶环结合环戊二烯基而成的铑金属为催化剂,探究了N-氧烷基苯甲酰胺类化合物与炔烃的分子内[4+2]环化反应,同时,利用底物本身的芳(杂)环结构合成出结构新颖的轴手性异喹啉酮类化合物(Scheme 4)。该反应具有较高的产率与对映选择性,且在对底物进行不同的结构修饰时,仍可以保持较高的对映选择性。
Scheme 4
Scheme 5
Scheme 6
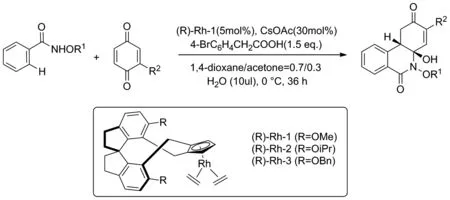
2020年,Gou和Wang课题组[13]以N-甲氧基苯甲酰胺类化合物与苯醌为反应原料,合成一系列的手性异喹啉酮类衍生物(Scheme 5)。在反应中,苯醌发挥了双重作用,一方面将催化剂CpRhII(C2H4)2原位氧化成CpRhIII催化反应进行,另一方面参与反应中间体的形成,通过自身与催化剂发生配位推动反应的进行,从而帮助完成[4+2]分子间环化反应。该反应通过螺环化的手性铑金属催化剂进行立体选择性的合成,具有很高的产率与对映选择性。
2.2 手性α,β-不饱和内酰胺类化合物的合成
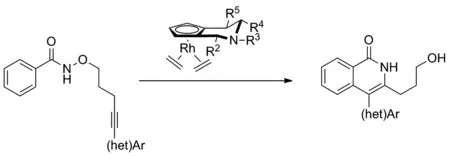
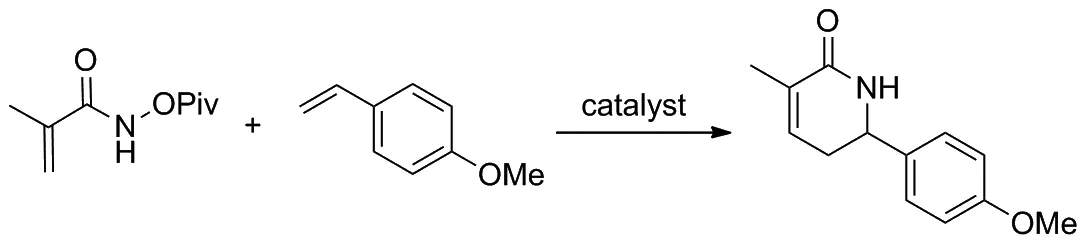
2019年,McNaughton和Rovis课题组[14]提出利用人工金属酶进行不对称催化C—H活化和[4+2]环化反应来合成手性α,β-不饱和内酰胺类化合物,并以此作为药物合成中间体构造哌啶(Scheme 6)。该反应以甲基丙烯酰胺与苯乙烯及其衍生物为反应底物,获得的产品可以衍生为具有良好对映选择性的哌啶。课题组还发现单体链霉亲和素相较于四聚体亲和素具有更好的催化活性,其所得产物也具有更高的产率和更好的对映选择性。
2.3 手性磷类化合物的合成
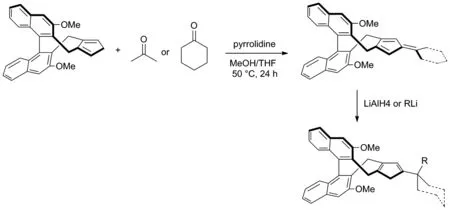
2018年,Sun 和Cramer等[15]开发了一系列三取代的手性环戊二烯配体并利用该类催化剂进行手性含膦化合物的合成(Scheme 7)。实验证明了双取代手性环戊二烯配体骨架可以与酮缩合成相应的富烯[16],并在LiAlH4或RLi的还原下生成相应的连有较大取代基的三取代手性环戊二烯的催化剂配体。
Scheme 7
Scheme 8
Scheme 9
Scheme 10
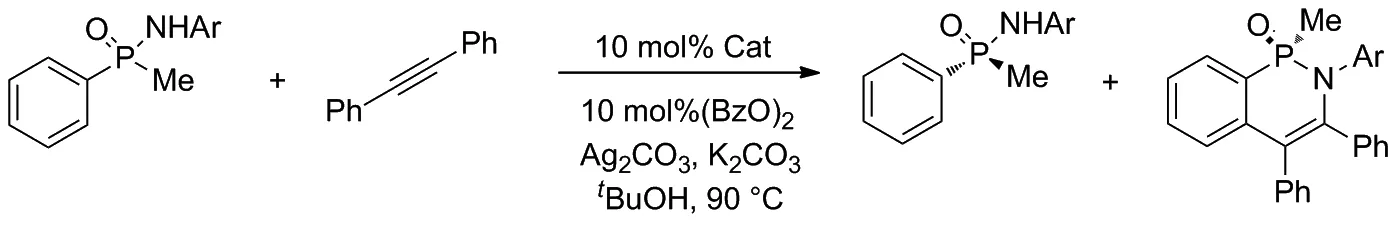
随后的实验证明,在环戊二烯中心位置引入体积较大的第三取代基可以显著提高动力学拆分的选择性,并通过动力学拆分提供手性膦化合物。实验还使用不同类型的催化剂参与外消旋苯基甲基次膦酰胺和二苯乙炔的反应,并统计了不同催化条件下所得产物的产率,验证了Cpx三取代催化剂优越的选择性(Scheme 8)。
2. 4 手性磺酰亚胺类化合物的合成
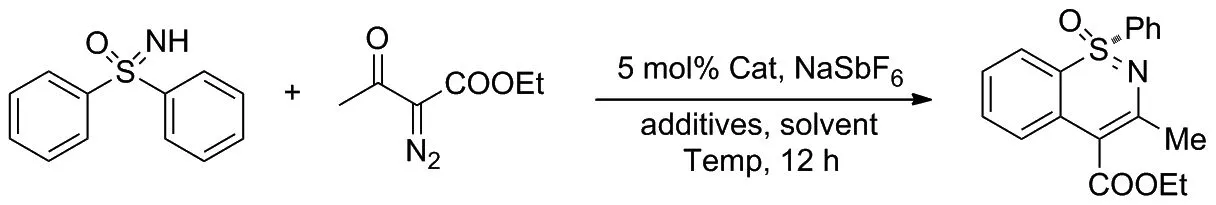
磺胺嘧啶中的立体中心:硫原子是一种潜在的手性药物结构单元。2018年, Sun和Cramer[17]提出了一种直接催化合成含有手性硫原子的1,2 -苯并噻嗪类化合物的方法(Scheme 9)。
Scheme 11
Scheme 12
Scheme 13
该课题组在手性环戊二烯基铑(III)催化剂与适当的酸类添加剂的作用下,以二苯亚砜和重氮乙酰乙酸乙酯为模板底物,合成手性的1,2-苯并噻嗪类化合物,得到良好的收率和对映选择性。同时,他们还发现该转化过程对不同取代修饰的磺基亚胺均具有较高的对映选择性,而使用手性酸类添加剂能产生协同作用并提高反应的选择性。
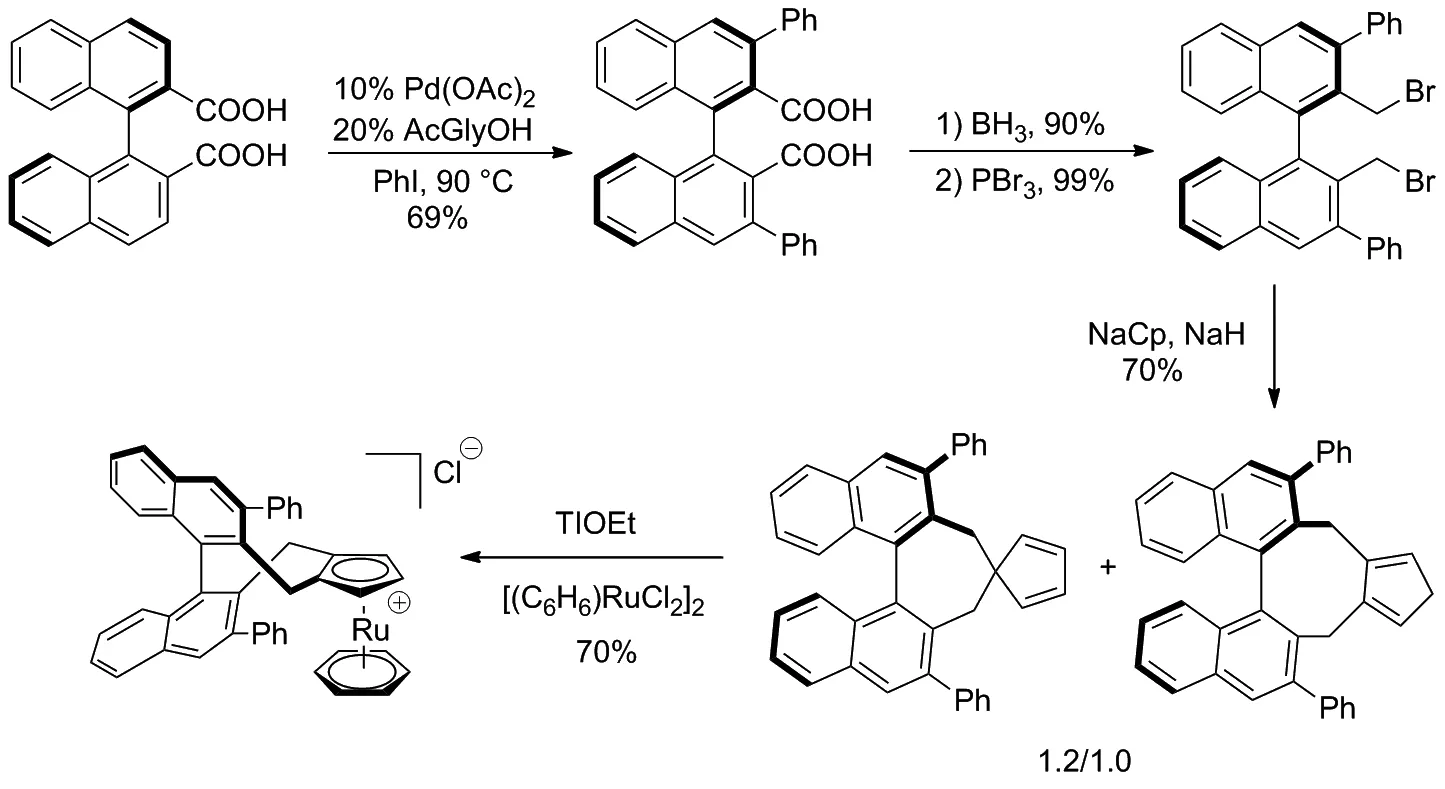
2017年Cramer等[18]设计了一种手性CpRuIICl络合物并缩短了该催化剂的合成路线(Scheme 10),用适量PdII催化二羧酸[19]与碘苯的偶联反应(双羧酸作为导向基团),进行邻位活化[20]从而获得双芳基产物,经还原和取代后得到了溴代产物,再通过Cp基团环化和络合生成稳定的手性CpRuII配合物。
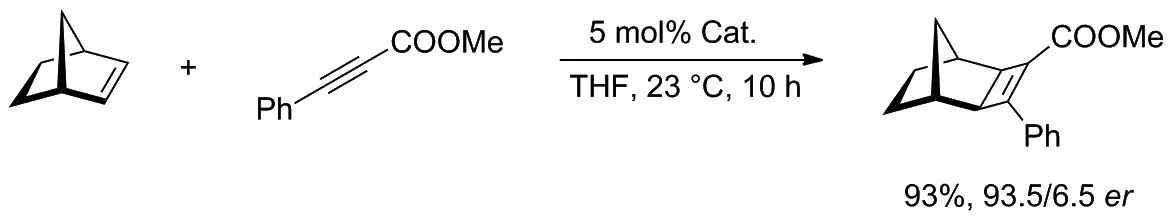
在以降冰片烯和炔烃为原料生成环丁烯的实验中(Scheme 11),该类催化剂对生成[2+2]-环加物表现出优异的反应活性和对映选择性,并降低了催化剂的负载量。催化剂中的氯离子具有很强的反离子作用,可将相应的非选择性阳离子络合物转化为具有高度对映选择性的中间体。
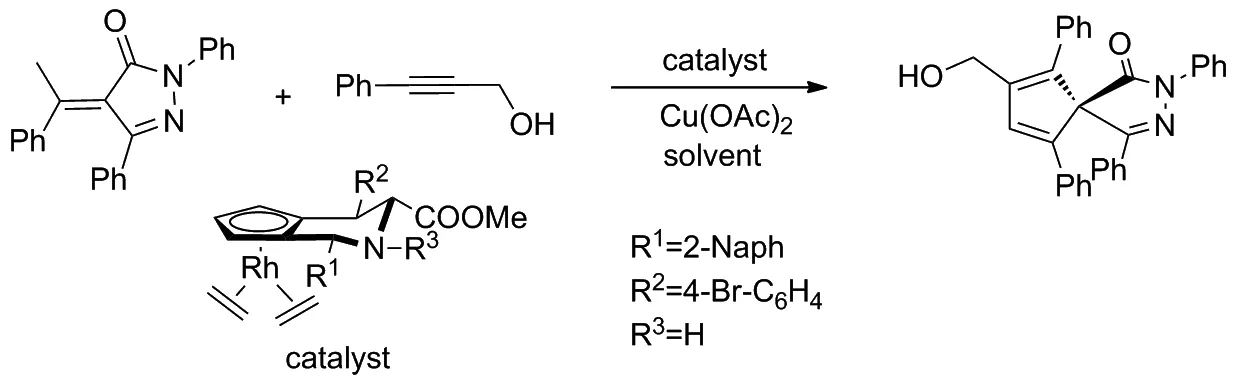
2019年,Waldmann等[21]以 CpxRhIII为催化剂,使用α-芳基吡唑啉酮和不对称芳基炔进行对映选择性环化反应,通过C(sp3)—H活化获得一系列包含全碳四元中心的螺并吡唑啉酮(Scheme 12)。该反应产率高、产物对映选择性好,可以在温和的反应条件下获得结构多样的产品。
5 手性金属催化的轴手性化合物的合成
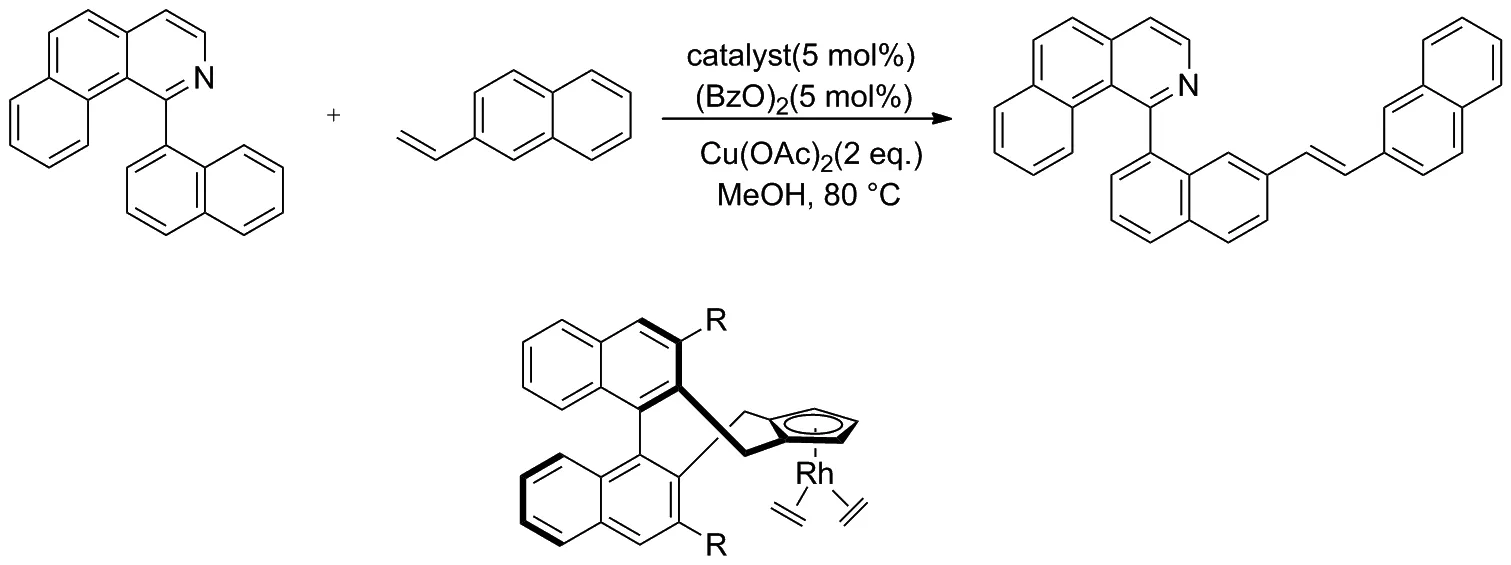
2014年, Zheng和 You等[22]报道了1-(萘-1-基)苯并[h]异喹啉和2-乙烯基萘联芳基的对映选择性烯基化反应(Scheme 13)。该反应使用手性CpRhⅢ催化剂,通过联芳基化合物的直接C—H键烯基化合成了新型轴手性联芳基骨架,并取得了良好的收率和对映选择性。
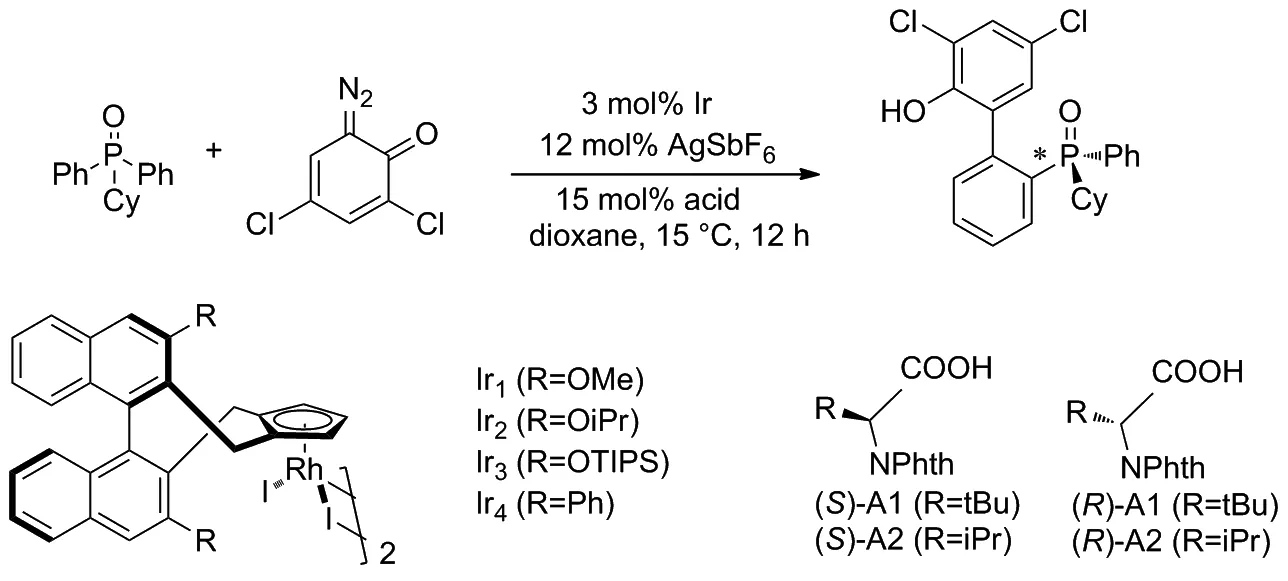
2018年,Cramer等[23]以二苯基环己基氧化膦和二叠氮化醌为原料,在IrIII催化剂的催化下通过对映选择性C—H芳基化反应获得了轴手性联芳基膦氧化物(Scheme 14)。证明了络合手性Cpx配体与带有亮氨酸衍生的对羟基苯磺酸(S)-甲酸酯(对苯二甲酸酯基)基团的IrIII催化剂可以带来良好的对映选择性和收率。该技术适用于在膦上具有手性的双芳基膦氧化物,以及对立体选择性要求高的轴向手性联芳基骨架的构建。
Scheme 14
本文总结了近年来关于手性环戊二烯基配体参与的环化反应的研究进展,为手性环戊二烯基配位的过渡金属的设计合成及催化应用提供了新的思路。同时,此类催化剂具有能够缩短合成路线、高效简便、选择性好、原子经济性高等优点,对以这类环状化合物结构为主要原料的药物催化合成、工业化大规模生产投放有着重要意义。
