89例肾血管周上皮样细胞分化的肿瘤病例分析
2021-08-17张弓单立平宋永胜
张弓,单立平,宋永胜
具有血管周上皮样细胞分化的肿瘤(PEComa)于1996年由Zamboni[1]等首次报道及命名,2013年WHO分类将PEComa定义为“一种间叶性肿瘤,瘤细胞显示与血管壁有局部相关性并通常表达色素细胞标记和平滑肌标记”。PEComa家族目前包括血管平滑肌脂肪瘤(AML)、肺透明细胞“糖”瘤(CCST)和淋巴管肌瘤病(LAM)、原发性肺外糖瘤、恶性透明细胞瘤等。对于PEComa的认识始于AML、CCST、LAM这3种肿瘤,最初认为它们是毫不相关的3种肿瘤,然而1991年之后的几年间多项研究证明它们中含有黑色素细胞相关蛋白(HMB45,主要为上皮样细胞所表达)等多种相同或相似的免疫表型,同时有相似的上皮样细胞的形态学表现,因此在1996年Zamboni等将这些发生在不同部位、看似互不相关的肿瘤,根据其基本的结构及其特殊的免疫表型特点定义为PEComas。直至2002年WHO第一次将PEComa明确定义[2]。PEComa这种肿瘤可见于很多部位,如肝、胰腺、肝、胰、直肠、腹部等,原发性肾PEComa临床较为罕见。PEComa有2种主要的组织学类型:经典型(AML)和上皮样型(EAML)。此外,还有一种少见类型为恶性PEComa,可能与上皮样肿瘤转化有关。与典型的良性肾血管平滑肌脂肪瘤相比,肾上皮样血管平滑肌脂肪瘤(EAML)因其具有上皮样肿瘤特征,被认为是具有恶性潜能的罕见间充质肿瘤,是肾PEComa最典型的代表之一。本研究回顾性分析2012年1月至2018年12月中国医科大学附属盛京医院第二泌尿外科收治的89例肾PEComa患者的病例资料,对该病的诊断、治疗及预后进行总结,从而提高对该病的认识。
1 资料与方法
本研究收录2012年1月至2018年12月中国医科大学附属盛京医院第二泌尿外科收治的经病理确诊的肾PEComa患者。纳入标准:根据Folpe等人于2009年提出的标准:不确定的恶性潜能(uncertain malignant potential,UMP)或恶性类型[3]。共计纳入病例89例,其中男11例,女78例,男女比例为1∶7。年龄16~65岁,平均46岁。病程为3 d至6个月。左侧46例,右侧43例。81例系体检或因其他疾病检查而发现,5例因肿瘤破裂出血就诊,3例因腰痛就诊。超声检查呈高回声、稍高回声或混合性回声团块。所有病例均行双肾增强CT检查,均行手术治疗。
邀请医院影像科及病理科高年资医师对典型图像进行二次阅片及技术指导,并进行分组及数据整理。以SPSS 22.0进行数据分析,比较采用相关性检验,连续型计量资料比较采用两独立样本t检验,计数资料采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 89例病例良恶性分析 89例病例均经手术切除肿瘤,其中单侧占位82例,双侧占位7例;7例双侧占位及40例单侧占位病例行根治性肾切除术,其余42例行保留肾单位手术。依据术前影像评估及术中所见,肿瘤最小为1.1 cm×0.5 cm,最大为26 cm×20 cm×15 cm。CT增强后多数病例呈不均匀强化,31例术前诊断考虑肾恶性肿瘤可能性大,其余58例均诊断为肾错构瘤。CT及超声等影像学表现并无明显特点,术前无法对其进行准确的良恶性分类。根据术后病理,参照Folpe三分法(表1),89例病例中,良性41例,恶性潜能未定(uncertain maligant potential, UMP)45例,恶性3例。UMP、恶性肾PEComa与良性肾PEComa相比,差异无统计学意义(P>0.05)。见表2。
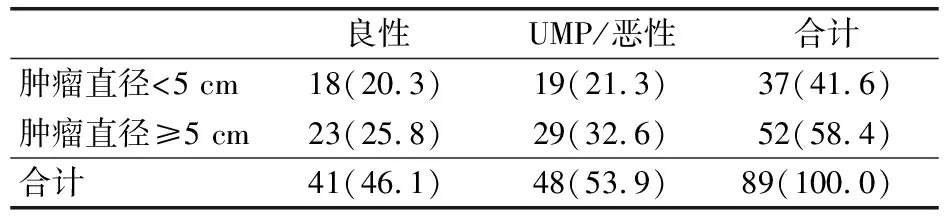
表2 病理确诊为肾PEComa的89例病例分析[例(%)]
2.2 肾PEComa良恶性的典型病理表现 所有病例的确诊均依靠术后病理及免疫组化。PEComa主要表达色素细胞标记,包括HMB45、PNL2、Melan-A、tyrosinase和MiTF,一般不表达S100蛋白。部分病例可同时表达象征平滑肌分化的标记物,包括SMA、MSA、Desmin、calponin和h-CALD,具体表达情况因病例而异。另外,亦有少部分病例可表达capthesin K、TFE3和细胞角蛋白。见图1。
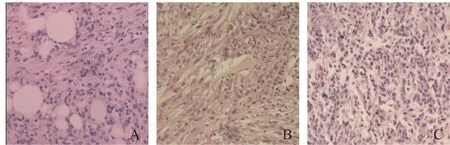
注:A为良性,B为恶性潜能未定,C为恶性图1 肾PEComa典型病理表现
2.3 89例肾PEComa病例随访情况 89例病例随访0.5~6.5 年,失访2例。1例肾PEComa根治术后5.5年行肝胆脾超声发现一可疑复发病灶,未进一步治疗; 3例患者术前检查发现双侧占位,较大一侧根治术后1~2年复查即发现对侧增大,现观察随访中;1例根治术后5年对侧复发,其余82例未发现明确复发占位。除失访外,87例均健在。
3 讨论
Folpe等人于2009对PEComas的形态和病理特征进行分类描述,在这之前,此类疾病名称一直沿用血管平滑肌脂肪瘤(1951年Morgan命名),镜下特点:含有大量成熟的脂肪组织,平滑肌组织和厚壁血管组成,也叫错构瘤。肾PEComa主要包含两大类,一类是良性的AML,另一类在形态学上表现为肾的上皮样AML(EAML),行为学上也呈低度恶性或恶性。到目前为止,肾PEComa的病例还不是很多,但同时也是最常见的PEComa类型。目前的共识是,PEComa具有恶性潜能,但是明确恶性的病例罕见,仅见个案报道,因此术前明确良恶性诊断对制定治疗方案具有重要的指导意义。
目前诊断肾PEComa主要依靠病理标本及免疫组化染色。过去认为,PEComa内含有的血管周围细胞为平滑肌细胞,但目前重新认识,认为这些细胞并不是成熟的平滑肌细胞,因此根据形态学命名为梭形细胞,根据梭形细胞分化情况来判定良恶性。Folpe等人于2009年根据PEComa的形态和病理特征,将其分为良性、UMP或恶性[3]。至2014年,有专家对这一分类作了一些修改,将良性类型和UMP归入一个类别,即恶性潜能未定类型[4]。根据Schoolmeester二分法,临床诊断PEComa的良恶性基于以下4个特征:肿瘤直径≥5 cm;高级别的核特征;坏死,血管侵犯;核分裂>1个/50 HPF。少于这4个特征的肿瘤是恶性潜能未定类型,否则是恶性的。本次研究所选89例病例中,以上4个特征均满足的肾PEComa仅有2例,其他均为恶性潜能未定类型。免疫组化染色对肾PEComa 的诊断具有重要作用,表达肌源性和黑色素细胞标志物,如 HMB45、α-SMA、Melan-A/Mart-1、Mitf及Actin等呈阳性表达,少部分表达Desmin,而上皮细胞标记EMA、CK阴性,从而确诊[5]。
肾PEComa的影像学诊断一般不困难,主要依靠脂肪成分,在超声表现为高回声,CT表现为负值。但是目前尚无法准确区分UMP和恶性的肾PEComas,一般对于大于5 cm的肿瘤,要警惕恶性的可能。一些不典型的,特别是脂肪成分含量少的病例,文献报道约14%[6],不容易与肾细胞癌相鉴别。进一步血管造影提示动脉瘤样扩张表现,可以帮助进一步明确诊断,在造影检查中,肾PEComas有明显的透明区。本研究中,超声诊断误诊肾癌12例,CT误诊肾癌10例。无论是临床特点或是超声表现甚至是CT表现,UMP和恶性的肾PEComa都没有明显的特异性,尤其是与良性的肾PEComa相比差异无统计学意义(P>0.05),因此主要通过术后病理确诊。
PEComas可能与某些基因改变有关,结节性硬化症(TSC)是一种常染色体显性遗传疾病,50% TSC病例合并PEComa,且肿瘤多中心和双侧常见,研究表明这与mTOR表达上调有关[7]。另有研究发现,TFE 3(转录因子E3)的易位与PEComas有关[4,8],TFE3是位于x染色体短臂上的微量邻苯二甲酸转录因子(mitf)基因家族的一个成员,在既往的研究中,TFE3常与肾癌及易位性肾癌联系在一起,这似乎揭示了肾PEComa具有不确定恶性潜能的原因之一。TP53通路也被认为与单纯上皮样PEComa的侵袭性生物学和不可预知的临床行为有关[8]。然而,这些肾PEComa的基因异常还需要更多的证据证明。这些相关基因的检测将有极大可能帮助临床术前诊断,从而更好地指导后续治疗方案。目前尚无肾PEComa特异性的血清标志物报道。要找到区分PEComa和其他肿瘤的特定标记非常困难,基因和蛋白组学分析可能对找到这样的标志物有所帮助。
目前肾PEComa的治疗主要依据肿瘤的良恶性以及疾病的自然进程,主要关注出血风险。多数研究认为肿瘤直径4 cm是外科治疗临界值[9]。外科治疗主要采用手术治疗和介入治疗的方式,目前主要采用微创治疗的方式。由于肿瘤缺乏外科包膜,与正常肾脏的界限不清,因此在腔镜下整块切除困难,多采用肿物部分切除,以吸引器将残余肿瘤组织吸除技术。肾PEComa在治疗上包括动态监测、动脉栓塞、手术切除以及mTOR抑制剂治疗[10]。尽管恶性诊断罕见,目前仅以个案报道的形式,但肿瘤直径≥5 cm的病例,具有恶性的可能,在临床处理要慎重,采取保肾手术时,尽量采取肿瘤整块切除,避免局部种植和肿瘤残余。如果术后病理提示恶性,建议二次手术切除患肾。此次研究选取的89个病例中,保留肾单位手术患者的预后优于根治性肾切除术患者,这也许与随访时间及术前根据恶性程度评估决定的术式有关。因为肾PEComa术前影像学难以确诊,不除外恶性的无论大小均建议手术;而术前诊断为错构瘤的肾PEComa,手术指征实际上参照了良性的错构瘤,即肿瘤直径超过4 cm,考虑到此种术前诊断为错构瘤的肾PEComa比例较高,手术指征应考虑适当放宽。在病理确诊前,影像学确诊肾PEComa较为困难,在适当放宽手术指征后,笔者的建议是若术前检查提示不除外恶性或是体积较大的肿物,应当考虑手术治疗;对于影像学明确报告为错构瘤且体积较小,可以观察,但需严密随访。对于高龄或患有严重基础疾病等这样的有禁忌证的患者,则建议动态监测,如有必要,动脉栓塞也是很好的选择。而对于辅助治疗,目前为止并没有研究明确的指出有效的化疗药物。然而,由于mTOR基因在与TSC相关或非相关的PEComa发生、发展中均有重要作用,mTOR抑制剂如依维莫司自然就成为针对PEComa的“靶向药物”,这一药物的治疗效果也已经得到了确切的证实[11-12]。
4 结论
本研究报道了89例肾PEComa病例,均经手术病理及免疫组化诊断,其中1例为恶性。由于部分PEComa其具有恶性潜能,与恶性肿瘤难以鉴别,找寻到良性与恶性PEComa以及其他类型恶性肿瘤在影像学中上皮成分表现的规律可能将成为解决这一问题的关键。手术治疗主要采用保留肾单位肾肿物切除肿瘤,对于肿瘤直径≥5cm的病例,有恶性的风险,建议采用肿物整块切除术;对于肿瘤直径<5 cm的病例,良性可能性大,多采用肿物部分切除,以吸引器将残余肿瘤组织吸除技术,笔者所在中心采用免缝合方式和单极电凝止血方式,利用电灼方式可以保证切缘阴性。目前仍需要更多的诊断和治疗这种肿瘤的经验。
