上调miR-433表达抑制结直肠癌细胞系增殖
2021-08-16王宏伟张继红张保祯董欣敏
张 剑,张 彤,王宏伟,张继红,张保祯,董欣敏
(内蒙古医科大学附属医院 1.放疗科;2.普外科,内蒙古 呼和浩特 010050;3.内蒙古医科大学附属人民医院 肿瘤内科,内蒙古 呼和浩特 010010)
结直肠癌是常见的恶性肿瘤之一,全世界每年的新诊病例可达136万,病死率居恶性肿瘤的第4位[1]。中国结直肠癌发病率、病死率尽管处于非高发水平,但其发病总例数及死亡总例数均高居世界第1位,且仍逐年上升[2]。微RNA(microRNAs,miRNAs)是一类非编码、内源性、长度19~25个碱基的小分子RNA,通过对3′非编码区的3′-UTR特异结合,与多种mRNA发生反应,通过不完全互补反应以抑制mRNA翻译,通过完全互补反应以促进mRNA降解,调控、诱导多种编码蛋白质的基因表达,从而参与机体几乎所有细胞的增殖、分化、凋亡等生命活动[3],并参与肿瘤细胞增殖、血管生长,或在远处脏器构建利于转移的微环境,进一步诱导肿瘤细胞发生转移、侵袭[4]。miR-433是位于第12号染色体的编码基因,研究表明其高表达可以抑制细胞的迁移、增殖和分化,与肿瘤的发生呈负相关[5];胃癌、肝癌中miR-433作为抑癌基因存在,而其高表达与浆液性卵巢癌不良进展预后亦高度相关[6]。但目前尚缺乏miR-433与结直肠癌侵袭、转移的相关研究,本研究拟分析miR-433在结直肠癌中表达状况及miR-433对结直肠癌发生、发展过程中的影响以及二者的相关性,以期寻找结直肠癌新的靶向治疗方向。
1 材料与方法
1.1 材料
1.1.1 细胞及试剂:人类结肠癌细胞系(HT-29、HCT-116和SW480)、人正常结直肠黏膜细胞系(NCM460)(中国细胞库)。
实时定量PCR试剂盒、RNA提取试剂盒[天根生化科技(北京)有限公司];碘化丙啶、Giemsa(Sigma-Adrich公司);CCK-8试剂盒(同仁化学研究所);细胞转染试剂、miR-433模拟物(上海吉玛生物有限公司);细胞培养基及血清(Gibco公司)。
1.1.2 入组人群和组织样本:获取2018年5月至2019年6月收治的125例结直肠癌患者的组织样本检测miR-433表达。其中女52例、男73例,平均年龄(47.8±10.5)岁;所有纳入对象心、肝、肾、骨髓功能正常。病理学诊断为结直肠癌患者且接受了手术切除治疗;排除标准:家族性腺瘤息肉病、遗传性非息肉病性结直肠癌、多个病灶的原发癌,以及术前接受放疗或化疗、新辅助治疗的患者。第1组:结直肠癌患者的癌组织样本、癌旁组织样本和癌病灶远端的正常结直肠黏膜,第2组:Ⅰ~Ⅳ 期(根据UICC分期系统)结直肠癌患者样本。组织样本从手术室取得,清洗后并立即于液氮或-80 ℃冷冻储存备用。本研究伦理委员会批准[WZ(2021023)],患者均于参与本研究前签署书面知情同意书。
1.2 方法
1.2.1 实时定量PCR检测mRNA:用RNA提取试剂盒从结直肠癌组织样本和结直肠癌细胞中分离提取组织或细胞中的总RNA定量。定量后将提取到的总RNA使用PrimeScript RT试剂盒反转录成 cDNA,由此产生的cDNA在miR-433引物作用下,使用SYBR PCR反应混合液进行扩增。miR-433的相对量化水平应用2-ΔΔCt方法计算。
1.2.2 稳定和瞬时过表达miR-433结直肠癌细胞株的转染:构建miR-433过表达载体,在结直肠癌细胞系中通过克隆含完整的miR-433 cDNA编码区的DNA片段扩增到pcDNA3.1载体。用Lipofectamine2000将Pre-miR433瞬时转染结肠癌细胞。用RT-qPCR验证miR-433的转染效率,U6作为内参进行评估。
1.2.3 CCK-8法检测细胞增殖:采用细胞计数Kit-8评估肿瘤细胞增殖能力。miR-433转染后的肿瘤细胞以5×103个/孔种植到96孔板。根据操作要求,48 h后细胞中加入CCK-8试剂孵育,于酶标仪下测定A值。计算细胞活性,计算公式:细胞相对活性=实验组A值/对照组A值×100%。
1.2.4 流式细胞测量术分析细胞周期:将肿瘤细胞接种到预先经4 ℃、18 h包被有10 μg/mL纤连蛋白的96孔板,经37 ℃、90 min孵育使细胞结合。孵育结束后,使用细胞计数Kit-8量化附着细胞。检测miR-433转染后细胞周期分布的变化,培养细胞并以miR-433 mimics 瞬时转染48 h后用PI染色,以流式细胞术检测细胞周期分布。
1.2.5 Transwell小室法检测迁移和侵袭:将8 μm孔径的半透膜放入24孔的细胞培养板。将培养的结直肠癌细胞按2×105个/mL加入到无血清条件的上室,室底部充满了含有20%胎牛血清的细胞增殖基质,37 ℃孵育。24 h后非迁移的细胞仍然在隔膜的上表面层,可以被棉球檫掉,而迁移的细胞已移动到膜的下层并被冰冷的甲醇固定,用5% Giemsa 染色,在光学显微镜下随机选取10个视野200倍放大计数,每个样本重复计数3次。肿瘤细胞侵袭实验用预先包被了基底膜基质的半透膜进行,其他步骤同上述细胞迁移实验。
1.2.6 肿瘤细胞划痕愈合实验:培养细胞,用miR-433模拟物瞬时转染48 h,进行划痕愈合试验。简言之,肿瘤细胞形成单层细胞后,使用10 μL微量移液管划一个伤口,然后用冰冷的PBS简单的清洗细胞,进一步培养48~72 h。
1.3 统计学分析

2 结果
2.1 miR-433在临床标本中的相对表达
与癌旁组织相比,miR-433在结直肠癌组织CRC中表达显著降低(P<0.05)(图1A)。在结肠癌患者血清中miR-433水平也显著低于健康人群(P<0.05)(图1B)。从TNM Ⅰ期到Ⅳ期,结直肠癌组织内miR-433表达逐渐降低(P<0.05)(图1C)。
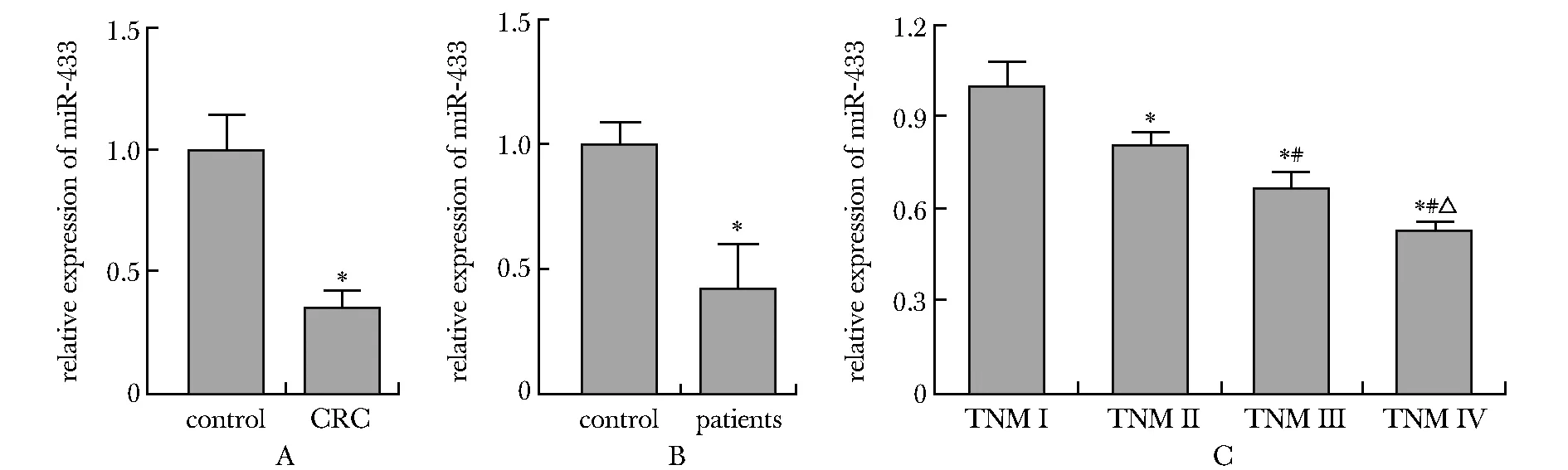
A.miR-433 expression in rectal cancer and adjacent tissues,*P<0.05 compared with control group;B.miR-433 expression in serum of colorectal cancer patients and normal people,*P<0.05 compared with control group;C.miR-433 expression in different stages;*P<0.05 compared with TNM Ⅰ group;#P<0.05 compared with TNM Ⅱ group;△P<0.05 compared with TNM Ⅲ group图1 miR-433在直肠癌组织和癌旁组织以及健康人群血清中的表达Fig 1 Expression of miR-433 in rectal cancer and adjacent tissues of patients and serum of normal population
2.2 miR-433在直肠癌系和正常细胞系的表达
与健康人结肠上皮细胞系NCM460相比,在结直肠癌细胞系HT-29、HCT-116、SW480中,miR-433表达下调(P<0.05)(图2)。
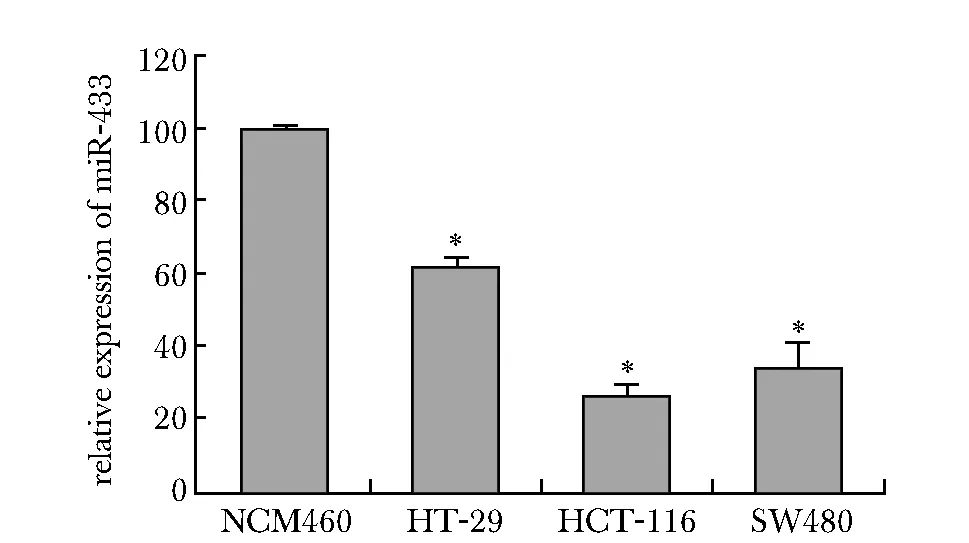
*P<0.05 compared with NCM460 group图2 miR-433在直肠癌系和正常细胞系的表达Fig 2 Expression of miR-433 in rectal cancer cell lines and normal cell line
2.3 上调miR-433表达抑制SW480细胞系增殖
SW480转染miR-433模拟物(图3A),与对照miRNA组相比,SW480细胞增殖水平明显降低(P<0.05)(图3B)。
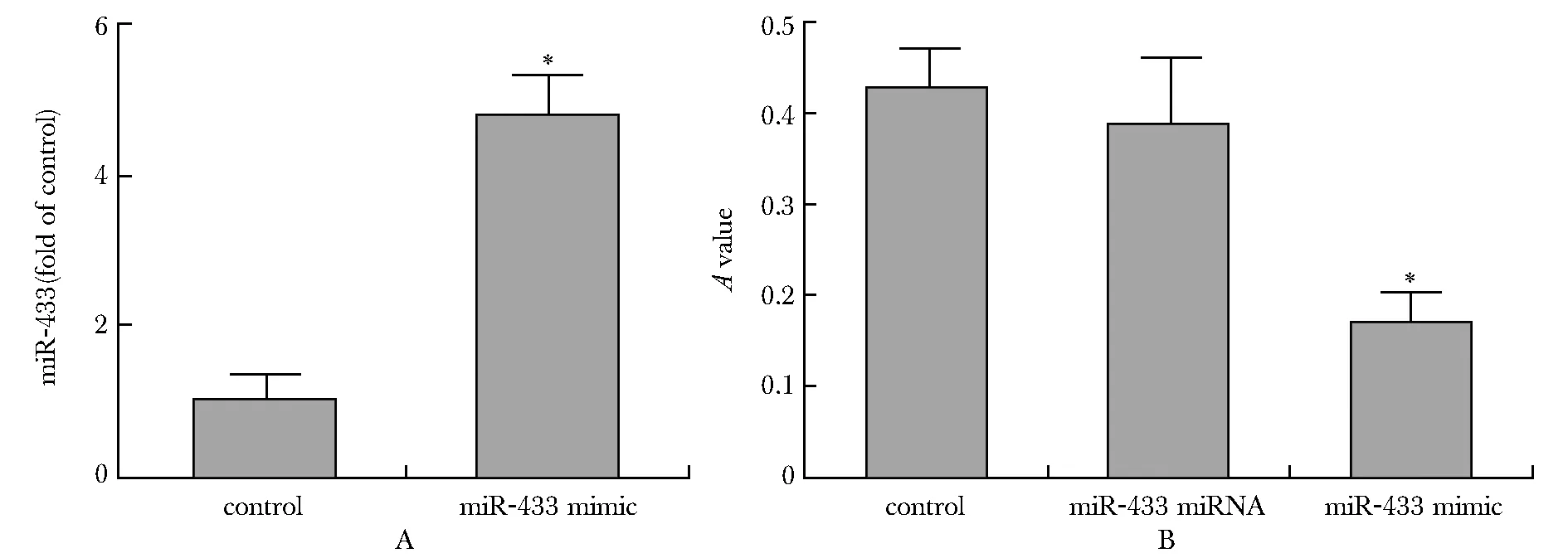
A.miR-433 mimic transfection;B.the effect of miR-433 minic transfection on the proliferation of SW480;*P<0.05 compared with control group图3 上调miR-433对SW480增殖的影响Fig 3 Effect of up-regulation of miR-433 on proliferation of SW480
2.4 上调miR-433表达诱导SW480细胞周期阻滞
SW480细胞转染miR-433 mimic后,G2期和M期细胞明显增加(P<0.05)(图4)。

图4 上调miR-433表达对SW480细胞周期阻滞的影响Fig 4 Effect of up-regulation of miR-433 on cell cycle arrest in SW480 cells
2.5 上调miR-433抑制SW480细胞侵袭与迁移
SW480具有较强的迁移能力。上调细胞内miR-433表达后,迁移能力显著下降(P<0.05)(图5A);对照组以及对照miRNA组细胞均有明显的侵袭穿透基质胶现象,转染miR-433 mimic后,与对照miRNA组相比,穿膜数目明显减少(P<0.05)(图5B)(表1)。
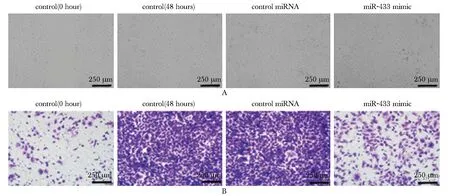
A.effect of miR-433 on invasion;B.effect of miR-433 on migration图5 miR-433对SW480细胞侵袭和迁移的影响Fig 5 Effect of miR-433 on invasion and migration of SW480 cells

表1 上调miR-433抑制细胞迁移与侵袭Table 1 Up-regulation of miR-433 decreased cells migration and invasion(%)
3 讨论
人类编码miRNA数千个,可调节约30%以上的人类基因蛋白。且每个miRNA可产生多个靶点效应,每个靶点又会接受多个miRNAs调控。肿瘤的进展过程中,由于表观遗传学及大量遗传学的变化,使得蛋白和基因表达异常,细胞凋亡、细胞黏附、细胞周期、DNA修复等亦受到影响[7]。故研究miRNA与肿瘤早期诊断、分期变化、侵袭、迁移、预后和复发等机制密切相关[8],其既可作为抑癌基因促进抑癌因子释放,也可作为致癌基因诱导肿瘤发生,其功能均取决于所调控之靶基因[9]。pri-miR-433含1 809个核苷酸、124个碱基对。同于12号染色体的miR-127基因与其有297个碱基对发生重叠。故存在miRNA之间的基因结构相互重叠,从而可扩大miRNA基因本身所携带的可应用信息量,进一步适应于较多种类的复杂的生理相关功能的调节[10-11]。本研究着重探讨miR-433对结直肠癌细胞生物学功能的影响。首先,检测miR-433在临床组织标本中的表达水平,与非肿瘤组织相比,癌组织中miR-433的表达水平明显降低,同时在血清中也得到了类似的结果。此外,本研究也证实,在TNMⅠ~Ⅳ 分期中,miR-433的表达水平也逐渐降低。这表明miR-433水平与结直肠癌疾病进展呈一定的负相关。
为了证实miR-433与结直肠癌生物学中的作用,随后检测了结直肠癌细胞系HT-29、HCT-116、SW480和正常的NCM460细胞系中miR-433的表达水平,结果示:HT-29、HCT-116和SW480中miR-433表达水平显著低于正常结直肠细胞系NCM460。随后以SW480为研究对象,通过转染miR-433 mimic,检测细胞的增殖水平、细胞周期以及侵袭与迁移的变化。CCK-8结果显示,转染miR-433 mimic以上调其表达水平后,与对照组相比,细胞的增殖活性明显降低。流式细胞术结果也显示,过表达miR-433 minic后,G2和M期细胞明显增多,说明miR-433参与细胞周期阻滞,与其他研究结果类似[12]。恶性肿瘤最显著的特征是侵袭与迁移。随后通过划痕实验和Transwell小室法也证实,上调miR-433表达后,细胞的侵袭与迁移水平显著降低,表明miR-433能负向调控SW480细胞的增殖与转移。
总之,本研究证实miR-433高表达可以抑制结肠癌细胞的迁移、增殖,与肿瘤的发生呈负相关。miR-433的异常调节可能是结直肠癌诊断和预后的一个潜在生物标志物。结合生物标志物组合的敏感性和特异性,通过调节血浆、组织中miR-433的方法可能发展成为结直肠癌防治的重要靶点。
