普伐他汀激活子痫前期小鼠MAPK抗凋亡信号通路
2021-08-16王芙蓉贺丰杰
王芙蓉,严 谨,贺丰杰*
(1.陕西中医药大学附属医院 产科,陕西 咸阳 712000;2.陕西中医药大学 第一临床医学院,陕西 咸阳 712046)
子痫前期(pre-eclampsia,PE)是孕产妇和新生儿发病和死亡的主要原因。其确切病因尚不清楚,但一般认为与血管生成失衡、炎性反应、氧化应激和内皮功能障碍有关[1]。PE与成人心血管疾病(adult cardiovascular disease,CVD)具有多种相同的病理生理途径,如炎性反应、内皮功能障碍以及糖尿病、高血压等[2]。可溶性fms样酪氨酸激酶1(soluble fms-like tyrosine kinase-1,sFlt-1)在小鼠中过度表达会导致高血压,血管反应性异常以及PE表型其他特征的发生[3-5],可用于诱导小鼠PE模型。他汀类药物具有降脂、抗氧化、抗感染等多种作用,在临床中应用广泛。由于CVD和PE之间的相似性、他汀类药物在PE预防中的生物可行性以及动物实验数据,使用他汀类药物预防PE渐渐成为一些研究人员关注的焦点[6]。在进行哺乳的PE母鼠中使用普伐他汀则可以恢复其血管生成平衡和血管轮廓,抑制高血压、肾脏损伤以及与PE有关的生长受限[5-7]。此外,细胞滋养细胞的异常侵袭和过度凋亡与PE的发展有关[7]。本研究的目的在于探究普伐他汀对PE小鼠胎盘组织中抗凋亡路径的影响。
1 材料与方法
1.1 试剂、动物及细胞
编码sFlt-1的复制缺陷型重组腺病毒(北京本元正阳公司进行制备并进行滴度测定);ICR小鼠[西安交通大学(SCXK(陕)2014-003)];sFlt-1 ELISA检测试剂盒(R&D Systems公司);293细胞(ATCC);p-ATF-2、p-p38、p-ERK、p-HSP27、p-STAT3、p-p53及β-actin抗体(Santa Cruz Biotechnology公司)。
1.2 方法
1.2.1 腺病毒载体的扩增及纯化:采用HEK293细胞进行培养和转染。待转染的细胞于正常条件下培养2~3 d,至70%~80%汇合时可以进行转染。将含有1%青霉素/链霉素、2%胎牛血清以及病毒的转染培养基加入到每个平板中,培养20 h后收集细胞,离心去掉上清液,得到的细胞储存在-80 ℃中或直接用于纯化。水浴融化冻存的细胞,然后将2 mL Tris缓冲液(10 mmol/L,pH 8.0)加入其中,反复冻融6次。1 000 r/min离心10 min,得到包含病毒的上清液。将包含病毒的上清液加入CsCl中直到1.43 g/mL,离心后用18号针头和5 mL注射器收集腺病毒条带,再注入到CsCl 为1.34 g/mL的离心管中,4 ℃、35 000 r/min离心16 h。收集富集有腺病毒颗粒的条带,装入平衡好的截留分子质量为3.5 ku的透析袋中进行透析,经溶液(10 mmol/L Tris,1 mmol/L EDTA,0.1% SDS)稀释后用分光光度计测算其浓度。
1.2.2 动物的分组及处理:将正常妊娠第9天的ICR小鼠随机分为:对照组(Con),不经任何干预;PE模型组(PE),尾静脉注射携带sFlt-1的病毒以诱导小鼠子痫前期(109PFUs/100 μL);治疗组(PE+Pravastatin),按体质量喂灌普伐他汀[Pravastatin,5 mg/(kg·d)],直至母鼠停止哺乳。第19天收集母鼠心脏血、胎盘,-80 ℃保存备用。
1.2.3 酶联免疫吸附试验(ELISA)检测:室温凝固收集的血样,于4 ℃放置过夜,3 000×g离心10 min,取上清。按照ELISA试剂盒说明检测各组小鼠血清sFlt-1,450 nm波长下测量吸光度值(A)并计算sFlt-1水平。
1.2.4 免疫印迹分析(Western blot)检测:在冰冷环境下粉碎冻干的胎盘,然后在裂解缓冲液中匀浆;4 ℃下12 000 r/min离心10 min,收集上清液;采用Bradford法(Bio-Rad)测定蛋白质浓度后进行SDS-PAGE,分离蛋白质。将分离的蛋白质转移到硝酸纤维素膜上,然后用3% (w/v)的脱脂奶粉在含0.1%吐温20的PBS (10 mmol/L Tris,140 mmol/L NaCl,0.1% Tween 20,pH=7.4)中室温封闭1 h。之后加入一抗,4 ℃孵育过夜;再用二抗室温孵育1 h。检测激活转录因子-2(activating transcription factor-2,ATF-2)、细胞外调节蛋白激酶(extra-cellular regulated protein kinases,ERK)1/2、热休克蛋白(heat shock protein,HSP)27、p38 MAPK、信号传导及转录激活蛋白(signal transducer and activator of transcription,STAT)3和p53。以β-actin作为内参,用化学发光(ECL)检测系统进行分析。
1.3 统计学分析

2 结果
2.1 母鼠基本情况
妊娠18 d后,对照组、PE模型组以及治疗组的母鼠体质量、产仔数及胎盘质量差异无统计学意义(表1)。
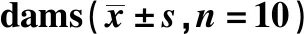
表1 母鼠基本情况Table 1 Basic information of
2.2 血清sFlt-1水平
PE模型组小鼠血清sFlt-1水平显著高于对照组(P<0.05);而经普伐他汀治疗后,显著下调(P<0.05)(图1)。
2.3 胎盘组织ATF-2、p38、ERK蛋白磷酸化水平
PE模型组小鼠胎盘组织ATF-2、p38以及ERK蛋白的磷酸化水平均显著低于对照组(P<0.05)。而经普伐他汀治疗后,显著上调(P<0.05)(图2,表2)。
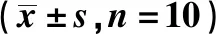
表2 小鼠胎盘组织p-ATF-2,p-p38和p-ERK相对表达量Table 2 Relative expression of p-ATF-2,p-p38 and p-ERK in placenta of different mice groups

图2 小鼠胎盘组织ATF-2、p38、ERK蛋白磷酸化水平Fig 2 phosphorylation of ATF-2,p38 and ERK proteins in placenta of different mice groups
2.4 胎盘组织HSP27、STAT3蛋白磷酸化水平
PE模型组小鼠胎盘组织HSP27和STAT3蛋白的磷酸化水平显著低于对照组(P<0.05)。而经普伐他汀治疗后,显著上调(P<0.05)(图3,表3)。

表3 小鼠胎盘组织p-HSP27和p-STAT3的相对表达量Table 3 Relative expression of p-HSP27 and p-STAT3 in placenta of different mice
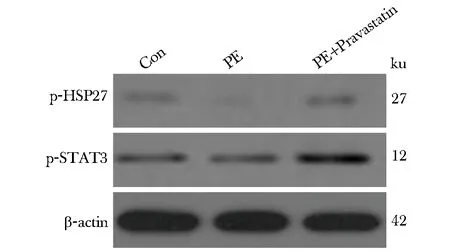
图3 小鼠胎盘组织HSP27、STAT3蛋白磷酸化水平Fig 3 Phosphorylation of HSP27 and STAT3 proteins in placenta of mice
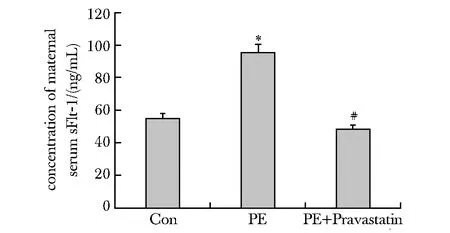
*P<0.05 compared with control;#P<0.05 compared with PE图1 各组小鼠血清sFlt-1浓度Fig 1 serum concentration of sFlt-1 of different
2.5 胎盘组织p53蛋白磷酸化水平
对照组、PE模型组和治疗组小鼠胎盘组织p-p53蛋白的磷酸化水平无差异(图4)。
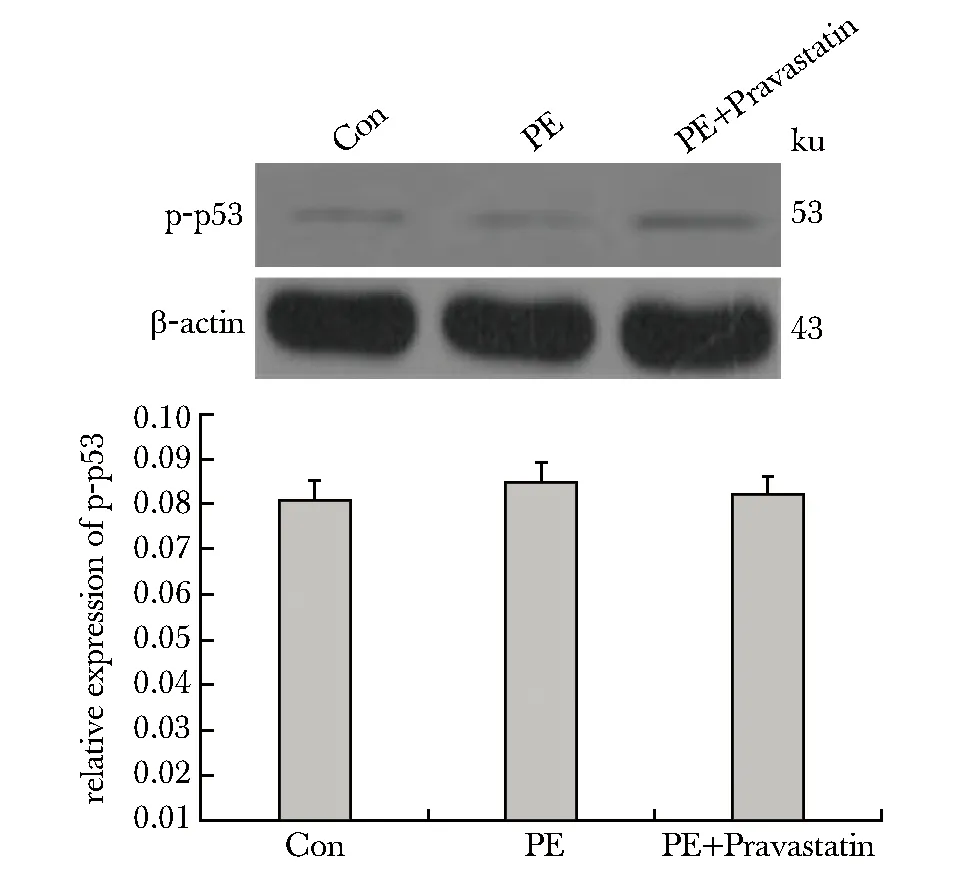
图4 各组小鼠胎盘组织p53蛋白磷酸化水平Fig 4 phosphorylation of p53 in placenta of different
3 讨论
PE是最常见的高血压并发症,同时也是导致孕产妇和胎儿并发症和死亡的主要原因之一。sFlt-1升高是导致母体出现PE症状的最主要原因之一。血清sflt-1水平越高,利用的VEGF水平越低,内皮功能障碍越严重[8]。子痫前期孕妇血浆sFlt-1浓度高于正常孕妇,严重子痫前期孕妇高于轻度子痫前期孕妇[9]。过度表达sFlt-1蛋白的大鼠具有高BP,蛋白尿和内皮损伤,表现出明显的PE症状[5]。基于此,本研究通过转染携带sFlt-1片段的腺病毒成功构建了PE小鼠模型。
p38MAPK信号通路是调节细胞凋亡的重要网络,同时能够促进细胞存活。然而,关于该通路在PE发病机制中的作用尚未明确。普伐他汀因亲水性强、抑制HMG-Co A活性的能力最低,难以通过胎盘屏障,易于清除等特点成为最受关注的他汀类药物。普伐他汀通过激活内皮细胞中的ERK1/2、Akt和MAPK途径诱导血管生成,调节sFlt-1和sEng水平来调节血管生成平衡[10-11]。ERK/MAPK信号通路对胎盘的正常生长、发育和形态发生至关重要。当ERK1信号传导受到抑制时,滋养层细胞的氧化损伤加重,暗示了ERK1/2通路在细胞抵抗氧化损伤促进存活中的作用[12]。
在本研究中,sFlt-1过表达导致小鼠表现出PE表型,各胎盘组织中的抗凋亡因子(ATF-2、p38、ERK、HSP27和STAT3)磷酸化水平均显著降低。ATF-2、p38和ERK是典型的促生长/抗凋亡因子,在促进细胞增殖中起到关键作用。HSP27和STAT3蛋白已被证明与胚胎发育过程中的氧化应激和细胞凋亡有关,是重要的促生存标志物和转录因子[13-14]。这些因子磷酸化水平的降低,提示了sFlt-1引发 PE可能与抑制MAPK信号通路的激活,进而抑制内皮细胞生存,促进细胞过度凋亡有关。经过普伐他汀治疗后,ATF-2、p38、ERK、HSP27和STAT3的磷酸化水平均得到显著上调,提示普伐他汀可能通过促进MAPK信号通路的激活,进而促进内皮细胞生存,抑制凋亡来发挥对胎盘的保护作用。此外,p53蛋白是细胞增殖周期的负调节因子,能够促进细胞凋亡。在本研究中未观察到p53磷酸化水平的变化,提示p53可能并未直接参与MAPK信号促生存的过程。
本研究的结果显示普伐他汀能够上调PE小鼠MAPK信号通路中抗凋亡因子的磷酸化水平,提示了普伐他汀对PE的治疗作用与激活MAPK通路的抗凋亡路径有关。
