花姜酮通过上调FBXW7表达抑制人非小细胞肺癌细胞系A549增殖、迁移和侵袭
2021-08-16万雪琼叶星明
万雪琼,陈 佳,何 超,叶星明
(湖南省胸科医院1.综合科;2.内五科;3.胸外科;4.内二科,湖南 长沙 410006)
肺癌是全球最常见的多发恶性肿瘤,其发病率和病死率均居恶性肿瘤首位,以非小细胞肺癌(non-small cell lung cancer,NSCLC)为主[1]。尽管靶向药物的开发和治疗措施不断完善,但肿瘤转移、复发和耐药等原因,NSCLC患者总体5年生存率仍较低[2]。与传统抗肿瘤药物相比,中药具有高效、低毒、不良反应轻微等特点,是近年来国内外抗肿瘤研究的热点[3]。花姜酮是从球姜中提取单环倍半萜类化合物,除具有抗氧化、抗菌、抗感染、解热和免疫调节等多种药理特性外,其通过调控不同途径对多种肿瘤细胞的增殖、存活、侵袭转移以及血管生成具有显著抑制作用[4]。然而,花姜酮在NSCLC中的抗肿瘤作用并未完全阐明。本研究通过观察花姜酮对人NSCLC细胞系A549增殖、迁移和侵袭的影响,探讨其可能的分子机制,以期为花姜酮用于NSCLC防治提供理论依据。
1 材料与方法
1.1 材料
人A549细胞系(中国科学院上海细胞研究所);胎牛血清、青链霉素双抗(上海江林生物科技有限公司);花姜酮(纯度≥99%)(上海源叶生物);F-BOX家族F框/WD-40域蛋白7(F-box with 7 tandem WD40,FBXW7)过表达质粒(pcDNA-FBXW7)、质粒空载体(pcDNA)、FBXW7小干扰RNA(si-FBXW7)和小干扰RNA无序阴性对照(si-NC)(上海生工生物工程有限公司);Trizol试剂、MTT试剂盒(上海晶抗生物工程有限公司);基质胶(Matrigel)、Transwell小室(BD公司);一步法cDNA合成试剂盒、SYBR Green Master Mix(北京天根生化科技公司);FBXW7兔单克隆抗体、细胞周期素D1(cyclinD1)兔单克隆抗体、P21兔单克隆抗体、基质金属蛋白酶-2(matrix metalloproteinase 2,MMP-2)兔单克隆抗体、MMP-9兔单克隆抗体、磷酸甘油醛脱氢酶(glyceraldehyde phosphate dehydrogenase,GAPDH)兔单克隆抗体和羊抗兔IgG(上海艾博抗生物公司)。
1.2 方法
1.2.1 细胞的培养和分组:复苏细胞后,将A549细胞接种于含10%胎牛血清、1%青链霉素双抗的DMEM培养基中培养。收集对数期细胞进行实验。用花姜酮(花姜酮用10%的DMSO溶解,再用细胞培养液制成100 μmol/L母液,实验时配制所需浓度,DMSO体积分数小于0.1%)终浓度分为5、10和20 μmol/L的细胞培养液孵育细胞48 h,依次记为花姜酮-低、中和高剂量组。同时设置对照组,给与0.1%的DMSO。利用脂质体转染法将pcDNA、pcDNA-FBXW7分别转染A549细胞,依次记为pcDNA组、pcDNA-FBXW7组。利用脂质体转染法将si-NC、si-FBXW7分别转染A549细胞,转染成功后用花姜酮终浓度为20 μmol/L的细胞培养液孵育细胞48 h,依次记为花姜酮+si-NC组、花姜酮+si-FBXW7组。
1.2.2 MTT法检测细胞增殖:将未转染A549细胞接种96孔板,贴壁后用含5、10、20 μmol/L花姜酮的细胞培养液(每孔100 μL)培养箱孵育48 h[5],设置3个复孔;将转染si-NC或转染si-FBXW7的A549细胞接种96孔板,贴壁后用含20 μmol/L花姜酮的细胞培养液(每孔100 μL)培养箱孵育48 h,设置3个复孔;将转染pcDNA或pcDNA-FBXW7的A549细胞接种96孔板,设置3个复孔,培养24 h。每孔加MTT溶液20 μL,继续孵育4 h,终止培养,小心吸弃孔内培养上清液。每孔加DMSO 150 μL,振荡10 min,使结晶物充分融解。选择490 nm波长,在酶联免疫监测仪上测定各孔吸光度(Absorbance,A)值。增殖抑制率=(1-A实验组/A对照组)×100%
1.2.3 Transwell小室法检测细胞迁移和侵袭:用细胞培养液将Matrigel按1∶8稀释,包被Transwell小室底部膜的上室面,室温放置30 min使Matrigel聚合成凝胶,使用前进行基底膜水化。消化各组细胞,用无血清细胞培养基调整细胞至5×105/mL。取细胞悬液200 μL加入Transwell小室,24孔板下室加入600 μL含20%血清的培养基。常规培养24 h,取出Transwell小室,弃去孔中培养液,用棉签轻轻擦掉上层未迁移细胞,磷酸盐缓冲液冲洗2次,甲醇固定30 min,将小室适当风干,用0.1%结晶紫染色20 min,磷酸盐缓冲液冲洗2次,显微镜下随即5个视野观察细胞,计数,以其均值表示细胞侵袭数量。迁移实验时采用未包被基质胶的Transwell小室,其他步骤参考侵袭实验。
1.2.4 实时荧光定量PCR(RT-qPCR)检测FBXW7 mRNA相对表达量:使用Trizol试剂提取各组细胞的总RNA,然后测定每个RNA样品浓度。利用一步法cDNA合成试剂盒进行反转录反应,利用SYBR Green Master Mix、特异性引物进行RT-qPCR反应,以GAPDH为内参照,2-ΔΔCt法分析FBXW7 mRNA相对表达量。FBXW7上游5′-CGTGGAATCAAACGAG ATCATCA-3′,下游5′-GCTTGTCCCAGTGGTGGATG T-3′;GAPDH上游5′-ATCCACGGGAGAGCGACAT-3′,下游5′-CAGCTGCTTGTAAAGTGGAC-3′。
1.2.5 蛋白质印迹(Western blot)检测FBXW7、cyclinD1、P21、MMP-2和MMP-9蛋白相对表达量:使用细胞裂解液对各组细胞进行裂解,然后测定每个蛋白样品的蛋白浓度。在蛋白样品中加入适量上样缓冲液,沸水浴加热3~5 min充分变性蛋白。冷却后,将蛋白样品直接上样到SDS-PAGE胶加样孔内,100 V恒压电泳90 min,利用标准湿式转膜装置300 mA转膜30 min。转膜完毕后,立即将膜置于TBST洗膜液中漂洗2 min,随后将膜置于含5%脱脂牛奶的封闭液中室温封闭1 h。用稀释的一抗溶液孵育膜1 h。用TBST洗膜液侧摆摇床洗膜10 min,共洗涤3次。用稀释的二抗溶液室温孵育膜1 h。用TBST洗膜液侧摆摇床洗膜10 min,共洗涤3次。将膜置于ECL发光液中显影、定影。凝胶成像系统对各条带吸光度值进行分析,目的蛋白相对表达量以目的蛋白和内参GAPDH吸光度值比值表示。
1.3 统计学分析
2 结果
2.1 各组A549细胞的增殖
与对照组比较,花姜酮低、中和高剂量组A549细胞增殖抑制率(IC50为11.83 μmol/L)、显著升高(P<0.05);与pcDNA组比较,pcDNA-FBXW7组A549细胞增殖抑制率显著升高(P<0.05);与花姜酮-高剂量+si-NC组比较,花姜酮-高剂量+si-FBXW7组A549细胞增殖抑制率显著降低(P<0.05)(表1)。

表1 各组A549细胞的增殖Table 1 Proliferation of A549 cells in each group
2.2 各组A549细胞的迁移和侵袭
与对照组比较,花姜酮低、中和高剂量组A549细胞迁移和侵袭数显著减少(P<0.05);与pcDNA组比较,pcDNA-FBXW7组A549细胞迁移和侵袭数显著减少(P<0.05);与花姜酮-高剂量+si-NC组比较,花姜酮-高剂量+si-FBXW7组A549细胞迁移和侵袭细胞数显著增加(P<0.05)(表2,图1)。

图1 各组A549细胞的迁移和侵袭Fig 1 Migration and invasion of A549 cells in each group
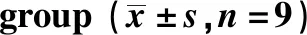
表2 各组A549细胞的迁移和侵袭Table 2 Migration and invasion of A549 cells in each
2.3 各组A549细胞FBXW7 mRNA相对表达量
与对照组比较,花姜酮低、中和高剂量组A549细胞FBXW7 mRNA表达量显著增加(P<0.05);与pcDNA组比较,pcDNA-FBXW7组A549细胞FBXW7 mRNA表达量显著增加(P<0.05);与花姜酮-高剂量+si-NC组比较,花姜酮-高剂量+si-FBXW7组A549细胞FBXW7 mRNA表达量显著减少(P<0.05)(表3)。

表3 各组A549细胞FBXW7 mRNA相对表达量Table 3 Relative expression levels of FBXW7 mRNA in A549 cells in each
2.4 各组细胞FBXW7、CyclinD1、P21、MMP-2和MMP-9蛋白相对表达量
与对照组比较,花姜酮低、中和高剂量组A549细胞FBXW7、p21蛋白表达显著升高,cyclinD1、MMP-2和MMP-9蛋白表达显著降低(P<0.05);与pcDNA组比较,pcDNA-FBXW7组A549细胞p21蛋白表达显著升高,cyclinD1、MMP-2和MMP-9蛋白表达显著降低(P<0.05);与花姜酮-高剂量+si-NC组比较,花姜酮-高剂量+si-FBXW7组A549细胞p21蛋白表达显著降低,cyclinD1、MMP-2和MMP-9蛋白表达显著升高(P<0.05)(图2,表4)。

表4 各组细胞FBXW7、cyclinD1、p21、MMP-2和MMP-9蛋白相对表达量Table 4 Relative expression levels of FBXW7,cyclinD1,P21,MMP-2 and MMP-9 proteins in each

图2 各组细胞FBXW7、cyclinD1、p21、MMP-2和MMP-9蛋白相对表达量Fig 2 Relative expression levels of FBXW7,cyclinD1,p21,MMP-2 and MMP-9 proteins in each group
3 讨论
姜是一种广泛使用的药食两用植物,具有解表散寒、温中止呕等功效。花姜酮是从姜中提取的主要活性成分,其通过调控肿瘤细胞增殖、凋亡、迁移侵袭、放化疗耐药显示出显著的抗肿瘤作用,是肿瘤治疗的潜在候选药物。花姜酮可能通过上调P53、下调B细胞淋巴瘤2(B cell lymphoma 2,Bcl-2)基因表达抑制食管癌细胞增殖、诱导细胞凋亡[6]。花姜酮通过激活丝裂原活化蛋白激酶(mitogen activated protein kinase,MAPK)信号通路抑制肝癌HepG2细胞的增殖和转移潜能[7]。此外,花姜酮还可调节放射治疗后肿瘤细胞DNA的修复反应,提高前列腺癌的辐射敏感性[8]。本研究探讨花姜酮在NSCLC中作用发现,花姜酮呈剂量依赖效应抑制A549细胞增殖、迁移和侵袭。与本研究类似,花姜酮可抑制骨桥蛋白诱导的A549细胞侵袭[9]。CyclinD1和P21是经典的增殖相关基因,cyclinD1表达增加可促进细胞周期向S期推进发挥促增殖作用,P21则通过阻止细胞周期依赖蛋白激酶和cyclinD1形成复合物发挥抗增殖作用[10]。MMP-2和MMP-9是经典的转移相关基因,其通过降解细胞外基质在肿瘤侵袭转移中发挥促进作用[11]。本研究发现花姜酮以剂量依赖方式降低cyclinD1、MMP-2和MMP-9表达水平,提高P21表达水平,与功能分析相一致,这进一步说明花姜酮对NSCLC细胞增殖、迁移和侵袭的抑制作用。
FBXW7蛋白是泛素连接酶的重要组成成分之一,其通过泛素-蛋白酶体系统降解促癌蛋白(c-Myc、cyclin E和c-JUN)参与调节肿瘤细胞增殖,是一种有效的肿瘤抑制因子。研究显示,NSCLC组织中FBXW7表达降低,FBXW7低表达与晚期临床病理分期、5年生存率较差有关[12]。过表达FBXW7通过诱导细胞周期阻滞、增加化学敏感性和抑制上皮-间质转化进程来抑制NSCLC的进展[13]。本研究显示,花姜酮处理后A549细胞中FBXW7呈剂量依赖性增加,提示花姜酮可能通过调控FBXW7表达在NSCLC中发挥抗肿瘤作用。过表达FBXW7后A549细胞的增殖、迁移和侵袭能力显著降低,cyclinD1、MMP-2和MMP-9蛋白表达降低,P21表达增加,与报道相一致[14]。进一步恢复实验显示,干扰FBXW7表达还可逆转花姜酮对A549细胞的增殖、迁移和侵袭抑制作用,进一步说明花姜酮通过上调FBXW7表达抑制A549细胞的增殖、迁移和侵袭。
综上所述,本研究证实花姜酮能够抑制NSCLC细胞的增殖、迁移和侵袭,其机制与上调FBXW7表达有关,这为花姜酮用于防治NSCLC奠定了理论依据。
