高分辨MRI评估单发未破裂颅内动脉瘤稳定性
2021-08-12钱丽霞闫俊荣史云峰
李 瑞,钱丽霞,闫俊荣,史云峰
[山西白求恩医院(山西医学科学院)放射科,山西 太原 030032]
颅内动脉瘤(intracranial aneurysm, IA)为非创伤性蛛网膜下腔出血最常见病因,一旦破裂则预后不良,严重时可危及生命;早期发现未破裂动脉瘤、判断其稳定性并给予相应处理可改善预后。既往研究[1]报道,动脉瘤患者出现神经症状(如突发头痛或上睑下垂等症状)提示动脉瘤不稳定,偶然发现的无症状动脉瘤则通常为稳定动脉瘤。高分辨率MRI(high-resolution MRI,HR-MRI)为非侵入性检查[2],可作为筛查和随访IA的工具。HR-MRI所示动脉瘤壁强化(aneurysm wall enhancement, AWE)提示瘤壁存在炎性反应,可用于鉴别稳定与不稳定IA[3]。本研究观察HR-MRI评估未破裂IA稳定性的价值。
1 资料与方法
1.1 一般资料 回顾性分析2017年9月—2020年6月于山西白求恩医院(山西医学科学院)就诊的63例未破裂IA患者,男35例,女28例,年龄36~71岁,平均(56.8±11.9)岁。纳入标准:经DSA或CT动脉造影(CT angiography, CTA)明确诊断为单发未破裂IA;接受三维时间飞跃法(three-dimensional time of flight, 3D-TOF)及平扫和增强HR-MR检查。排除标准:多发IA;经CT或腰椎穿刺确诊动脉瘤破裂、存在蛛网膜下腔出血;近期服用阿司匹林或非甾体类抗炎药物;梭状、创伤性动脉瘤或动静脉畸形;图像质量差。
参照文献[1]方法将患者分为稳定组(32例)及不稳定组(31例,图1)。稳定组:偶然发现IA,无症状;不稳定组:警示性头痛(入院前2周内突发性头痛);入院前1个月内患侧头痛伴眼睑下垂,瞳孔对光反射消失和/或眼外肌麻痹。
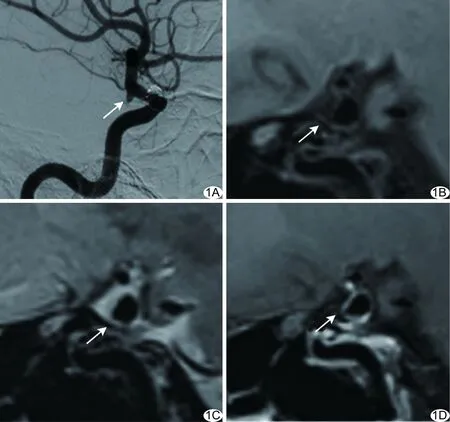
图1 患者女,36岁,不稳定IA(头痛、头晕伴恶心、呕吐10 h) A.DSA图示右侧颈内动脉交通段IA(箭); B.T1WI示瘤体形态不规则,呈等-略低信号(箭); C.T2WI示瘤体不规则,呈稍高信号(箭); D.增强T1WI示动脉瘤壁明显强化(箭)
1.2 仪器与方法 采用Siemens skyro 3.0T MR仪,32通道头部线圈。先以TOF序列扫描定位IA,HR-MR扫描序列包括3D space T1W、T2W。参数:T1W,TR 900 ms,TE 21.0 ms,扫描时间6 min 46 s;T2W,TR 1 300 ms,TE 122 ms,扫描时间7 min 40 s; FOV 230 mm×230 mm,矩阵384×224,层厚0.60 mm,层间距0 m。经静脉注射钆喷酸葡胺注射液0.1 mmol/kg体质量5 min后行脂肪抑制T1增强扫描。
1.3 图像分析 由影像科主治医师和副主任医师各1名以盲法分析HR-MRI,寻找测量动脉瘤形态学指标的最佳视角。形态学指标包括位置(前循环、后循环)、大小(瘤体深度、瘤颈宽度、瘤体宽度)、是否为分叉动脉瘤及形状(规则或不规则)。分叉动脉瘤指动脉瘤起源于颅内颈内动脉系统和椎基底动脉系统动脉主干的主要分叉;形态不规则指动脉瘤具有分叶或子囊[4]。参照文献[5]标准判断AWE形式,即无强化、部分强化或全部强化。
手动将影像存储和传输系统(picture archiving and communication systems, PACS)图像所示动脉瘤放大3倍,分别在动脉瘤颈部、体部和穹顶部放置ROI,测量增强前后信号强度,每个区域测量3次,取平均值。计算强化指数,强化指数=(增强后信号强度—增强前信号强度)/增强前信号强度[6]。
1.4 统计学分析 采用SPSS 22.0统计分析软件。以χ2检验比较组间计数资料。以±s表示符合正态分布的计量资料,组间比较采用独立样本t检验;不符合正态分布者以中位数(上下四分位数)表示,行Mann-WhitneyU检验。绘制受试者工作特征(receiver operating characteristic, ROC)曲线,计算曲线下面积(area under curve, AUC),评估相关参数鉴别稳定与不稳定IA的诊断效能。P<0.05为差异有统计学意义。
2 结果
稳定组与不稳定组间患者年龄、性别、既往史差异均无统计学意义(P均>0.05),见表1;组间IA形态、是否为分叉动脉瘤及强化指数差异均有统计学意义(P均<0.01),而位置、瘤颈宽度、瘤体深度和宽度以及强化形式差异均无统计学意义(P均>0.05),见表2。

表1 稳定组与不稳定组IA患者相关资料比较

表2 稳定组与不稳定组IA形态学参数比较
将组间差异具有统计学意义的参数纳入ROC曲线分析,结果显示强化指数鉴别稳定与不稳定IA的AUC为0.82[95%CI(0.71,0.93)],敏感度81.7%,特异度71.9%;形态不规则的AUC为0.73[95%CI(0.60,0.86)],敏感度77.4%,特异度68.7%;分叉动脉瘤的AUC为0.70[95%CI(0.57,0.83)],敏感度71.0%,特异度68.7%。见图2。

图2 根据HR-MRI所示动脉瘤形态、是否为分叉动脉瘤及强化指数鉴别稳定与不稳定IA的ROC曲线
3 讨论
HR-MRI所示AWE被认为与瘤壁炎性反应和损伤有关[7],炎症反应使巨噬细胞、肥大细胞等炎性细胞处于应激状态,致血管内皮细胞及平滑肌细胞受损,平滑肌细胞为管壁中层主要细胞成分,其破坏会引起管壁内弹力层破坏,管壁重塑,进一步加剧管壁损伤而增加破裂风险;同时炎症可促进管壁新生微血管生成及通透性增加,导致AWE;AWE与炎症呈正相关,炎症与破裂风险呈正相关,故IA强化越明显,提示其越不稳定。EDJLALI等[1]认为不稳定IA包括IA破裂、症状明确的未破裂IA或随访过程中发生形态学改变的IA,该研究于9个有症状未破裂IA中的6个观察到AWE,但入组病例存在部分破裂动脉瘤。WANG等[8]观察80例患者89个IA,发现症状性IA强化程度更高,但该组部分患者存在多发动脉瘤。本研究纳入对象均为单发未破裂IA,以排除破裂动脉瘤病理结构变化及多发动脉瘤等因素的影响。
既往多采用定性方法评估AWE与IA稳定性的关系。LIU等[9]根据AWE程度将其分为无强化、轻度强化和明显强化,明显强化时破裂风险增加,但难以严格界定强化程度;且有研究[3]认为无症状动脉瘤亦可部分或全部强化,故根据IA是否强化评估其稳定性可能存在一定假阳性率。OMODAKA等[10]采用定量方法进行评价,发现破裂动脉瘤的壁强化指数明显高于未破裂者。量化评价AWE程度对预测IA稳定性有一定价值[11]。本研究分别测量增强前后动脉瘤壁信号强度,并计算强化指数,结果显示以强化指数预测动脉瘤稳定性的AUC为0.82,敏感度81.7%,特异度71.9%,验证强化程度对评估动脉瘤稳定性具有较好价值。
颅内囊状未破裂动脉瘤发病率较高,但破裂风险相对较低,破裂率为3%~4%。既往研究[12]显示,对未破裂IA治疗决策主要取决于其大小和位置,前循环中小动脉瘤(最大径<7 mm)破裂风险较低,但临床实践中亦可见最大径<7 mm动脉瘤导致蛛网膜下腔出血,与之相反,亦有老年患者罹患巨大动脉瘤经多年随访而未见破裂[13]。FU等[14]观察37例患者45个未破裂IA,发现IA大小与其稳定性无明显相关。本研究中稳定与不稳定IA瘤体大小差异无统计学意义,提示动脉瘤大小对评估其稳定性意义不大;分叉动脉瘤稳定性较低,原因可能在于分叉动脉瘤更易受血流动力学影响而致其不稳定风险增加;存在分叶或子囊(形态不规则)意味着动脉瘤不稳定性增加,与既往研究[15]相符,提示动脉瘤形态改变导致其血流分布变化而增加破裂风险。
综上,HR-MRI可用于评估未破裂IA的稳定性,增强前后瘤壁强化指数的评估效能较高。但本研究样本量小,且受HR-MRI分辨率所限,无法精确测量增强前后血管壁厚度,有待进一步完善。
