CT鉴别诊断胃神经内分泌癌与胃腺癌
2021-08-12高剑波王霄英
高 歌,梁 盼,王 睿,高剑波,王霄英*
(1.北京大学第一医院医学影像科,北京 100034;2.郑州大学第一附属医院放射科,河南 郑州 450052)
胃是神经内分泌肿瘤的好发部位之一[1]。胃神经内分泌癌(gastric neuroendocrine carcinoma, GNEC)发病率近年呈上升趋势[2],其侵袭性高,易早期发生淋巴结和肝转移,预后差[3]。因其临床特点及影像征象与胃腺癌(gastric adenocarcinoma, GC)存在较多重叠,术前易误诊。本研究观察CT鉴别诊断GNEC与GC的效能。
1 资料与方法
1.1 一般资料 回顾性分析2011年8月—2020年12月于郑州大学第一附属医院经病理确诊的62例GNEC(GNEC组)和70例GC(GC组)患者。纳入标准:①临床资料完整;②于手术或活检前7天内接受腹部增强CT检查;③检查前无化学及放射治疗史。排除标准:①罹患其他肿瘤;②图像质量欠佳。
1.2 仪器与方法 嘱患者禁食4~6 h,检查前口服约1 000 ml温开水后仰卧于检查床。采用GE Discovery 750 HD CT扫描仪行腹部扫描,管电压120 kVp,自动管电流290~650 mms,球管旋转时间0.6 s;或Sienmens Somatom Definition Flash型双源CT仪,管电压120 kV,参考管电流250 mAs,球管旋转时间0.33 s。以流率3.0~3.5 ml/s经肘静脉团注碘佛醇(320 mgI/ml)1.5 ml/kg体质量,于注射后30 s、70 s行动脉期、静脉期扫描。采用标准算法重建薄层图像,层厚、层间距均为1.25 mm。
1.3 图像后处理 将数据传送至ADW4.7工作站,观察肿瘤位置(胃上区、胃中区、胃下区、2个以上区域)、大小(厚径和长径)、形态(隆起型或溃疡型)、边界(清晰或不清晰)、囊变/坏死(有或无)、淋巴结转移(有或无)及肝转移(有或无)。肿瘤厚径指肿瘤黏膜面至浸润最深处的最大垂直距离,长径为轴位图像中沿胃壁最大径所见肿瘤长度;淋巴结短径超过1.0 cm时判定为转移。于肿瘤最大横断面及2个邻近层面,避开囊变、坏死区勾画ROI,保持各期扫描图像中ROI位置、大小及形状一致,以上述3个层面的平均CT值作为测量结果,记录平扫CT值(CTNON)、动脉期CT值(CTAP)和静脉期CT值(CTPP),计算动、静脉期强化率[CTAP/(CTPP-CTNON)/CTNON]及静脉-动脉期强化率比[(CTPP-CTNON)/(CTAP-CTNON)]。
1.4 统计学分析 采用SPSS 21.0统计分析软件。以±s表示符合正态分布的计量资料,组间行t检验;以中位数(上下四分位数)表示不符合者,以Wilcoxon符号秩检验进行比较。采用χ2检验比较组间计数资料。将差异有统计学意义的CT特征纳入Logistic回归分析,筛选鉴别GNEC与GC的独立预测因素。绘制受试者工作特征(receiver operating characteristic, ROC)曲线,计算曲线下面积(area under curve, AUC),评估诊断效能。P<0.05为差异有统计学意义。
2 结果
2.1 临床资料和CT特征 组间肿瘤边界、囊变/坏死及肝转移和肿瘤厚径及静脉-动脉期强化率差异均有统计学意义(P均<0.05),见表1、2及图1、2。

图1 患者男,63岁,胃上区贲门部腺癌 A.平扫CT图示贲门部隆起型肿块,边界清晰; B.增强动脉期CT图示肿块均匀强化; C.增强静脉期CT图示肿块渐进性强化 (箭示肿块) 图2 患者男,58岁,胃上区贲门部神经内分泌癌 A.平扫CT图示胃贲门溃疡型肿块,边界清晰; B.增强动脉期CT图示肿块中度不均匀强化,肝脏多发转移灶强化程度与胃壁肿块相仿; C.静脉期CT图示肿块强化程度稍减低,肝脏转移灶强化程度亦减低 (白箭:胃部病灶;黄箭:肝转移病灶)

表1 GNEC与GC患者临床及CT特征比较
2.2Logistic回归分析及ROC曲线分析 肿瘤边界、厚径、囊变/坏死、肝转移及静脉-动脉期强化率比为鉴别GNEC与GC的独立预测因素(表3)。以病理诊断为金标准,单独以肿瘤边界、厚径、囊变/坏死、肝转移及静脉-动脉期强化率比及联合应用以上参数鉴别GNEC与GC的AUC、敏感度、特异度及准确率见表4及图3。

图3 肿瘤边界、厚径、囊变/坏死、肝转移、静脉-动脉期强化率比单一及联合鉴别GNEC与GC的ROC曲线

表2 GNEC和GC的CT测值比较

表3 各CT参数鉴别GNEC与GC的Logistic回归分析结果
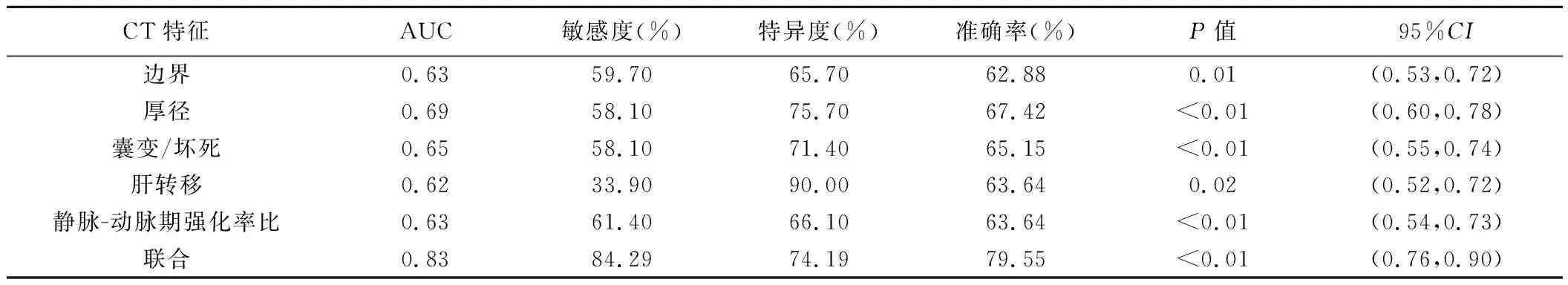
表4 各独立预测因素单独及联合鉴别GNEC与GC的ROC曲线结果
3 讨论
胃神经内分泌肿瘤起源于肠嗜铬细胞,具有分泌生物活性多肽类激素和神经介质功能[4],检出率逐年增长[5-7],以男性多见[6],而女性生存率可能更高[7-8];主要临床表现为消化系统症状及肿瘤压迫、远处转移等相关症状,仅少数功能性神经内分泌肿瘤临床表现特异,如胃泌素瘤可表现为卓-艾综合征[9]。相关标志物免疫组织化学分析结果是诊断GNEC的重要依据,如血清嗜铬粒蛋白A(Chromogranin A, CgA),但易受质子泵抑制剂等药物或心力衰竭、肝硬化等疾病干扰。通过胃镜检查可获得组织标本,但部分GNEC可被误诊为分化较差的GC[10];且部分GNEC因活检钳取样致标本变形而难以与淋巴瘤鉴别。
CT是诊断胃肿瘤性病变的最常用影像学方法之一,可快速、准确评估肿瘤形态学特征及肿瘤与邻近结构的关系和有无远处转移等,辅助临床进行决策。GNEC多见于胃底和贲门部[11],GC则多见于胃窦部,但本组GNEC和GC均好发于胃上区,其中53.23%GNEC位于胃上区,与既往研究[6]结果相近;37.14%的GC位于胃上区,发病率稍高于胃下区(30.00%),与针对本地区的既往研究[12]结果差异不大,可能与胃食管反流病发病率增高、导致胃食管结合部患癌风险增加有关[13]。
本研究中59.68%的GNEC和32.86%的GC边界清晰,差异有统计学意义,提示肿瘤边界是否清晰可作为鉴别二者的影像学指标,与KIM等[14]的观点相符,即病灶表面黏膜覆盖的完整性可作为鉴别点,这可能与肿瘤病理起源有关:GNEC起源于胃壁固有层的肠嗜铬细胞而非表面上皮细胞[15],病灶较小时表面覆盖完整黏膜,病灶增大后,尽管部分上皮剥离,但损伤边缘上皮仍完整,尚可完整覆盖表面黏膜[16];而GC起源于胃壁黏膜层上皮细胞,表面上皮细胞被浸润、破坏,表面粗糙、不光整。
肿瘤大小与生物学行为关系密切,常被视为定性诊断的重要依据。本研究结果显示,GNEC平均厚径大于GC,而其长径无明显差异,提示肿瘤黏膜面至浸润最深处的最大垂直距离、即肿瘤胃壁浸润深度是鉴别二者的重要依据。肿瘤浸润较深,发生囊变/坏死概率越高,本组GNEC更易发生囊变/坏死。
静脉-动脉期强化率比主要反映肿瘤新生血管通透性,肿瘤病灶微血管密度增高,血管通透性亦增高[17]。GNEC静脉-动脉期强化率比低于GC,可能与其病理基础及微血管结构有关。GNEC细胞增殖活性更高、血供更丰富,其强化峰值位于动脉期[16];而GC组织表面血管密集、规则,深部纤维结缔组织较多,主要呈渐进性强化,故强化峰值多位于静脉期[16]。
是否存在淋巴结转移与定性诊断及治疗等密切相关。既往研究[17]认为GNEC比GC更易出现淋巴结转移,本研究GNEC组淋巴结转移率70.97%,略高于GC组(65.71%),但差异无统计学意义,可能与组间样本分布不均衡有关。此外,GNEC较GC更易出现肝转移,且二者肝转移灶注射对比剂后强化方式存在差异,前者以动脉期强化为主,后者则以渐进性强化为主。因此,有无肝转移及肝转移灶强化方式对于鉴别GNEC与GC具有提示意义。
本研究结果显示,尽管肿瘤边界、囊变/坏死、肝转移、厚径和静脉-动脉期强化率比对鉴别诊断GNEC与GC均有提示意义,但单独以之鉴别GNEC与GC的效能有限,AUC均不高于0.7;联合应用上述CT特征,其鉴别GNEC与GC的AUC提高为0.83,且诊断敏感度和特异度均得到提升。
综上所述,CT可为鉴别诊断GNEC与GC提供依据,联合应用肿瘤边界、厚径、囊变/坏死、肝转移及静脉-动脉期强化率比参数可提高鉴别诊断的准确性。但本研究样本量小,且为单中心回顾性分析,存在选择偏倚,有待增大样本量并开展多中心研究进一步观察。
