双参数11C-MET PET/MRI在脑肿瘤样病变的初步应用
2021-08-12富丽萍张晓军李昉晔刘家金张锦明徐白萱田嘉禾
富丽萍,李 灿,张晓军,李昉晔,刘家金,张锦明,徐白萱,田嘉禾★
(1.中日友好医院核医学科,北京 100029;2.中国人民解放军总医院第一医学中心,核医学科,北京 100853;3.中国人民解放军总医院第一医学中心神经外科,北京 100853)
碳11 标记的蛋氨酸(11C-methionine,11C-MET)是目前常用的氨基酸PET 显像剂,METPET 显像能够提供良好的肿瘤/脑实质本底的对比、凸显肿瘤边界、在脑肿瘤的诊断尤其是疗效评估中发挥重要作用[1,2]。但随着成像技术的发展,单一成像方式越来越难以满足临床需求,因此引入了多模式成像的概念[3]。弥散峰度成像(diffusion kurtosis imaging,DKI)通过多方向、多B 值、大B 值等扩展了弥散张量成像(diffusion-tensor imaging,DTI),能够评估基于细胞膜、细胞器以及细胞外间隙的非高斯分布的水分子扩散情况,真正反映组织微结构特征[4],因此DKI 主要参数平均峰度(mean kurtosis,Kmean)被认为是评价组织微结构复杂程度的重要指标。PET/MRI 一体机能够同时进行形态学的、功能的和代谢相关数据的采集,提供互补的影像学信息,在脑肿瘤的诊断及管理中具有一定优势[5~7]。本文旨在探讨多参数11C-MET PET/MRI 检查在脑肿瘤样病变的诊断价值,为找寻多参数分析方法及提高脑肿瘤样病变诊断的效能奠定基础。
1 资料与方法
1.1 临床资料
回顾性分析2013年1月~2016年12月因临床怀疑脑肿瘤来中国人民解放军总医院核医学科行11C-MET PET/MRI 检查的患者共35 例,所有患者具有完整的临床及影像资料,均基于手术病理及治疗后随访做出临床最终诊断。患者均签署知情同意书[8]。
1.2 PET/MRI 采集
患者在安静状态下接受11C-MET(固相法合成,日本住友NM-10 回旋加速期)静脉注射(4.44~5.55MBq/kg),休息20min 后进行PET/MRI(Biograph mMR,德国西门子公司)头部数据采集。(1)PET 采集1 个床位(轴向视野25.8cm),采集时间10min,采用基于超短回波时间(ultrashort echo-time,UTE)序列进行衰减校正,重建参数如下:3D 模式,采用有序子集期望值最大化法进行重建,3 次迭代,21 个子集,半高宽4mm,矩阵:256×256。(2)MRI 扫描与PET 数据采集同时进行,采用如下序列:矢状位T1 加权成像三维磁化强度预备梯度回波序列(T1 weighted imagingthree dimensional magnetization prepared rapid gradient echo,T1-3D-MPRAGE),重复时间(repetition time,TR)=1600ms,回波时间(echo time,TE)=2.15ms,层厚(thickness,THK)=1.0mm,视野(field of vision,FOV)=256mm×256mm,矩阵(Matrix)=256×256;横轴位T2液体衰减反转恢复序列(T2fluid attenuated inversion recovery,T2-FLAIR),TR =8000ms,TE =94ms,THK =5.0mm,FOV =192mm×220mm,翻转角150°;以及横轴位弥散加权成像(diffusion weighted imaging,DWI),TR =7900ms,TE=101ms,THK=5mm,其中采用3 个b值(0、700、2000s/mm2),对于b 值为700 和2000,对应的弥散方向分别为22 和45。
1.3 数据分析
1.3.1 最大标准化摄取值的提取(maximum standardized uptake value,SUVmax)
首先包括结构像(T1-3D-MPRAGE,T2-FLAIR)和MET-PET 图像分别传输至工作站(Syngo.via,Siemens Healthcare,德国)进行融合图像的分析。病灶感兴趣区(volume of interest,VOI)的选择和测量均由2 位医生(分别有12年和5年PET/CT 经验、2年和6年MR 经验)共同完成:等高线VOI 包括高于最大值40%的所有像素用于计算SUVmax,VOI 置于病灶放射性摄取最高层面,获得该病灶SUVmax。复制该VOI 置于健侧镜像位置,作为正常组织参考区,用于后期DKI 参数分析。
1.3.2 DKI 数据分析
采用dipy 工具包计算DKI 数据,获得K 最大值(Kmax)、K 均值(Kmean)和K 最小值(Kmin)。采用2D 直方散点图对SUVmax 及Kmean 进行双参数分析。
1.4 统计学方法
应用SSPS17.0 软件进行统计学分析,Kolmogorov-Smimov 检验用于正态分布的检测。采用秩和检验及独立样本t 检验评价良、恶性病变之间,以及病变与正常组织之间SUVmax、Kmax、Kmean 和Kmin 的差异。
2 结果
2.1 试验受试者情况
所有受试者均顺利完成11C-MET PET/MRI检查,无副反应或严重不良反应。由于图像伪影严重,3 名试验受试者的影像数据不能用于后期分析,最终入组32 例患者(男22 例、女10 例,年龄7~82 岁)的32 个病灶用于统计分析。所有病灶均经病理、脑脊液及治疗后随访证实,其中24 个恶性病灶(胶质瘤20 例、转移瘤4 例),8 个良性病灶(脱髓鞘病变1例、免疫相关脑炎3例、放疗后脑损伤2 例、微血管炎1例以及神经节神经胶质瘤1例)。
2.2 多参数分析结果
2.2.1 SUVmax 的比较
恶性肿瘤性病变SUVmax 显著高于良性病变(Z=-3.04,P<0.01)。在本组良性病变中,放射性摄取最高的病灶见于1例自身免疫性脑炎患者(SUVmax=4.7),放射性摄取最低的是1例神经节神经胶质瘤(WHO I )伴海马硬化的患者(SUVmax=1.2)。本组恶性病灶中,放射性摄取程度最低的肿瘤为1例弥漫星形细胞瘤伴部分胶质母细胞瘤的病灶(SUVmax=1.3),放射性摄取最高的肿瘤为1例胶质母细胞瘤(SUVmax=8.6)。
2.2.2 DKI 多参数的比较
表1 示,恶性病变的Kmean 显著低于良性病变(Z=-2.25,P<0.05),而Kmax 及Kmin 均未见组间显著性差异。此外,在于健侧正常组织参考区的比较中,恶性病变的Kmean 显著低于健侧参考区(t=-5.44,P<0.05),Kmax(t=1.16,P>0.05)及Kmin(t=0.66,P>0.05)均未见组间显著性差异。良性病变的Kmean、Kmax 及Kmin 均与健侧参考区大致相仿,未见组间显著性差异(均P>0.05)。
2.2.3 ROC 曲线的结果
图1 示,SUVmax 在良、恶性病变鉴别中取得最大曲线下面积(area under curve,AUC)为0.85±0.08,P <0.05;Kmean 的AUC 为0.77 ±0.11,P <0.05。根据ROC 曲线获得SUVmax 与Kmean 的最佳阈值分别为4.7 和2.1。
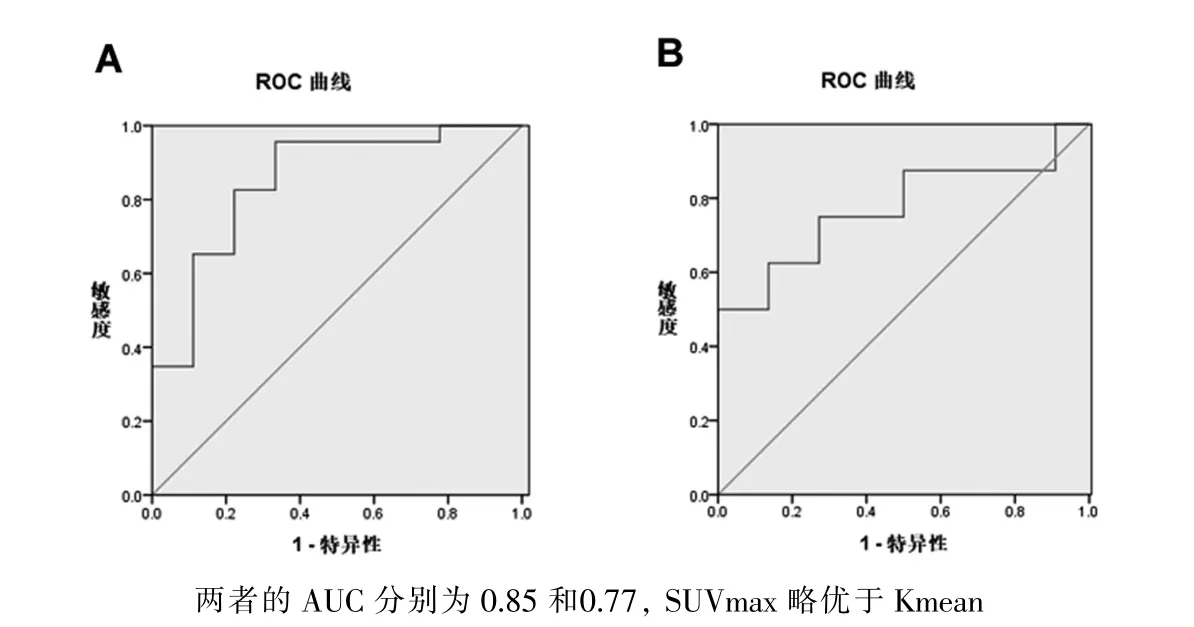
图1 SUVmax(A)与Kmean(B)在良、恶性病变诊断效能的比较
2.2.4 双参数分析
SUVmax 与Kmean 的双参数分析典型病例如图2所示(见封二)。
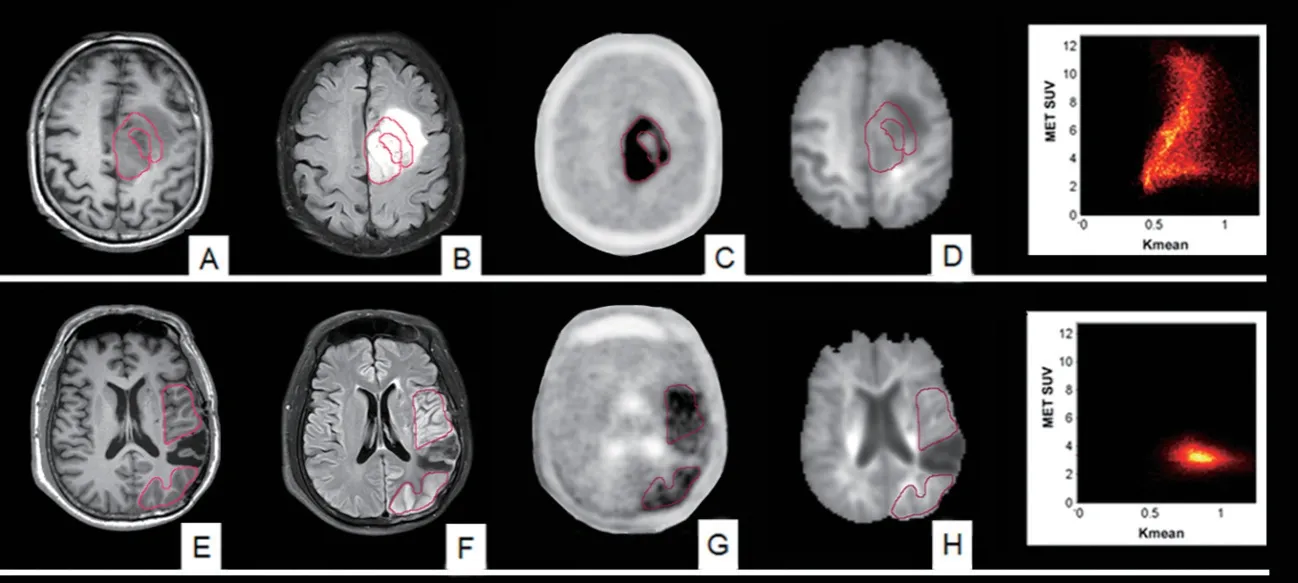
图2 MET-SUVmax与Kmean在恶性与良性病变的双参数分析(红色轮廓为感兴趣区)。上行:左侧额叶胶质母细胞瘤患者(82岁,男性)。T1WI(A)及T2-FLAIR(B)图像显示左侧额叶深部大脑镰旁混杂信号肿块。MET-PET(C)显示病变存在明显异常放射性浓聚(SUVmax:5.6)。Kmean (D)图像显示病灶局部平均弥散峰度较对侧正常组织显著减低。SUVmax-Kmean双参数分析显示恶性病变体素分布呈明显离散趋势,反映了肿瘤异质性强的生物学特征。下行:左侧颞枕叶胶质瘤术后,抽搐,微血管炎患者(48岁,男性)。结构MRI(E, F)图像显示左侧额、颞及枕叶皮层轻度弥漫性肿胀,局部楔形长T1短T2信号为胶质瘤切除术后空腔。MET-PET(G)图像显示相应区域轻度放射性摄取(SUVmax:2.4)。Kmean(H)图像显示病灶局部平均弥散峰度与对侧正常组织大致相仿。SUVmax-Kmean双参数分析显示良性病变体素分布呈集中趋势,反映了病变异质性较弱的生物学特征。
3 讨论
颅内良性及恶性病变均可以占位性病变形式出现,影像表现复杂多样,临床症状常常相互叠加。很多情况下即使结合实验室及MRI 检查,临床医生仍然难以判定病变的性质(特别是存在既往肿瘤病史的情况下),因此MET-多参数分析应用于颅内肿瘤样疾病的诊断和鉴别诊断研究[9]。
3.1 DKI 与脑肿瘤样病变
与传统基于高斯模型的DTI 技术相比,DKI的参数(Kmean)采用了更接近实际的水扩散模型,能较好评估组织结构的空间走向、刻画灰质和白质的特征;另一个优势在于Kmean 可以解决交叉纤维束的问题而部分各项异性只能示踪单方向走行的纤维束。因此基于上述特点DKI 能够更好的反映组织微结构的变化,在中枢神经系统疾病的研究中应用甚广[10,11]。本研究显示良性病变Kmean 值明显高于恶性病变。正常脑白质组织结构完整,包含很多限制水分子弥散的屏障,例如髓鞘和丰富的神经元轴突等。本组恶性病变主要包含高级别胶质瘤和转移瘤,虽然起源不同,但两者均具有细胞排列紧密、形态多样、细胞核异型性明显、肿瘤血管丰富、易出现坏死等病理改变,突显了恶性病变组织微结构复杂和非均质性特点。而本组良性病变主要包含脑炎、炎性脱髓鞘以及放射性脑损伤,虽然病理生理改变不尽相同,但是其基本病理改变主要包括不同程度的神经元肿胀、血管源性水肿及髓鞘崩解消失等。与恶性肿瘤相比,良性病变累及范围内病变严重程度大致相仿(呈现均质性特点),髓鞘崩解后对水分子弥散限制减低。Raab 等在应用DKI 对胶质瘤的研究发现,低级别胶质瘤具有细胞密度低、核浆比小以及肿瘤边界不清的特点,因此低级别胶质瘤中水分子弥散受限程度最低,与正常脑结构差异最大;而高级别胶质瘤Kmean 值显著高于低级别胶质瘤,更加接近正常脑组织[10]。本结果显示良性病变Kmean 值接近正常脑组织并显著高于恶性病变,一方面反映了良病变对脑组织损伤程度低于恶性肿瘤,另一方面显示恶性病变微结构复杂程度明显高于良性病变。
3.2 11C-MET 与脑肿瘤样病变
11C-MET 是常用的氨基酸类正电子显像剂,11C-MET 在脑内的摄取受到细胞膜上左旋氨基酸转运体调节,当肿瘤细胞旺盛增殖蛋白质合成增加时出现11C-MET 摄取的异常增加[12]。虽然文献报道MET-PET 在胶质瘤的诊断和管理中具有突出价值[13],但是也有研究认为MET-PET 在高低级别胶质瘤的鉴别中能力有限[2],而且MET 的异常摄取也可见于良性病变,例如脑缺血,炎症以及良性肿瘤。因此本研究通过对良、恶性病变的比较,评估MET-PET 在颅内占位性病变的诊断价值。本组恶性肿瘤由高级别胶质瘤(13例)、经病理证实的胶质瘤复发(7 例)和随访证实的转移瘤治疗后代谢活性尚存(4 例)组成,结果显示病变SUVmax 在恶性肿瘤显著高于良性病变,与文献报道一致。有趣的是在本组良性病变中,代谢最高的情况见于一位自身免疫性脑炎患者,该患者起病急,进展快,临床以精神行为异常为主要表现。METPET 显示患者右侧额、颞叶及基底节区出现不均匀放射性浓聚,异常摄取的最高点(SUVmax=4.7)出现在右侧壳核。而在恶性病变组,代谢最低的情况见于一个弥漫星形细胞瘤伴部分胶质母细胞瘤的患者,T2-FLAIR 显示异常信号累及右侧颞叶、枕叶、岛叶、右侧背丘脑和胼胝体压部,MET-PET仅在右侧颞叶深部白质内出现局灶性轻度放射性浓聚(SUVmax=1.3)。上述病例提示MET 的放射性摄取程度在良、恶性病变存在明显交叉重叠,SUVmax 虽然是重要诊断依据,但临床工作中需要结合相关影像学检查及临床资料综合判断才能得出比较可靠的诊断结论。其次,由于MET 的摄取不依赖于血脑屏障的破坏,常常在增强MRI 阴性显像的情况下发现局部异常放射性摄取,在显示肿瘤异质性的同时也为立体定向穿刺活检提供了靶点[14]。
3.3 Kmean 与SUVmax 双参数分析与脑肿瘤样病变
在Kmean 与SUVmax 的双参数分析中可见良性病变与恶性肿瘤(缺血vs 胶质母细胞瘤)存在明显不同的影像分布模式。由于恶性肿瘤的细胞多样性及微结构复杂性,胶质母细胞瘤呈现更为明显的离散分布模式;而在亚急性脑梗死的情况下,相对均匀的病变程度和同质性的病理生理改变,使其表现为更加集中和单一的分布特点。因此双参数分析有助于综合评估病变的生物学特点,为诊断及鉴别诊断提供更为全面的影像学信息。本研究存在的不足之处:(1)样本量不足,尤其是良性病变。希望未来研究中能够扩大样本,对结果进行检验和修正。(2)未能构建一个复合指标。
