超高龄高血压患者中性粒细胞/淋巴细胞水平与动态血压参数的相关性
2021-08-12孙晓楠骆雷鸣秦爱梅付士辉
王 吉,孙晓楠,骆雷鸣,秦爱梅,付士辉
(1.解放军总医院第二医学中心保健六科,北京 100853;2.解放军总医院第二医学中心心血管内科,北京 100853)
近年来,越来越多的研究显示炎症在高血压的发生发展中扮演重要角色,故而围绕炎性标记物在高血压预测价值的研究是心血管病研究的新热点之一,其中炎症标记物与患者血压形态、动态血压参数关系的研究吸引了越来越多的关注[1]。中性粒细胞/淋巴细胞(neutrophil to lymphocyte ratio,NLR)作为一种基于血常规、方便获得的新型炎症标记物,包含了2 种白细胞亚型的信息,被认为能够更加准确反映全身性炎症状态,且与多种肿瘤及心血管疾病的预后相关[2],其在高血压患者中的应用日益受到临床的重视[3]。那么对于高龄老年高血压患者,其NLR 水平与血压的负荷、血压形态之间是否具有相关性?本文即针对此点进行初步的探讨。
1 对象与方法
1.1 研究对象
本研究入选2016年10月~2019年12月间在解放军总医院老年心血管内科就诊,年龄≥80岁的高血压患者。高血压的诊断标准参照《中国高血压防治指南2010》。研究设计通过解放军总医院伦理委员会的审核,本研究获得全部患者的知情同意。
1.2 方法
1.2.1 研究对象信息采集
采用病史询问及病历回顾结合的方法收集入选研究对象的年龄、性别、生活方式(吸烟、饮酒状况)及基础病史情况,测定入选患者一般情况如身高、体质量、静息心率、收缩压和舒张压。
1.2.2 炎症相关指标及生化指标的检测
采血检测包括血常规、血生化、肝肾功能、超敏C 反应蛋白(hsCRP)、肌钙蛋白I,肌钙蛋白T等相关指标。根据血常规结果计算NLR。
1.2.3 动态血压参数采集
使用便携袖带式动态血压自动记录系统(匈牙利,Meditech ABPM-04)完成动态血压监测(ABPM)。日间间隔30min 自动测量1 次,夜间60min 测量1 次。计算夜间血压较日间血压下降程度 [(日间血压平均值-夜间血压平均值/日间血压平均值)×100%]。夜间血压较日间血压下降>10%即认定为“杓型”,反之为“非杓型”。计算“睡眠-谷”晨峰(起床后2h 的平均血压-包括夜间最低血压在内lh 的平均血压)和“睡眠-醒”晨峰(起床后2h 的平均血压-起床前2h 的平均血压)[4]。
1.2.4 统计学方法
应用SPSS22.0 软件包对数据进行统计学分析,对于连续性定量资料,首先采用K-S 正态性检验分析其是否服从正态分布,正态分布的定量资料采用方差分析比较组间差异,否则采用Mann-Whitney U 检验比较组间差异。多组间比较采用方差分析,两两比较采用LSD。定性资料,采用卡方检验比较组间差异,等级资料采用秩和检验;并对相关数据做两变量的线性相关分析。
2 结果
2.1 研究对象基线情况
共入选超高龄男性高血压患者280 例,排除伴有急性感染、最终完成资料采集及动态血压检查共238 例,根据动态血压监测结果将患者分为杓型血压及非杓型血压2 组,其基线情况见表1,各基线指标2 组均无统计学差异(均P>0.05)。
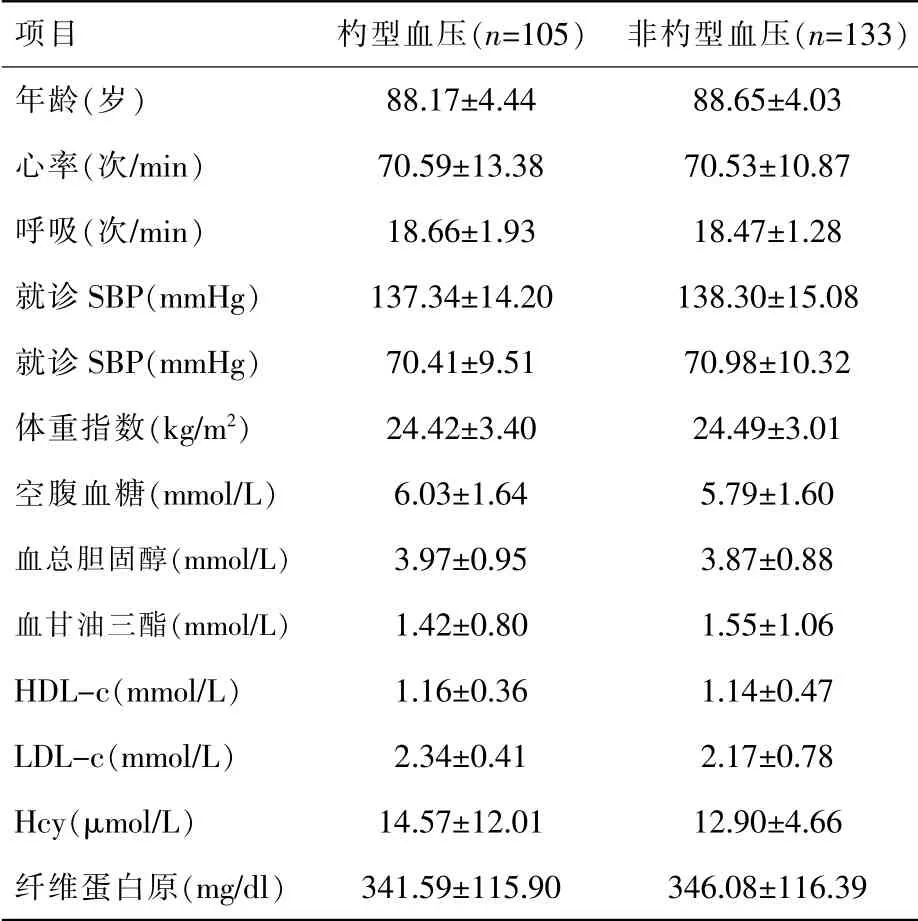
表1 研究对象分组基线情况比较
所有入选患者均接受降压药物治疗,应用1种降压药者52 例、联合应用2 种或是应用复方混合制剂或联合用药者142 例、使用3 种及以上降压药物的44 例,不同药物治疗方案的高血压患者血压形态的组成无统计学差异(P>0.05),其24h平均收缩压及舒张压水平亦无差异,见表2。
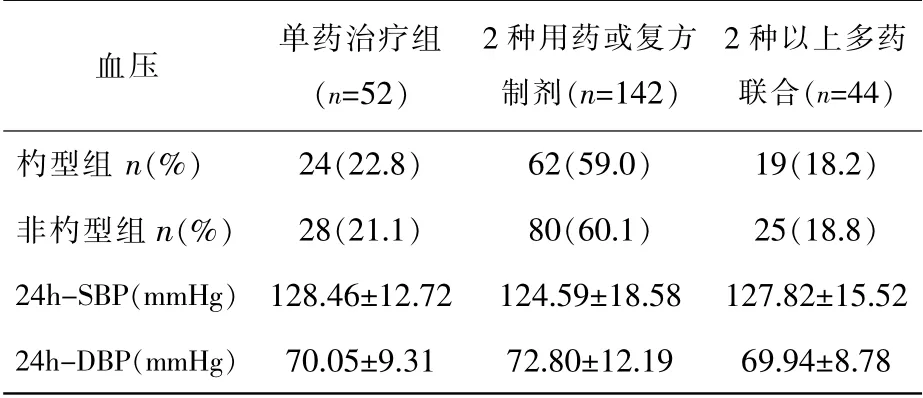
表2 入选高血压患者用药情况及血压情况
2.2 不同形态高血压患者相关炎性指标比较
进一步对研究对象血中的炎症因子变化情况进行比较,结果见表3。与杓型血压组患者相比,非杓型血压患者的hsCRP 及NLR 水平均显著升高(均P<0.05),但白细胞计数水平及肌钙蛋白水平则未显示出差异(均P>0.05)。
表3 不同血压节律患者炎症相关指标的对比(±s)
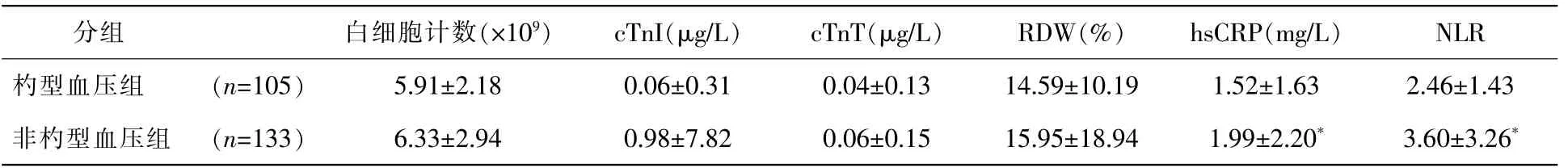
表3 不同血压节律患者炎症相关指标的对比(±s)
注:* 与杓型血压组比较,P<0.05。
分组白细胞计数(×109)cTnI(μg/L)cTnT(μg/L)RDW(%)hsCRP(mg/L)NLR杓型血压组(n=105)5.91±2.180.06±0.310.04±0.1314.59±10.191.52±1.632.46±1.43非杓型血压组(n=133)6.33±2.940.98±7.820.06±0.1515.95±18.941.99±2.20*3.60±3.26*
我们进一步根据NLR 四分位数将患者分为4 组,第1 组<1.68,第2 组1.68~2.37,第3 组2.37~3.46,第4 组>3.46。第1 组~第4 组非杓型血压发生情况见表4,提示不同水平NLR 患者非杓型血压发生率存在的差异有统计学意义(Z=-2.679,P<0.01)。随着NLR 水平增高,非杓型血压增多。
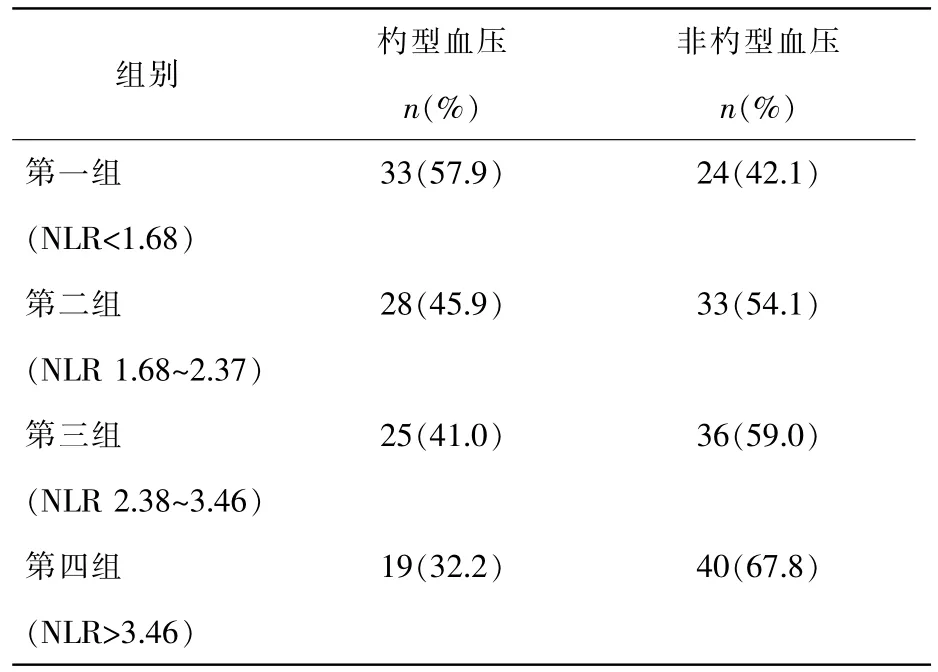
表4 不同组别高血压患者血压形态
2.3 超高龄高血压患者炎性标志物与动态血压参数的相关性
对NLR 及hsCRP 水平与动态血压指标进行相关性分析,结果如表5所示。NLR 与24h-SBP呈现显著正相关(P<0.05);进一步分析显示,NLR与夜间血压水平的关系更为密切,其水平的升高会伴有N-SBP 及N-DBP 的升高(P<0.05);NLR与夜平均/白平均未呈现显著相关性(P>0.05);NLR 与夜间最低血压、睡眠-醒晨峰具有相关性(P<0.05);但与睡眠谷晨峰未呈现显著相关性(P>0.05);NLR 与清晨-晚上无显著相关性(P>0.05);而hsCRP 与睡眠-谷晨峰正相关(P<0.05),与睡眠-醒晨峰无明显相关性(P>0.05)。
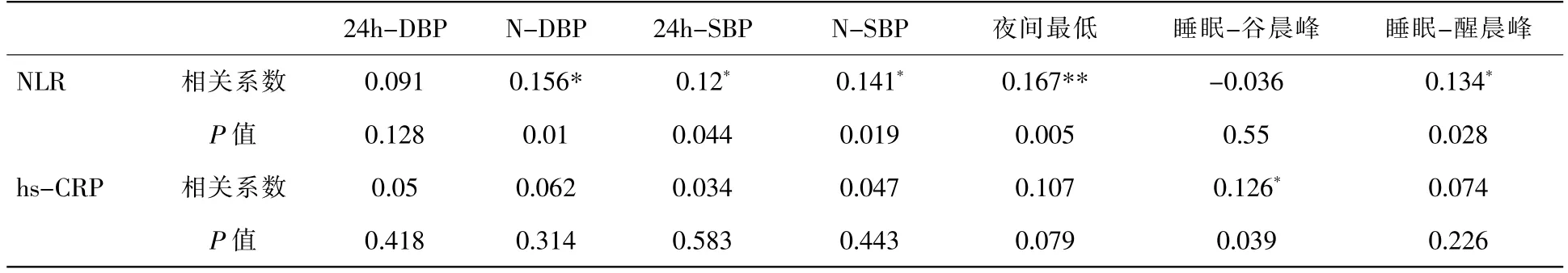
表5 NLR 与动态血压各指标相关性分析
2.4 NLR 对于非杓型血压发生的预测评价
根据患者的NLR 水平及非杓型血压发生情况绘制受试者工作特征(receiver operator characteristic curve,ROC)曲线,结果见图1。曲线下面积(area under the curve,AUC)为0.625(95%CI:0.555~0.696,P=0.001),截断界值点为NLR=1.97,敏感度80.3%,特异度40.1%。hsCRP 的AUC 为0.506(95%CI:0.432~0.581,P=0.872)。
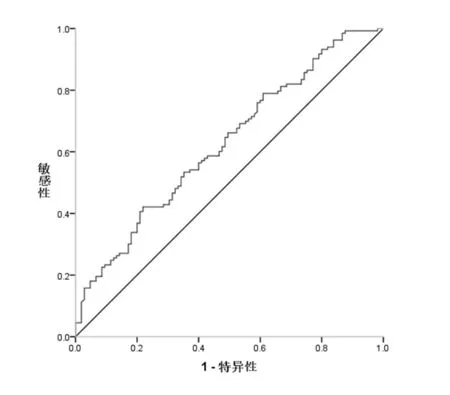
图1 NLR 预测高血压患者血压形态的ROC 曲线
3 讨论
随着持续全身低级别炎症在高血压病理生理进程中作用的肯定,炎性标记物在高血压评价中的作用引起越来越多的关注[5]。一项对于近3 万人的6年的持续追踪研究显示,NLR 水平增高患者高血压发生率增高,即NLR 是高血压发生良好预测因子[6],而另一项研究则进一步发现在60 岁以上的男性患者中这种预测作用更加明显[7]。对于已经发生高血压的患者,NLR 同样显示良好的评价作用。我们既往的研究显示在各种原因住院高龄高血压患者中,NLR 水平是心血管事件的良好预测因子[8],提示NLR 水平监测可以为高血压患者的管理提供丰富的信息。
Aydin 等人已经证明,高NLR 与高血压前期患者中与血压水平密切相关,NLR 水平有助于确定CV 风险和治疗方案[9];Cimen 等人[10]对于初诊高血患者患者的研究发现,日间舒张压(DBP)、日间收缩压和白天舒张压负荷在NLR 上2 个四分位数患者中显著升高,提示NLR 水平的增高容易出现日间高血压的情况;我们的研究结果则显示在高龄男性患者中,NLR 的与夜间血压水平的关系更为密切,而且首次发现NLR 与睡眠-晨峰的发生关系密切,这种结果的差异可能与研究对象的年龄、高血压病程有关。
正常血压昼夜节律变化对于延缓高血压靶器官损伤具有重要意义,血压节律的改变往往伴随着更早的靶器官损伤的发生[11]。一方面系统性低炎症状态及免疫系统中的细胞激活,氧化应激导致内皮功能障碍,可以说血压节律的异常是持续炎症状态的结果[12],另一方面这种节律的改变,晨峰的存在,会加重体内慢性炎症的持续存在,进一步刺激纤维化进程,最终导致靶器官损伤[5,13],形成恶性循环,因此炎症状态对血压及相关参数具有重要影响。本研究发现,非杓型血压的老年患者hsCRP、NLR 水平均明显增高,也佐证炎症与血压形态改变的关系。进一步分析结果显示对于高龄男性高血压患者来说,其NLR 水平与血压形态关系似乎更加密切,随着NLR 水平增高,非杓型血压比例增多。NLR>1.97 对于非杓型血压的预测敏感性达到敏感度80.3%(P<0.05),而hsCRP水平对于血压形态的预测性则未显示出显著性。此外NLR 与24-SBP、N-SBP 及N-DBP 等多项动态血压参数均呈显著正相关(P<0.05);特别值得注意的是,NLR 高的老年患者晨峰更加明显,往往意味着更容易出现靶器官的损伤及事件[14,15]。相较于其他心血管炎性标志物,NLR 是基于血常规计算获得的指标,具有方便、经济等优势,在高血压慢病管理的过程中便于获得、监测。通过监测NLR 水平变化可以为临床老年高血压患者的管理提供更多的参考。
本研究由于客观条件所限,仅入选了男性患者,需要在今后的工作中进一步完善。
