大孔树脂联合Sephadex LH-20葡聚糖凝胶纯化蜂胶总黄酮工艺研究
2021-08-12汤毛毛常相伟刘劲松彭代银王国凯桂双英
李 治,汤毛毛,李 景,常相伟,2,3,4,刘劲松,彭代银,5,王国凯,桂双英,2,3,4
(1.安徽中医药大学药学院,安徽 合肥 230012;2.药物制剂技术与应用安徽省重点实验室,安徽 合肥 230012;3.安徽省中医药科学院药物制剂研究所,安徽 合肥 230012;4.安徽省教育厅现代药物制剂工程技术研究中心,安徽 合肥 230012;5.中药复方安徽省重点实验室,安徽 合肥 230012)
蜂胶为蜜蜂科昆虫意大利蜂(Apis
mellifera
L.)工蜂采集的植物树脂与其上颚腺、蜡腺等分泌物混合形成的黏性固体胶状物。现代研究表明,蜂胶中含有黄酮类、萜烯类、酚酸类、芳香醛类及氨基酸、酶、矿物质等多种成分,其中黄酮类化合物是主要活性成分,具有抗肿瘤、抗氧化、抗菌、降血糖等广泛的药理作用。关于蜂胶黄酮类成分的提取研究较多,主要有溶剂浸提法、超声提取法、微波提取法及超临界萃取法等,但提取液中蜂胶总黄酮纯度较低,难以直接应用,需要进一步纯化。大孔吸附树脂是一种广泛应用的吸附分离材料,文献报道其对黄酮类成分具有较好的选择吸附性。本实验采用大孔吸附树脂和Sephadex LH-20葡聚糖凝胶联用分离纯化蜂胶总黄酮,为蜂胶总黄酮的进一步研究与开发利用奠定基础。1 仪器与试药
紫外可见分光光度计(型号 UV-8000):上海元析仪器有限公司;恒温培养振荡器:上海智城分析仪器制造有限公司;真空干燥箱(型号 DZF-250):郑州长城科工贸有限公司;液晶超声波清洗器(型号 KS-250DE):昆山洁力美超声仪器有限公司;旋转蒸发仪(型号 R-300):瑞士BUCHI公司。
蜂胶(批号 FJ20190213):安徽绩溪五蜂园蜂业有限公司,经安徽中医药大学彭华胜教授鉴定为中国蜂胶;HPD-100、HPD-500、HPD-600、HPD-722、HPD-826、AB-8、ADS-17、NKA-9、D101型大孔吸附树脂:沧州宝恩吸附材料科技有限公司;Sephadex LH-20葡聚糖凝胶(批号 413B052):上海索莱宝生物科技有限公司;芦丁对照品(批号 Y24F11Y17051,质量分数≥98%)、杨梅素对照品(批号 YM0311YA13,质量分数≥98%):上海源叶生物科技有限公司;白杨黄素对照品(批号 C93335CCK0,质量分数≥97%)、芹菜素对照品(批号 A90650IFP1,质量分数≥98%)、山奈酚(批号 J70002JBY1,质量分数≥98%)、高良姜素(批号 G01300IGP1,质量分数≥98%):天津希恩思生化科技有限公司;乔松素(批号 CFS201802,质量分数≥98%):Chem Faces公司;槲皮素(批号 C10623828,质量分数≥97%):上海麦克林生化科技有限公司;水为超纯水,其余试剂均为分析纯。
2 方法与结果
2.1 蜂胶总黄酮的含量测定
2.1.1 对照品溶液的配制 精密称取芦丁对照品10.14 mg,置50 mL量瓶中,加无水乙醇溶解并定容至刻度,摇匀,配制成浓度为0.202 8 mg/mL的对照品溶液。
2.1.2 供试品溶液的配制 取蜂胶粉末(过3号筛)1.0 g,精密称定,用25 mL 95%乙醇超声(频率:40 kHz,功率:100 W)提取30 min,过滤,取续滤液,备用。
2.1.3 标准曲线的绘制 精密吸取芦丁对照品溶液1.0、2.0、3.0、4.0、5.0、6.0 mL,分别置于50 mL容量瓶中,加95%乙醇至总容积为15 mL,依次加入硝酸铝溶液、醋酸钾溶液各1 mL,摇匀,加水至刻度,摇匀,静置1 h。于415 nm处,以30%乙醇为空白试剂调零,415 nm波长下测定吸光度值(A),绘制吸光度值与芦丁浓度的标准曲线,得回归方程:Y
=25.
379X
+0.
018 5,R
=0.
999 5,结果表明芦丁在0.004~0.024 mg/mL线性关系良好。2.2 上样液的制备 取蜂胶粉末(过3号筛)约45 g,精密称定,加入25倍量95%乙醇,超声提取30 min,过滤,滤液减压回收溶剂,浓缩至无醇味,用20%乙醇复溶至1 000 mL,上样液中蜂胶总黄酮浓度为1.25 mg/mL。
2.3 大孔吸附树脂的预处理 将9种不同型号的大孔树脂分别浸泡在95%乙醇中24 h,充分溶胀后装柱,用95%乙醇冲洗,直至流出液澄清、蒸干后无残留物为止,再用大量超纯水冲洗至无醇味,备用。
2.4 静态吸附试验
2.4.1 大孔吸附树脂的筛选 精密称定D101、HPD-100、AB-8、HPD-722、ADS-17、HPD-826、NKA-9、HPD-500、HPD-600型大孔树脂各2.0 g(湿质量),置于100 mL锥形瓶中,加入浓度为1.25 mg/mL的上样液50 mL,25 ℃恒温振荡24 h,振荡频率为100 r/min,滤过,取续滤液测定,计算各树脂在25 ℃下对蜂胶总黄酮的吸附量和吸附率。将上述吸附饱和的大孔树脂用超纯水清洗后,分别加入95%乙醇50 mL,25 ℃恒温振荡12 h进行静态解吸,滤过,取续滤液测定,计算解吸率。结果见表1。
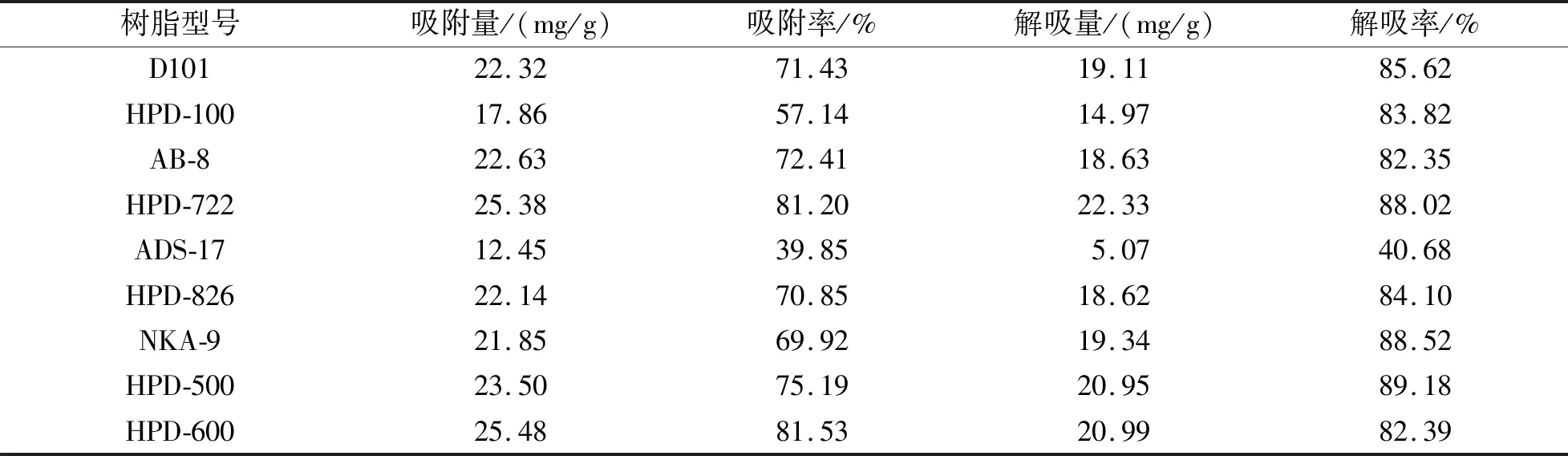
表1 不同类型大孔树脂对蜂胶总黄酮的静态吸附量及吸附率
由表1可知,HPD-722和HPD-600型大孔树脂对蜂胶总黄酮的吸附能力较强;而HPD-722型大孔树脂对蜂胶总黄酮的解吸能力强于HPD-600,因此选择HPD-722型树脂用于蜂胶总黄酮的分离纯化。
2.4.2 静态吸附曲线的绘制 取HPD-722型大孔树脂约1 g(湿质量),精密称定,共24份,分别置50 mL锥形瓶中,加入浓度为1.25 mg/mL的上样液20 mL,在25 ℃条件下以100 r/min的速率振荡24 h,每隔1 h取出一个锥形瓶,测定其浓度,绘制静态吸附曲线,结果见图1。

图1 HPD-722型大孔吸附树脂的静态吸附曲线
在0~9 h间,树脂对蜂胶总黄酮的吸附量随着时间增加而增加,在9 h以后,树脂的吸附量趋于平衡,吸附率达81.13%,提示HPD-722型大孔树脂对蜂胶总黄酮吸附9 h时基本达到吸附饱和。
2.5 动态吸附行为的考察
2.5.1 泄露曲线的绘制 取HPD-722大孔树脂约10 g(湿质量),精密称定,装入层析柱(2 cm×30 cm),室温下将浓度为1.25 mg/mL的上样液,以1.0 mL/min加入树脂柱中,流出液每5 mL收集一份,按“2.1”项下方法测定吸光度值,并绘制泄露曲线。当流出液浓度为上样液浓度的1/10时,到达泄露点,认为此时为最佳上样容积。由图2可见,在第19份流出液中浓度为0.126 mg/mL,达到上样液浓度的1/10,因此选择上样液容积为95 mL。
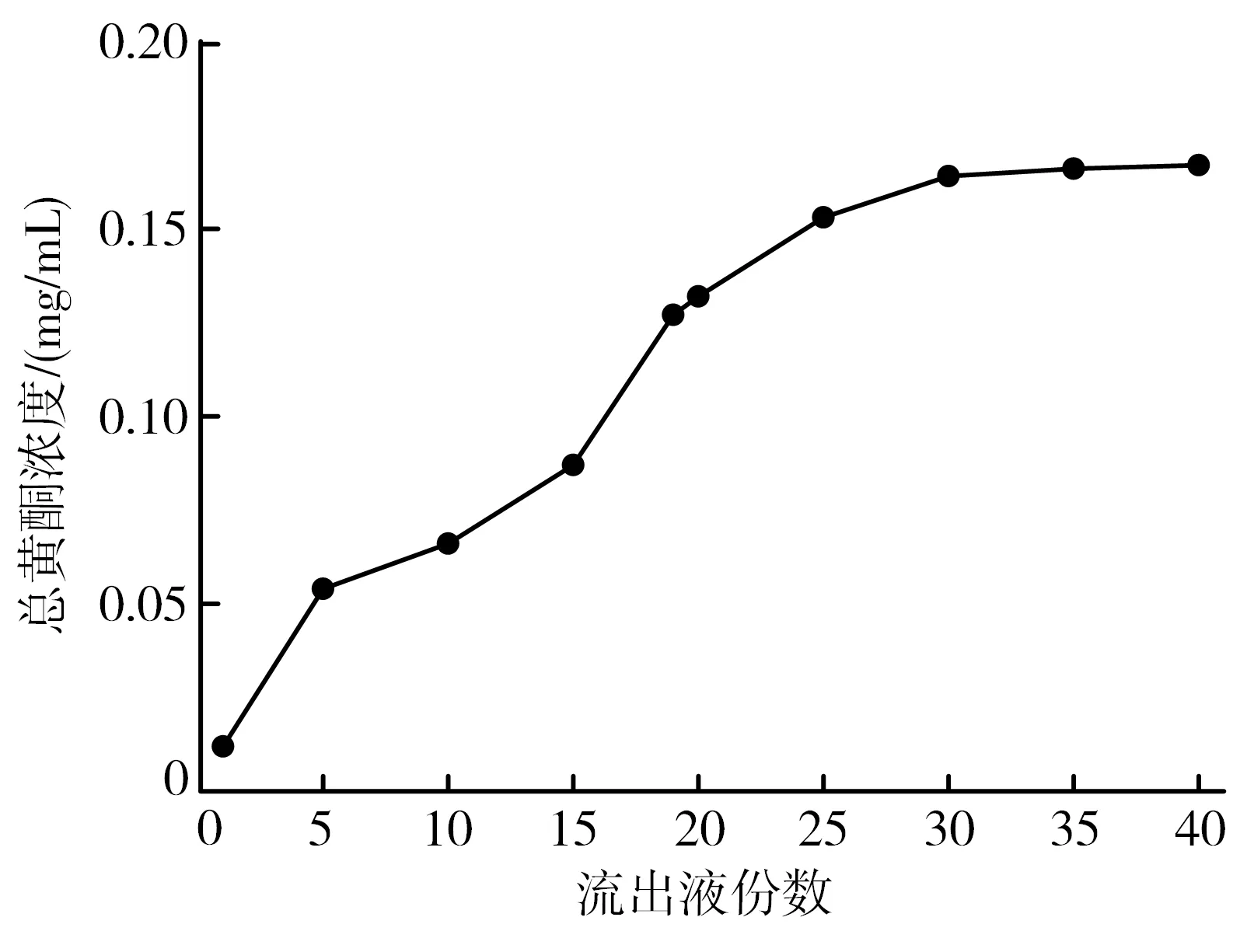
图2 蜂胶总黄酮在HPD-722大孔树脂上的泄露曲线
2.5.2 上样液浓度对动态吸附性能的影响 取HPD-722大孔树脂约10 g(湿质量),精密称定,共5份,缓慢装入层析柱(2 cm×30 cm)中,径高比为1∶9,配制浓度分别为0.33、0.68、1.34、2.47、4.64 mg/mL的上样液各95 mL,以每小时2倍床体积(bed volume,BV)上样,考察最佳上样浓度。结果各上样浓度下的吸附率分别为95.89%、95.16%、93.28%、92.15%、85.81%,结果表明,当上样液浓度为2.47 mg/mL时,树脂吸附得较为饱和,吸附率也较高,因此选择上样液浓度为2.47 mg/mL。
2.5.3 上样容积流量对动态吸附性能的影响 取HPD-722型大孔树脂约10 g(湿质量),精密称定,共4份,缓慢装入层析柱(2 cm×30 cm)中,径高比为1∶9,以浓度为2.47 mg/mL的上样液95 mL分别以每小时1、2、3、4 BV上样,考察最佳上样容积流量。结果各上样容积流量下的吸附率分别为92.08%、92.94%、80.47%、67.82%,结果表明,当上样容积流量为每小时2 BV时,总黄酮的吸附率较高,因此选择上样容积流量为每小时2 BV。
2.5.4 径高比对动态吸附性能的影响 取HPD-722型大孔树脂约10 g(湿质量),精密称定,共4份,缓慢装入径高比为1∶2、1∶4、1∶9、1∶12的层析柱中,将浓度为2.47 mg/mL的上样液95 mL以每小时2 BV上样,考察最佳径高比,结果各径高比下的吸附率分别为84.87%、90.09%、93.32%、93.56%,结果表明当径高比为1∶9时,吸附率增加趋于平缓,因此确定最佳径高比为1∶9。
2.5.5 洗脱剂容积分数对HPD-722型大孔树脂洗脱蜂胶总黄酮效果的影响 取HPD-722型大孔树脂约10 g(湿质量),精密称定,缓慢装入层析柱(2 cm×30 cm)中,径高比为1∶9,将浓度为2.47 mg/mL的上样液95 mL以每小时2 BV上样,待吸附饱和后,依次用超纯水及10%、20%、30%、40%、50%、60%、70%、80%、90%、95%的乙醇溶液各2 BV梯度洗脱,考察最佳洗脱剂容积分数。结果各部分洗脱率分别为0、0、0.21%、2.89%、12.53%、31.24%、26.49%、15.83%、6.61%、3.58%、2.45%。结果表明超纯水和10%乙醇几乎没有洗脱下总黄酮,用超纯水洗脱时,用Fehling试剂检测显阴性,即用纯水洗脱时无水溶性单糖被洗脱下。20%、30%乙醇洗脱液中总黄酮含量很低,40%~70%乙醇洗脱液中总黄酮含量较高,而80%~95%乙醇洗脱液中也含有少量总黄酮,故确定80%乙醇为洗脱溶剂。
2.5.6 洗脱剂用量对洗脱效果的影响 取HPD-722型大孔吸附树脂约10 g(湿质量),精密称定,按“2.5.5”项下方法上样除杂,再用80%乙醇溶液120 mL(8 BV)以每小时2 BV洗脱,考察最佳洗脱剂用量。结果洗脱剂用量为1、2、3、4、5、6、7、8 BV的洗脱率分别为28.15%、69.21%、78.53%、83.76%、85.01%、85.84%、86.36%。当洗脱剂用量为1、2 BV时,总黄酮洗脱率分别为28.15%和41.06%;当洗脱剂用量为3、4 BV时,总黄酮洗脱率分别为9.32%和5.23%。结果表明此时树脂上吸附的黄酮类成分已基本洗脱完全,因此确定洗脱剂用量为4 BV。
2.5.7 洗脱剂容积流量对洗脱效果的影响 取HPD-722型大孔树脂约10 g(湿质量),精密称定,共4份,按“2.5.5”项下方法上样除杂,再用80%乙醇溶液60 mL(4 BV)分别按每小时1、2、3、4 BV洗脱,考察最佳洗脱剂容积流量。结果各洗脱容积流量下的洗脱率分别为89.12%、86.76%、83.24%、72.41%。蜂胶总黄酮的洗脱率随着洗脱容积流量的增加而减少,故确定洗脱剂容积流量为每小时1 BV。
2.5.8 大孔树脂最佳纯化工艺及验证试验 根据上述试验结果,确定纯化蜂胶总黄酮的最佳工艺条件为选用HPD-722型大孔树脂,比上样量为0.43 g/g(药材/湿树脂),上样液浓度为2.5 mg/mL,上样容积为95 mL,上样容积流量为2 BV/h,径高比为1∶9,洗脱时先以30%乙醇3 BV除杂,再用80%乙醇4 BV洗脱,洗脱容积流量为每小时1 BV。
采用大孔树脂最佳纯化工艺进行验证试验,结果见表2。结果表明,80%乙醇的平均洗脱率为87.46%,固形物由1.15 g减少到0.452 g,质量分数从20.65%升至平均41.42%(RSD=2.28%),表明建立的纯化工艺对蜂胶中黄酮类成分有较好的分离纯化效果。
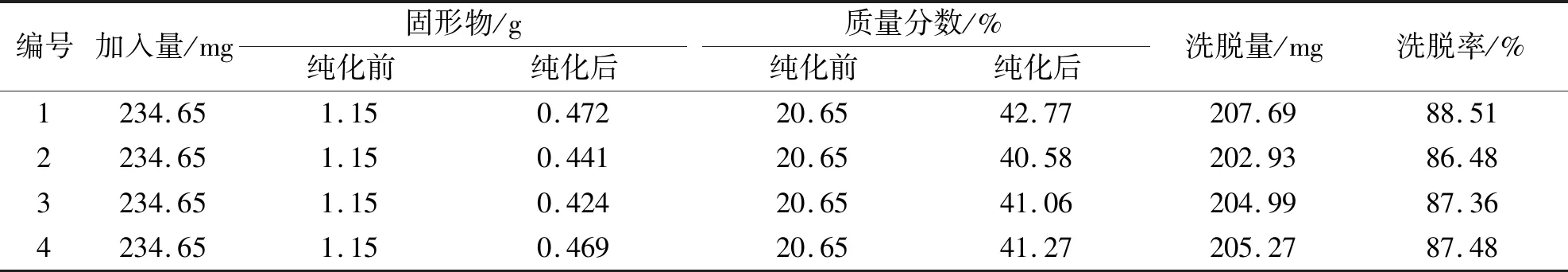
表2 大孔树脂纯化工艺验证结果
2.6 Sephadex LH-20纯化蜂胶总黄酮的工艺研究
2.6.1 洗脱剂容积分数对Sephadex LH-20纯化蜂胶总黄酮效果的影响 称取适量葡聚糖凝胶,甲醇溶胀24 h后,装入2.5 cm×180 cm层析柱中,柱容积为500 mL。取经大孔树脂纯化后的蜂胶总黄酮Ⅰ(质量分数:41.42%)1.2 g,精密称定,用少量甲醇超声溶解后,上样于Sephadex LH-20层析柱,分别以100%、90%、80%、70%甲醇洗脱,洗脱流速为1 mL/min,每10 min收集一个流份。各流份分别点样于聚酰胺薄膜,以三氯化铝为显色剂,于紫外365 nm下与蜂胶中主要黄酮单体对照品(高良姜素、槲皮素、芦丁、杨梅素、芹菜素、白杨素、松属素、山奈酚)点样后进行比对,将紫外灯下显现相同颜色的流份进行合并,浓缩,干燥,得蜂胶总黄酮Ⅱ。取蜂胶总黄酮Ⅱ适量,按“2.1”项下方法,计算蜂胶总黄酮Ⅱ的纯度及回收率,结果见表3。由表3可知,随着洗脱剂甲醇容积分数的降低,蜂胶总黄酮纯度和回收率均呈降低趋势,因此选择100%甲醇作为洗脱剂。
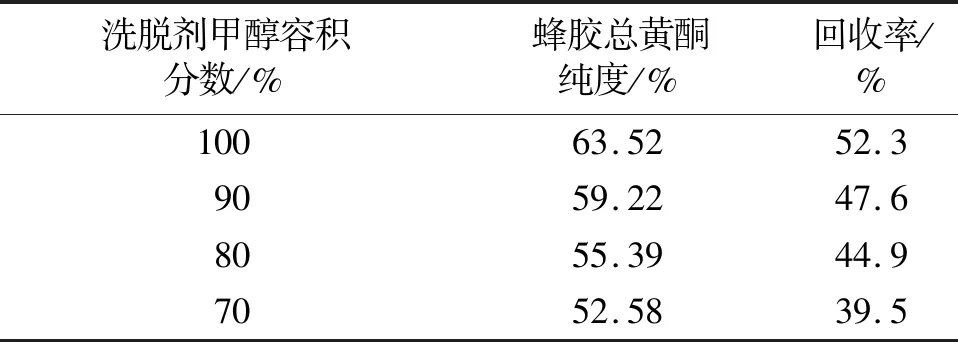
表3 不同洗脱剂容积分数下蜂胶总黄酮纯度及回收率
2.6.2 洗脱剂容积流量对Sephadex LH-20纯化蜂胶总黄酮效果的影响 取经大孔树脂纯化后的蜂胶总黄酮Ⅰ(质量分数:41.42%)1.2 g,精密称定,用少量甲醇超声溶解后,上样于Sephadex LH-20层析柱,以甲醇洗脱,洗脱流速分别为0.50、0.75、1.00、1.25 mL/min,其他工艺同“2.6.1”,取蜂胶总黄酮Ⅱ适量,按“2.1”项下方法,计算蜂胶总黄酮Ⅱ的纯度及回收率,结果见表4。由表4可知,蜂胶总黄酮的纯度和回收率都随着洗脱剂容积流量的增加而降低,因此选择洗脱容积流量为0.75 mL/min。

表4 不同洗脱剂容积流量下蜂胶总黄酮纯度及回收率
2.6.3 Sephadex LH-20最佳纯化工艺及验证试验 据上述试验结果,确定最佳工艺条件为取经大孔树脂纯化后的蜂胶总黄酮Ⅰ1.2 g,精密称定,用少量甲醇超声溶解后上样于Sephadex LH-20层析柱,以甲醇洗脱,洗脱流速为0.75 mL/min,7.5 mL作为一个流份收集。各流份点样于聚酰胺薄膜,以三氯化铝为显色剂,于紫外365 nm下与蜂胶中主要黄酮单体对照品点样后进行比对,将紫外灯下显现相同颜色的流份进行合并,浓缩,干燥,得蜂胶总黄酮Ⅱ。
取4份经大孔树脂纯化后的蜂胶总黄酮Ⅰ(质量分数:41.42%)约1.2 g,精密称定,按Sephadex LH-20最优工艺进行纯化,结果见表5。由验证结果可知,经Sephadex LH-20柱层析后,固形物由452 mg减少到平均162 mg,质量分数从41.42%升至平均68.48%(RSD=2.05%);平均回收率为59.1%(RSD=1.05%),表明经Sephadex LH-20柱层析后,蜂胶总黄酮纯度可以进一步提高。
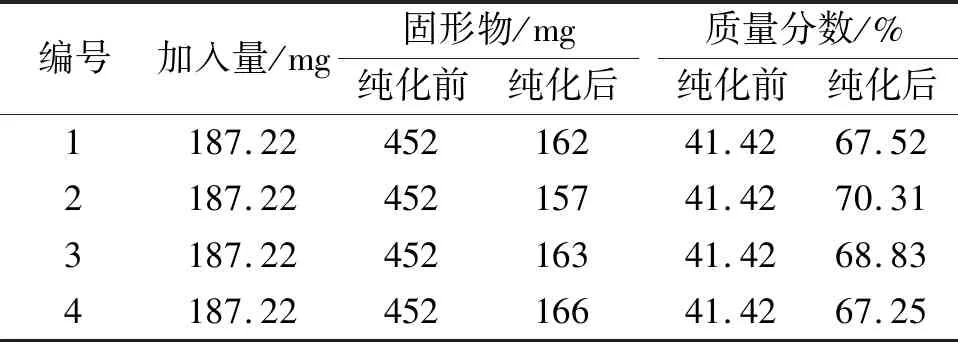
表5 纯化工艺验证结果
3 讨论
大孔树脂是一类由有机高分子聚合物构成的吸附材料,具有稳定性高、吸附选择性强、解吸条件温和、易于再生等优点,这种方法提取率较高、成本较低,因而适合用于工业化生产,目前已较多地用于黄酮类化合物的分离纯化。Sephadex LH-20型葡聚糖凝胶适用于分离有机溶剂中的亲脂性化合物,其分离效果好,可再生利用,因而常用于中药有效成分的分离。
本研究前期参考相关文献及适用于分离纯化黄酮类成分的各类型树脂,从而选择了此9种型号的大孔吸附树脂进行筛选。由于蜂胶中含有的脂溶性成分较多,几乎不溶于水,难以用水对蜂胶中的有效成分进行提取,而多以乙醇为溶剂。由于大孔吸附树脂在蜂胶乙醇提取液中对黄酮类成分几乎不吸附,因此本研究参考了相关文献,并根据前期实验结果,以醇提水沉法制备蜂胶大孔树脂上样液,确定最终上样液乙醇浓度为20%。此方法制备的上样液上样于大孔树脂柱中,蜂胶总黄酮吸附率较高,适用于大孔树脂较为充分地富集蜂胶中的黄酮类成分。
Sephadex LH-20型葡聚糖凝胶对分离黄酮类化合物效果较好,已较为广泛地应用。在使用时,应尽量增加柱长,调缓洗脱流速至每滴3~4 s,以达到较好的分离纯化效果。
本实验制备得到的蜂胶总黄酮固形物由1.15 g减少到0.268 g,总黄酮质量分数从20.65%提高到68.48%,表明HPD-722型大孔吸附树脂联合Sephadex LH-20型葡聚糖凝胶可有效纯化富集蜂胶中的黄酮类成分,该工艺可以为蜂胶总黄酮及其原药材的研究与开发提供参考。
