高效液相色谱法测定桔梗多糖对桔梗皂苷D在大鼠体内药物代谢动力学参数的影响
2021-08-12任蓉蓉陈青青张青青尹登科
任蓉蓉,陈青青,张青青,杨 晔,2,3,尹登科,2,3
(1.安徽中医药大学药学院,安徽 合肥 230012;2.新安医学教育部重点实验室,安徽 合肥 230012;3.药物制剂技术与应用安徽省重点实验室,安徽 合肥 230012)
桔梗为桔梗科植物桔梗[Platycodon
grandiflorum
(Jacq.)A.DC.]的干燥根,常以“桔梗汤”或“桔梗水提液”给药,其主要活性成分为三萜皂苷。现代药理学研究显示,桔梗具有祛痰止咳、抗肿瘤、抗炎症、保肝、降糖降脂和调节免疫等多种药理活性,其中桔梗皂苷D(platycodin D,PD)被认为是主要的有效成分。但PD口服生物利用度低,相关的体内药物代谢动力学研究也较少。“桔梗汤”或“桔梗水提液”在水煎煮过程中使桔梗多糖(Platycodon
grandiflorum
polysaccharides,PGP)成分溶出,PGP与小分子活性成分PD一同服下。目前关于桔梗的研究主要集中在其小分子活性成分PD,对于PGP主要集中在提取、抗氧化等方面,很少有研究关注PGP是否在“桔梗汤”或“桔梗水提液”发挥药效时起到一定作用。本研究通过大鼠灌胃模型,探究PGP对PD口服吸收过程中可能产生的影响。本研究对于探讨多糖与小分子的协同作用以及提高药物疗效和安全性,指导新药开发均具有重要意义。1 材料与试剂
1.1 药品与试剂 PGP(批号DST191105-178,纯度≥98.0%)、PD(批号DST191103-015,纯度≥98.0%):成都德思特生物技术有限公司;水为超纯水;乙腈、甲醇(色谱纯):瑞典Oceanpak公司;其余试剂(分析纯):国药集团化学试剂有限公司。
1.2 实验动物及分组 健康SD大鼠24只,SPF级,雌雄各半,体质量(200±25)g,由安徽医科大学实验动物中心[生产许可证号:SCXK(皖)2017—001]提供。常规饲养,自由饮食饮水,饲养环境温度为18~26 ℃,相对湿度为(55±5)%,研究所涉及的动物实验经安徽中医药大学实验动物伦理委员会批准。大鼠实验前禁食12 h,可自由饮水。将实验大鼠随机分为PD组,PD+PGP低、中、高剂量组(PD-PGP-L、PD-PGP-M、PD-PGP-H组),每组6只。
1.3 仪器 Vortex-genie涡旋混合器:美国Scientific Industries;Milli-Q超纯水器:美国Millipore公司;Centrifuge台式高速离心机:上海东兢电子有限公司;BP212D型电子天平:德国Sartorius公司;LC-20ADXR液相色谱仪:日本岛津公司。
2 方法与结果
2.1 方法学考察
2.1.1 色谱条件 Agilent ZORBAX SB C色谱柱(250 mm×4.6 mm,5 μm);流动相:乙腈-水(25∶75,V/V
);流速:1.0 mL/min;柱温:30 ℃;进样量:10 μL;检测波长:206 nm。2.1.2 标准添加对照品的制备 精密称取PD对照品10.0 mg,以甲醇溶解并定容至10 mL,得质量浓度为1.0 mg/mL的对照品储备液。精密吸取上述储备液10 μL,加入100 μL空白大鼠血浆中,加入甲醇400 μL,涡旋除蛋白5 min,15 000 r/min离心15 min,取上清,置氮气干燥仪下挥去溶剂,残渣加100 μL乙腈复溶,即得。供试品溶液的制备方法:精密吸取含药血浆100 μL,自“加入甲醇”起,按照标准添加溶液对照品制备方法处理样品,即得。
2.1.3 专属性考察 分别考察大鼠空白血浆、空白血浆加PGP、空白血浆加PD对照品以及PD-PGP-H组给药30 min后大鼠血浆样品,每组6份,按照“2.1.2”项下血浆样品处理操作,得到相应的色谱图(见图1)。结果表明,PD保留时间为8.53 min,血浆中内源性物质对PD的测定无干扰。
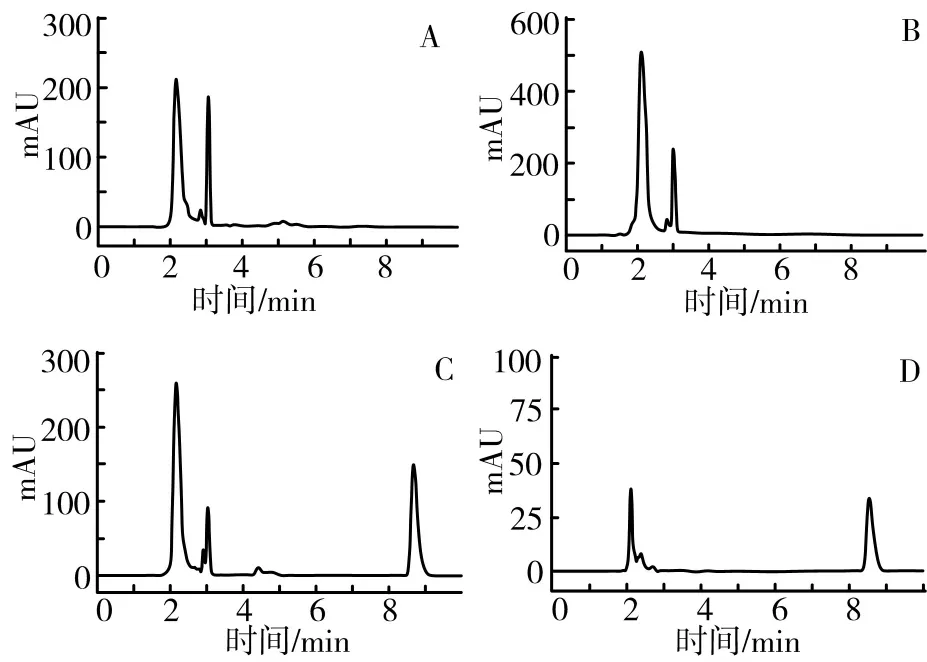
图1 空白血浆(A)、PGP血浆样品(B)、PD对照品血浆样品(C)、PD-PGP-H组含药血浆样品(D)色谱图
2.1.4 定量限确定 取100 μL空白血浆,加入PD对照品溶液,按“2.1.2”项下血浆样品处理方法进行操作。当色谱峰信噪比(S/N)=10时,得定量限为5 μg/mL(准确度为95.53%,RSD=3.05%,n
=6);当色谱峰的S/N=3时,最低检测限为2 μg/mL。2.1.5 标准曲线及线性范围确定 取标准品储备液,以空白大鼠血浆配制浓度分别为0、5、10、20、40、80、100 μg/mL的PD标准血浆样品,按照“2.1.2”项下血浆样品处理操作,以样品浓度(ρ
)为横坐标,样品的峰面积(A
)为纵坐标,最小二乘法计算回归方程。测得回归方程为A
=10 906ρ
-5 534.
8(r
=0.
999 3),说明PD在5~100 μg/mL浓度范围内线性关系良好。2.1.6 回收率考察 精密移取空白血浆100 μL,分别加入低、中、高3种浓度(5、50、100 μg/mL)的PD溶液各10 μL,各浓度样品平行6组,按“2.1.2”项下血浆样品处理操作,10 μL进样分析。经计算,PD低、中、高3个浓度样品的回收率分别为(103.60±2.60)%、(96.33±2.29)%、(100.74±2.10)%,RSD分别为2.51%、2.38%、2.09%,符合生物样品分析原则要求的回收率。
2.1.7 日内及日间精密度考察 精密移取空白血浆100 μL,分别加入低、中、高3种浓度的PD溶液(5、50、100 μg/mL)各10 μL,各浓度样品平行5组,按“2.1.2”项下血浆样品处理操作,10 μL进样分析。3种浓度溶液均1日内重复进样6次,测定日内精密度,连续进样6 d,测定日间精密度。实验结果显示,低、中、高3种浓度PD溶液的日内精密度RSD分别为3.10%、2.94%、2.41%,日间精密度RSD分别为2.23%、2.81%、2.34%,符合生物样品分析原则要求。
2.1.8 稳定性实验 精密移取空白血浆100 μL,加入低、中、高3种浓度(5、50、100 μg/mL)的PD溶液各10 μL,各浓度样品平行5组,按“2.1.2”项下血浆样品处理操作,分别进行室温长期放置、反复冻融3次和-20 ℃冰箱冻存2周后,10 μL进样分析,并考察稳定性。结果显示低、中、高3种浓度稳定性的RSD分别为3.62%、4.31%、1.43%,结果表明PD在上述条件下稳定性良好,符合生物样品分析原则。
2.2 动物实验 PD组灌胃液的制备:精密称取PD,用生理盐水溶解并定容,得2 mg/mL的PD灌胃溶液。另精密称取3种不同质量的PGP,溶解于上述PD溶液中,调节PGP浓度至2、4、8 mg/mL,即得PD-PGP-L组、PD-PGP-M组、PD-PGP-H组灌胃液。大鼠的灌胃容积为10 mL/kg。PD组只灌胃2 mg/mL的PD,PD-PGP-L、PD-PGP-M与PD-PGP-H组分别灌胃2 mg/mL的PD和2、4、8 mg/mL的PGP。给药后5、10、15、30、45、60、90、120、180、240、360 min,从眼眦取血0.5 mL,置于经肝素处理的EP管中,3 000 r/min离心10 min,收集血浆。
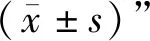
2.4 PD血药浓度-时间曲线 大鼠单剂量灌胃PD或PD+PGP所得的平均血药浓度-时间曲线见图2。

图2 PD在大鼠体内血药浓度-时间曲线
2.5 灌胃PD的主要药物代谢动力学参数 将计算所得的血药浓度-时间数据,采用DAS 2.1软件进行拟合(二室模型,权重系数为1),进而计算药物代谢动力学参数(见表1)。结果表明,PD+PGP灌胃后大鼠体内的药物代谢动力学参数发生了显著改变。与PD组相比,各PD-PGP实验组PD的达峰时间均显著缩短,峰浓度均显著提高,血药浓度-时间曲线下面积显著增加(P
<0.
05)。此外,PD-PGP-M组的清除率显著减小(P
<0.
05)。
表1 PGP对PD药物代谢动力学参数的影响
3 讨论
中药大多采用水煎煮口服的给药方式,可溶性多糖可在水煎煮过程中溶解在汤剂中。多糖大分子的生理药理活性近年来受到了越来越多的关注,被发现具有免疫调节、抗肿瘤、延缓衰老、降血糖、抗病毒、抗炎等多种生物活性。当桔梗以水煎煮(桔梗汤或桔梗水提液)口服的给药方式,可溶性多糖在中药水煎液中与小分子活性成分PD一同服下进入胃肠道。由于人体缺乏多糖水解酶,大部分多糖不能被人体直接消化和吸收。研究证实,中药多糖被作为肠道菌群代谢底物,与肠道菌群相互作用时产生一些其他的生物活性物质对药物的体内过程产生影响。此外,研究证实,PGP可以诱导T细胞以及巨噬细胞的增殖,显著促进相关细胞因子的分泌。细胞因子的产生会对肠上皮的通透性产生影响,进而影响药物在体内的代谢。本研究结果显示,PGP能够显著缩短PD的达峰时间,显著减小清除率,提高最大药物浓度以及增大血药浓度-时间曲线下面积。由此推测,PGP与小分子活性物质PD一同服下后,一方面可能与肠道菌群发生相互作用,另一方面可能直接影响相关效应因子的分泌,进而对PD的体内药物代谢动力学参数产生影响。PGP影响PD在大鼠体内药物代谢动力学参数的具体机制将是下一步研究的方向和重点内容。
