樟芝深层发酵液萃取物对食源性致病菌的抑制效果*
2021-08-11陆春雷赵雨菡姜金源徐思玥任怡琳王娟娟冒雅妍郭影琪李华祥
陆春雷,赵雨菡,姜金源,徐思玥,任怡琳,王娟娟,冒雅妍,郭影琪,李华祥**
(1.扬州大学食品科学与工程学院,江苏 扬州 225127;2.江南大学药学院,江苏 无锡 214122)
樟芝(Antrodia cinnamomea),又名牛樟芝、牛樟菇,属于担子菌纲(Basidiomycetes) 非褶菌目(Polyporales) 多孔菌科 (Polyporaceae) 薄孔菌属(Antrodia),是我国台湾地区特有的一种食药兼用大型真菌,具有保肝、抗氧化、抗癌、抗肿瘤、降血脂及调节免疫等多种生物活性[1-2]。牛樟芝的唯一天然寄主牛樟树是我国台湾地区的特有树种,数量稀少且盗伐严重,加之野生樟芝生长极其缓慢,导致其子实体资源稀缺、价格昂贵、供不应求[3]。为弥补野生樟芝子实体资源,大规模人工培养樟芝显得尤为必要。而基于无性孢子接种的深层发酵法可快速获得大量樟芝菌丝体,因此成为目前最主要的樟芝人工培养方式[4-6]。
采用深层发酵法生产牛樟芝时,人们通常通过离心或过滤的方式获得樟芝菌丝体,并从樟芝菌丝体中提取三萜、多糖、马来酸和琥珀酸衍生物及泛醌衍生物等活性物质[3,7]。对分离出樟芝菌丝体后的发酵液,通常仅单一地提取胞外多糖甚至丢弃处理。而事实上,樟芝深层发酵液中还含有一些其他活性物质,如5-氧-四氢呋喃-2-甲酸、苯乙酸、4-羟基苯乙醇、2,4-二羟基苯基乙基酮、3-甲基-2,4-二羟基乙酰苯、2,3,4-三氟苯甲酸异丙酯、5,7,8-三甲基-6-氧杂萘邻酮基乙酸酯、顺-10-十二碳烯酸四氢吡喃酯等[8-9]。
此外,赵能等[10]发现,樟芝发酵液乙酸乙酯萃取物对13种致病菌(蜡样芽孢杆菌、缓慢芽孢杆菌、无乳链球菌、短小芽孢杆菌、福氏志贺氏菌、枯草芽孢杆菌、金黄色葡萄球菌、藤黄微球菌、副溶血性弧菌、溶血性葡萄球菌、铜尿假单胞菌、乙型副伤寒沙门氏菌、大肠埃希氏菌) 均有不同程度的抑制作用。
李娟等[11]也发现,樟芝发酵液乙酸乙酯萃取物对7种多重耐药性人体致病细菌(肺炎克雷伯菌、溶血性葡萄球菌、金黄色葡萄球菌、大肠埃希菌、粪肠球菌、鲍曼不动杆菌、绿脓杆菌) 均有显著抑制作用,提取物的抑菌效果甚至优于氯霉素、庆大霉素、氨苄青霉素、链霉素、四环素及卡那霉素等抗生素。以上研究结果表明,樟芝深层发酵液中含有抑菌效果较为显著的活性物质。
但对于樟芝发酵液的抑菌活性研究,目前除上述报道外[10-11],鲜见其他相关研究报道。赵能等[10]所用的原料为发酵培养60 d的发酵液,李娟等[11]所用的原料亦为发酵培养50 d的发酵液,发酵周期过长,成本较高;此外,上述研究均只研究了樟芝发酵液乙酸乙酯萃取物的抑菌活性。
为了进一步开发樟芝深层发酵液的实用价值及完善樟芝发酵液的抑菌活性研究,以成本低廉、深层发酵10 d的樟芝发酵液为原料,分别采用氯仿、乙酸乙酯及石油醚等不同极性的有机溶剂萃取樟芝发酵液活性物质,并研究不同有机溶剂萃取物对食源性致病菌的抑菌活性。研究拓展了樟芝在食品领域的应用范围,为樟芝发酵液的进一步有效利用及开发奠定了理论基础。
1 材料与方法
1.1 材料
1.1.1 供试菌株
樟芝(Antrodia camphorate) AC01、金黄色葡萄球菌 (Staphylococcus aureus)、霍乱弧菌 (Vibrio cholerae) 23794、 河 流 弧 菌 ( Vibrio fluvialis)1.1609、创伤弧菌 (Vibrio vulnificus) 10383、副溶血性弧菌 (Vibrio parahaemolyticus)、哈氏弧菌(Vibrio harveyi)1.1593、河流弧菌(Vibrio fluvialis)21612、最小弧菌(Minimal vibrio) 21613、蜡样芽孢杆菌(Bacillus cereus)、大肠杆菌(Escherichia coli)、沙门氏菌(Salmonella sp.)及阪崎肠杆菌(Enterobacter sakazakii)21545、阪崎肠杆菌21569、阪崎肠杆菌22919,均为扬州大学食品科学与工程学院食品微生物应用与控制实验室保藏菌株。
1.1.2 培养基
PDA培养基、LBS培养基及LB培养基购自生工生物工程(上海) 股份有限公司;樟芝发酵培养基[12]:葡萄糖2%、酵母浸出粉0.2%、MgSO40.15%、KH2PO40.3%,pH 4.5。
1.2 方法
1.2.1 樟芝的发酵培养
将静置培养14 d~20 d的樟芝PDA斜面菌种接种到装有100 mL发酵培养基的500 mL摇瓶中,26℃、150 r·min-1振荡培养12 d,再将产生的孢子按1×106个/mL的接种量接种到装有3 L发酵培养基的5 L发酵罐中,26℃、150 r·min-1培养10 d后,收集樟芝菌丝体及发酵液[12]。
1.2.2 樟芝发酵液活性物质萃取
先将原始樟芝发酵液旋蒸浓缩3倍体积,再量取100 mL浓缩后的发酵液,按发酵液∶有机溶剂1∶1的比例分别加入氯仿、石油醚及乙酸乙酯,于37℃恒温振荡器中震荡2 h,取有机溶剂层萃取液,蒸干并称重。重复上述提取操作3次,所得干物质用适量体积的二甲基亚砜(DMSO)复溶,使萃取物终浓度为 50 mg·mL-1[12]。
1.3 供试菌的培养及稀释
将霍乱弧菌、河流弧菌、创伤弧菌、副溶血性弧菌、哈氏弧菌、河流弧菌及最小弧菌接种于LBS培养基中,将金黄色葡萄球菌、蜡样芽孢杆菌、大肠杆菌、沙门氏菌及阪崎肠杆菌接种于LB培养基中,于37℃静置培养12 h。将培养好的细菌用无菌生理盐水以10倍梯度稀释涂布法(共稀释10个梯度,每个稀释梯度3个重复)进行菌落计数,随后根据菌落计数结果将各菌液用生理盐水稀释到菌体浓度为1×105CFU·mL-1后用于后续试验。
1.4 抑菌谱的测定
采用牛津杯法测定樟芝发酵液萃取物的抑菌谱[13]。吸取100 μL稀释好的各细菌菌悬液并均匀涂布于LB固体琼脂平板上(弧菌所用培养基为LBS培养基),再用镊子将无菌牛津杯轻轻放在培养基上并做好标记并编号,将200 μL樟芝发酵液不同溶剂萃取物加入相应编号的牛津杯中,设置DMSO溶剂对照组,每组设置3个重复。随后将平板放入恒温培养箱中37℃静置培养12 h后,取出观察并测量抑菌圈的直径,根据抑菌圈直径判断樟芝提取物对测试菌的抑制效果。
1.5 最小抑菌浓度的测定
采用二倍稀释法测定樟芝发酵液萃取物对测试菌的最小抑菌浓度(minimum inhibitory concentration,MIC)[14]。将樟芝发酵液萃取物原液按二倍梯度稀释,再分别吸取100 μL不同稀释浓度的樟芝发酵液萃取物溶液及稀释好的各细菌菌悬液于96孔板的小孔中,以添加100 μL DMSO的孔作为溶剂对照组,以添加100 μL无菌生理盐水的孔作为空白对照组,每组设6个重复。再将96孔板置于摇床中,37℃、120 r·min-1振荡培养12 h,取出检测OD600值,并根据OD600值计算抑菌率(I,%),计算公式为:
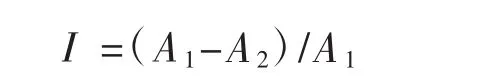
式中:A1为空白对照组OD600值;A2为处理组OD600值。
同时辅以肉眼观察各孔中的菌落生长情况。将溶剂无抑菌效果(抑菌率为0)且提取液完全抑菌(抑菌率为100%)时所对应的最低浓度视为相应的最小抑菌浓度。
1.6 平板菌落计数法测定抑菌率
为了进一步明确樟芝发酵液不同溶剂萃取物的抑菌效果,采用平板菌落计数法[15-16]对抑菌率进行测定以验证其抑菌效果。在装有5 mL LB液体培养基(弧菌所用培养基为LBS培养基) 的20 mL试管中接种100 μL稀释好的各细菌菌液,再分别加入100 μL樟芝发酵液石油醚萃取物、乙酸乙酯萃取物及氯仿萃取物,并设置空白对照(添加100 μL生理盐水) 和溶剂对照(添加100 μL的DMSO),每组设置3个重复。将试管置于摇床中,37℃、120 r·min-1振荡培养10 h,取样进行平板涂布及菌落计数,根据菌落数结果计算不同樟芝发酵液萃取物对测试菌株的抑菌率。
2 结果分析
2.1 樟芝发酵液萃取物抑菌谱的测定
按1.4中的方法,检测不同樟芝发酵液萃取物对14种食源性致病菌的部分抑菌谱,结果见表1。
由表1可知,樟芝发酵液氯仿萃取物的抑菌范围最广,对14株测试菌均有明显抑制效果;其次为樟芝发酵液乙酸乙酯萃取物,对除大肠杆菌和阪崎肠杆菌以外的10株测试菌均有明显抑制效果;樟芝发酵液石油醚萃取物仅对金黄色葡萄糖球菌、大肠杆菌、沙门氏菌及阪崎肠杆菌有抑制效果。总体而言,樟芝发酵液萃取物对测试菌均有抑制效果,其中对沙门氏菌和金黄色葡萄球菌最为显著。
2.2 樟芝发酵液萃取物的最小抑菌浓度
在检测出3种樟芝发酵液萃取物的抑菌谱后,采用二倍稀释法进一步检测了不同樟芝发酵液萃取物对测试菌株的最小抑制浓度,结果见表2。

表2 樟芝不同发酵液萃取物对测试菌的最小抑菌浓度Tab.2 The minimum inhibitory concentrations of different extracts from submerged fermentation broth of Antrodia camphorata on test bacteria
由表2可知,樟芝发酵液氯仿萃取物确实对所有测试菌有良好的抑制效果。其中,对7种弧菌的抑制作用稍弱,最小抑菌浓度均为3.125 mg·mL-1;对金黄色葡萄球菌、大肠杆菌、蜡样芽孢杆菌、沙门氏菌及阪崎肠杆菌的抑制效果较好,最小抑菌浓度均为1.565 mg·mL-1。樟芝发酵液乙酸乙酯萃取物对所有弧菌有较好的抑制效果,最小抑菌浓度均为1.565 mg·mL-1;对金黄色葡萄球菌、蜡样芽孢杆菌及沙门氏菌亦有显著抑制效果,最小抑菌浓度均为3.125 mg·mL-1。樟芝发酵液石油醚萃取物的抑菌谱较窄,且抑菌效果比氯仿萃取物及乙酸乙酯萃取物弱,仅对金黄色葡萄球菌、大肠杆菌、沙门氏菌及阪崎肠杆菌有明显抑制效果,且最小抑菌浓度相对较大,均为 12.5 mg·mL-1。
2.3 樟芝发酵液萃取物抑菌率的测定
为了进一步明确各樟芝发酵液萃取物的抑制效果,采用平板菌落计数法,测定各樟芝发酵液萃取物在最小抑菌浓度下对测试菌的抑菌率。从上述试验结果可知,各樟芝发酵液萃取物对不同编号的阪崎肠杆菌及不同种类的弧菌作用效果一致。因此在本试验中,以副溶血性弧菌为弧菌类测试菌的代表,以阪崎肠杆菌21569为阪崎肠杆菌的代表进行测试,结果见表3。

表3 不同樟芝发酵液萃取物对测试菌的抑制率Tab.3 The antibacterial rate of different extracts from submerged fermentation broth of Antrodia camphorata
由表3的数据可以看出,樟芝发酵液各萃取物在最小抑菌浓度下对目标菌的抑制率为(63.8±2.9)%~(92.7±4.3)%,对沙门氏菌的抑制率最高,为 (83.2±4.1)%~(92.7±4.3)%。其中,樟芝发酵液氯仿萃取物对其目标菌的抑制率均在75%以上,对沙门氏菌的抑制率最大,达到(92.7±4.3)%;樟芝发酵液乙酸乙酯萃取物对沙门氏菌的抑制率也最大,为(83.2±4.1)%,对副溶血性弧菌亦有较为显著的抑制效果,抑菌率为(82.7±2.8)%;樟芝发酵液石油醚萃取物对金黄色葡萄球菌的抑制率最低,为(63.8±2.9)%,对沙门氏菌的抑制率最高,为(91.3±3.8)%,其萃取物对其他目标菌的抑制率均在71%以上。
3 讨论
樟芝由于具有出众且多样的生物活性,近年来已成为食(药) 用菌领域的研究热点。研究表明,樟芝除具有解酒保肝等功能外,还具有突出的抑菌活性[17]。
如Geethangili等[18]发现,樟芝氯仿提取物及正己烷提取物对引起胃炎的幽门螺杆菌(Helicobacter pylori)有显著抑制作用;Lien等[19]发现樟芝乙醇提取物、乙酸乙酯提取物及氯仿提取物均对口腔细菌变异链球菌(Streptococcus mutans) 和牙龈卟啉单胞菌(Porphyromonas gingivalis) 有显著抑制作用,其最小抑菌浓度为 4 μg·mL-1~16 μg·m-1;杨淑贤等[20]发现樟芝中三萜对金黄色葡萄球菌及枯草芽孢杆菌有明显的抑制作用,且对金黄色葡萄球菌的抑制效果最显著;汪雯翰等[21]发现樟芝氯仿及正丁醇提取物对金黄色葡萄球菌及枯草芽孢杆菌均有显著的抑制效果。樟芝菌丝体中含有丰富的抑菌活性物质。
已有的报道中对樟芝在发酵过程中产生的胞外抑菌活性物质研究较少。因此,为了进一步开发樟芝的价值并完善樟芝发酵液活性物质的抑菌活性研究,分别采用氯仿、乙酸乙酯及石油醚等不同极性的有机溶剂萃取樟芝发酵液活性物质,并检测其对食源性致病菌的抑菌活性。结果表明,樟芝发酵液氯仿萃取物抑菌谱最广,对14株测试菌均有显著的抑制效果;其次为樟芝发酵液乙酸乙酯萃取物,可抑制14株测试菌中的10株菌株。2种萃取物对目标菌株的最小抑菌浓度最低可达1.565 mg·mL-1,抑菌效果较为显著。研究结果是对樟芝抑菌活性研究的重要补充,并证实了樟芝在深层发酵过程中会产生抑菌效果显著的胞外活性物质,拓展了樟芝的应用范围及价值,为进一步分离樟芝抑菌活性物质并用于开发新型食品抑菌剂提供了理论依据并奠定了基础。
4 结论
采用牛津杯法及二倍梯度稀释法检测了不同樟芝发酵液萃取物对14株食源性致病菌的抑制效果及最小抑菌浓度。结果发现,樟芝发酵液氯仿萃取物的抑菌谱最广,对14株致病菌均有较好的抑制效果,其次为樟芝发酵液乙酸乙酯萃取物。樟芝发酵液萃取物的最小抑菌浓度为1.565 mg·mL-1~12.500 mg·mL-1。采用平板菌落计数法测定了不同樟芝发酵液萃取物对测试菌的抑菌率。结果表明,樟芝发酵液各萃取物在最小抑菌浓度下对目标菌的抑制率为(63.8±2.9)%~(92.7±4.3)%,对沙门氏菌的抑制率最高,为 (83.2±4.1)%~(92.7±4.3)%,对副溶血性弧菌亦有较显著的抑制效果。
