肝细胞癌切除术后升结肠转移1例
2021-08-10王建超赵鲁刚闫书山段全红
王建超 赵鲁刚 闫书山 段全红#
潍坊医学院临床医学院1(261053) 潍坊医学院附属医院胃肠肛门疾病外科2
在2020年全球癌症统计中,肝癌在癌症发病和死亡中分居第六和第三位,年新发和死亡病例分别约为906 000例和830 000例[1]。目前手术治疗仍然是肝癌的主要治疗方案,但术后极易发生转移和复发,患者预后较差,5年总生存率仅为18%[2]。在过去10年中,肝癌死亡率呈持续上升趋势[3]。肝细胞癌(hepatocellular carcinoma, HCC)最常见的肝外转移部位为肺部,仅0.5%~2%的HCC患者发生胃肠道转移[4-5],而且以上消化道转移为主,结直肠转移更为少见[6-9]。本文报道1例HCC切除术后1年发生升结肠转移的罕见病例,以期为HCC胃肠道转移的临床诊断和治疗提供借鉴。
病例:患者男性,56岁,于2020年1月下旬开始出现上腹部疼痛、胀闷不适,2020-01-24至潍坊市人民医院就诊,腹部B超检查:肝右叶低回声团;血清肿瘤标志物:甲胎蛋白(AFP)>1 000 ng/mL;肝脏增强CT检查:肝右叶Ⅶ、Ⅷ段见椭圆形稍低密度灶,考虑肝右叶恶性占位。为进一步治疗,2020-03-14至上海东方肝胆医院就诊,初步诊断为肝原发恶性肿瘤。复查血清肿瘤标志物:AFP 1 210 ng/mL,异常凝血酶原(DCP) 3 915 mAU/mL。2020-03-16于局部麻醉下行B超引导下经皮肝穿刺微波凝固治疗(percutaneous microwave coagulation therapy, PMCT)联合经导管肝动脉化疗栓塞术(transcatheter arterial chemoembolization, TACE),术后予口服甲苯磺酸索拉菲尼片。2020-04-24至上海东方肝胆医院复查,AFP 698 ng/mL,DCP 48 mAU/mL。为巩固疗效,2020-04-26再次于局部麻醉下行B超引导下PMCT联合TACE治疗,术后恢复尚可。
2020-06-30 PET-CT检查发现腹膜转移,予免疫检查点抑制剂卡瑞利珠单抗(人源化PD-1单克隆抗体)和靶向药物(甲磺酸仑伐替尼)治疗。之后病情继续进展,2020-09-12于潍坊市人民医院就诊,MRI检查:肝右前方肿块,考虑腹膜和大网膜转移。为进一步治疗,2020-09-22至复旦大学附属中山医院就诊,复查AFP 691 ng/mL,DCP 582 mAU/mL。2020-10-08于全身麻醉下行肝叶切除术+腹腔肿块切除术+膈肌部分切除术、修补术,术后病理示HCC。术后继续服用甲磺酸仑伐替尼,情况稳定。
2021年6月复查MRI发现小复发癌灶,予甲磺酸仑伐替尼加量联合PD-1单抗治疗,病情未继续进展。2021年11月自觉下腹部疼痛不适,复查肝脏原发灶未见进展,疑为肠道病变,遂于2021-11-05至潍坊医学院附属医院行结肠镜检查,于升结肠见不规则肿物环肠腔约1/2周(图1A),疑为升结肠恶性肿瘤;活检病理示HCC结肠转移(图1B);免疫组化标记:GS(+),HSP70(+),Glypican-3(+),MLH1(+),MSH2(+),PMS2(+),MSH6(+),Ki-67(阳性,约50%),hep-1(-),CDX-2(-),MUC2(-),CD56(-),Syn(-),Melan-A(-),CK19(-);补充免疫组化:PD-L1(22C3)∶CPS约10,阳性对照(dako1011+),阴性对照(-)。结合免疫组化与病史,符合HCC结肠转移。
2021-11-19起患者出现腹泻症状,每日排便10余次,粪便呈稀水样,偶有便中带血,暗红色,量不多,伴发热,体温最高39.0 ℃。2021-11-22以“腹泻伴发热3 d”收入潍坊医学院附属医院。腹部CT检查:升结肠癌并周边浸润(图1C);肝脏未见占位性病变。血清肿瘤标志物:AFP 174 ng/mL,DCP 290.60 ng/mL(1 ng/mL=1 mAU/mL)。2021-12-01行根治性右半结肠切除术+小肠部分切除术+肠粘连松解术(图1D)。术中见肿瘤位于升结肠中段,直径约10 cm,侵犯右侧腹壁、大网膜以及近端空肠,乙状结肠系膜与之粘连,分解粘连后有黄白色脓液流出,见肠壁穿孔。手术前期和中期大部分组织游离工作于腹腔镜下进行,但因肿瘤巨大且与空肠和大网膜粘连严重,故后期转为开腹手术切除病灶、移除标本并重建消化道。手术切除标本剖开后见肿瘤呈溃疡型,由肠壁内向外呈浸润性生长,外部形态高度类似原发性结肠癌(图1E),肠壁穿孔位置位于肿瘤一侧(图1F)。术后病理示转移性HCC(图1G),肿瘤大小6.5 cm×6.5 cm×3 cm,癌组织侵透肠壁全层;脉管内查见癌栓,可见神经侵犯;肠管上、下切缘无癌,肠周淋巴结(17枚)均未见癌转移,阑尾浆膜面查见癌组织;免疫组化标记:Glypican-3(+),Villin(+),Ki-67(阳性,约40%),CK7(-),CDX-2(-),p53(-),CK20(-),CK19(-),MUC2(-),hep-1(-)。结合免疫组化与病史,符合转移性HCC。

A:结肠镜下见升结肠肿物;B:活检病理示HCC结肠转移(HE染色,×100);C:腹部CT检查示升结肠癌并周边浸润(箭头示肿瘤,a-b-c-d为平面由高至低);D:右半结肠切除术+小肠部分切除术标本,圈内为肿瘤;E:肿瘤呈溃疡型,由内向外浸润,形态类似原发性结肠癌;F:箭头示肠壁穿孔位于肿瘤一侧;G:术后病理示转移性HCC(HE染色,×100)
术后予对症支持治疗,患者恢复良好,腹部症状缓解,血清AFP、DCP逐渐降低(图2)。出院前复查腹部CT未见异常,其余指标基本正常,予出院。对于本病例撰写,患者已签署知情同意书。
讨论:HCC是原发性肝癌的主要组织学亚型,在所有肝癌病例中占比达到70%~85%[10]。HCC极少累及结肠,主要原因为结肠位于门静脉回流的上游,门静脉系统接收经肠系膜静脉回流的源自结直肠的血液,而后进入肝脏,因此上游器官很少会被累及[6,11]。本例患者术后病理显示17枚肠周淋巴结均未见癌转移,由此排除了经淋巴系统转移的可能性。结合病史以及肝癌切除术中见膈肌和腹膜转移,起初怀疑结肠癌灶可能来源于肝癌切除术中的种植转移,但结肠镜下可见凸向肠腔内部的完整肿瘤,手术切除标本剖开后见肿瘤呈溃疡型,向肠壁浸润性生长,表明肿瘤起源于黏膜层,排除了术中腹腔种植转移的可能。于是,唯一可以解释本病例结肠肿瘤来源的仅剩血源性转移。推测可能原因为:①癌组织浸润血管阻塞门静脉,门静脉癌栓形成导致血流逆转,使肝脏原发灶癌细胞逆行转移至结肠[7]。②本例患者病程前期曾接受2次经肝动脉介入治疗,经导管肝动脉栓塞术可引起门静脉压力升高,导致血栓形成和逆流,造成逆行血源性转移[6,12]。
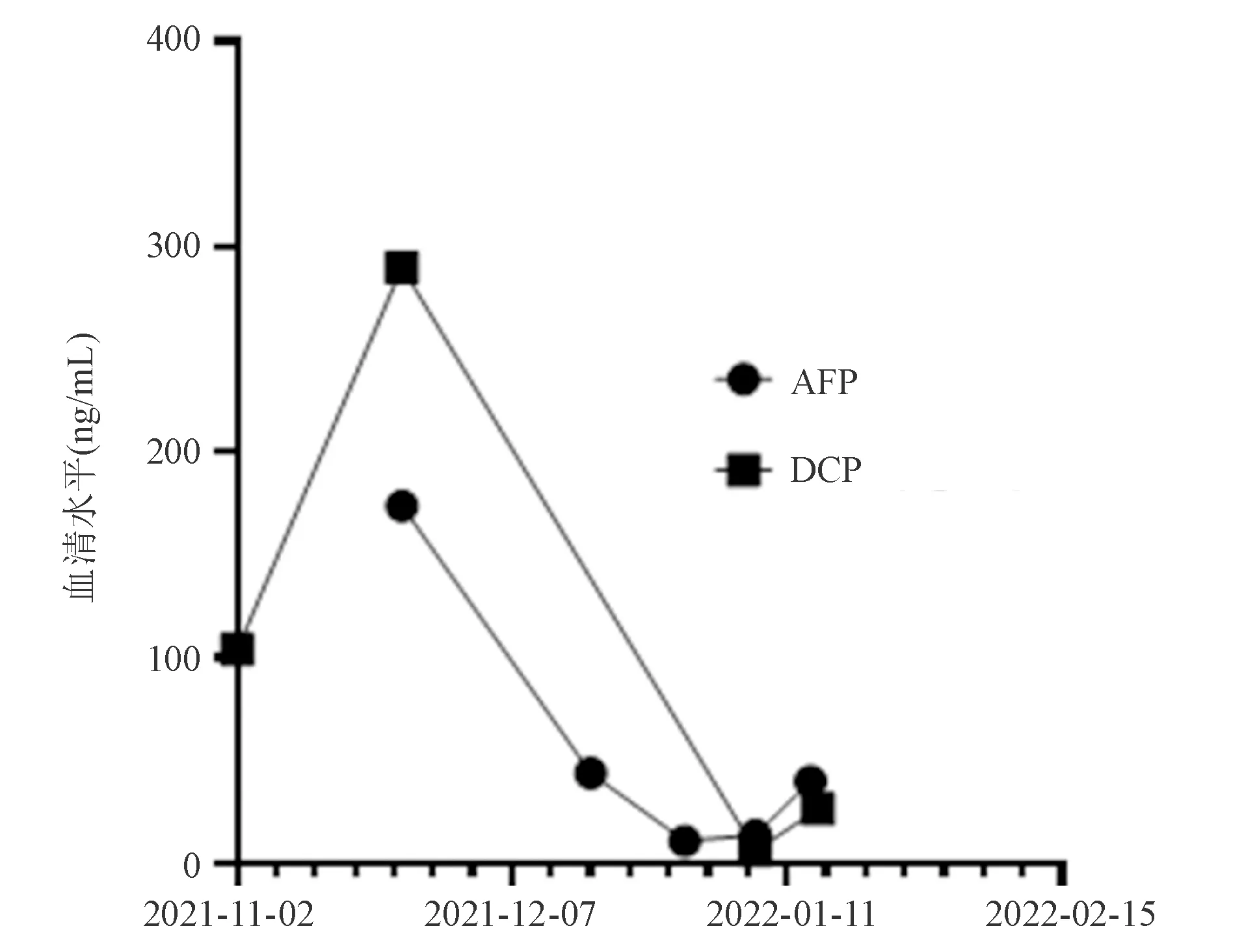
图2 本例HCC患者结肠转移灶切除前后血清AFP、DCP变化趋势
本例患者收治入潍坊医学院附属医院时已存在腹泻、血便、发热(可能与肠穿孔引起的腹腔感染有关)等症状。HCC结肠转移的局部症状主要有排便习惯改变、血便、里急后重、腹痛等,与原发性结直肠癌相似性高[8-9],因此临床医师如仅根据症状和体征,可能会作出错误判断。此外,本例患者HCC特异性血清学标志物AFP、DCP均显著升高,提示存在HCC病灶。值得注意的是,本病例DCP升高尤为明显。国内一项真实世界研究[13]发现,某医院2014年—2016年行DCP检测并诊断为HCC的1 016例患者中,230例因DCP检测而免于漏诊。因此,DCP检测可作为HCC监测中AFP检测和影像学检查的有效补充。
HCC发生肝外转移者术后生存率本就不高,加之转移癌灶往往会引起一系列并发症,进一步威胁患者生命。研究发现,伴有胃肠道侵犯的HCC患者接受手术切除治疗后,中位生存期明显长于接受非手术治疗和支持治疗的患者[6]。出于缓解腹部症状,以及对瘤体过大存在肠梗阻风险的考虑,本病例接受手术治疗,将结肠肿瘤以及穿孔部位完整切除。术后各项指标逐渐恢复正常,腹部症状缓解,身体状况较前改善,有利于延长总生存期。
总结本病例诊治经过,尽管HCC累及结肠极为罕见,但结合影像学检查结果,对于存在腹痛不适、腹泻、血便等原发性结肠癌表现,并伴有HCC相关血清学标志物显著升高的HCC患者,应考虑HCC结肠转移的可能。门静脉系统血流动力学改变可能是HCC发生结肠转移的合理解释。在特定情况下,HCC肝外转移患者可从手术治疗中获益。
