过表达微RNA-590-3p对大鼠心肌缺血再灌注损伤的保护作用及机制
2021-08-10石晓欣邬亦华王瑞良
石晓欣,邬亦华,昌 菁,王瑞良
(1.上海交通大学医学院附属新华医院老年医学科,上海 200092;2.上海国际医学中心内分泌科,上海 200120)
心肌缺血再灌注损伤(myocardial ischemia-reperfusion injury,MIRI)是指发生急性心肌梗死后,在冠状动脉缺氧缺血恢复灌注后组织损伤加重的病理过程。目前治疗急性心肌梗死的再灌注方法(溶栓、介入治疗等)均可能引起MIRI[1]。有研究发现,心肌细胞凋亡是MIRI中的重要环节,在一定程度上反映心肌损伤的严重程度[2]。有研究表明,2型糖尿病伴MIRI大鼠心肌细胞凋亡率显著增高,异丙酚能够有效缓解2型糖尿病大鼠MIRI,其机制与抑制细胞凋亡有关[3]。因此,抑制细胞凋亡成为防治MIRI的重要方法。微RNA(microRNA,miRNA)是一类非编码单链小RNA,其在心肌梗死、心肌纤维化等病理生理过程中发挥着重要作用,如miR-21可以缩小心肌梗死范围[4],miR-133可抑制心肌细胞凋亡[5]等。有研究发现,miR-590在恶性肿瘤发展中发挥重要作用[6],上调miR-590-3p可抑制心肌细胞纤维化[7],提示其与心血管疾病存在紧密联系。但miR-590-3p在MIRI中的作用的研究报道较少。因此,本研究通过制备MIRI大鼠模型,观察心肌组织中miR-590-3p表达、心肌细胞凋亡情况及血清炎症因子、氧化应激和心肌损伤标志物的表达,探讨过表达miR-590-3p对MIRI的作用及机制,旨在为临床治疗MIRI提供新的靶点。
1 材料与方法
1.1 实验动物无特定病原体(specific pathogen free,SPF)级雄性Sprague Dawley(SD)大鼠24只购自河北伊维沃生物科技有限公司[许可证号:SCXK(冀)2019-008],体质量220~250 g,7~8周龄,饲养于SPF级动物房内,保持温度(25±1)℃、湿度(50±5)%,12 h昼夜交替,自由饮食和活动。
1.2 试剂与仪器miR-590-3p、U6、agomir-miR-590-3p及agomir NC扩增引物序列由生工生物工程(上海)股份有限公司提供,RNA提取试剂、实时荧光定量聚合酶链反应(quantitative real-time polymerase chain reaction,qRT-PCR)检测试剂盒、兔抗B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)单克隆抗体、兔抗Bcl-2相关X蛋白(Bcl-2 associated X protein,Bax)单克隆抗体、辣根过氧化物酶标记的羊抗兔免疫球蛋白(immunoglobulin,Ig)G二抗、脱氧核糖核苷酸末端转移酶介导的缺口末端标记法(TdT mediated dUTP nick end labeling,TUNEL)细胞凋亡检测试剂盒(显色法)、大鼠白细胞介素-1β(interkeulin-1β,IL-1β)检测试剂盒、蛋白激酶K、二喹啉甲酸(bicinchoninic acid,BCA)法蛋白定量试剂盒均购自北京百奥莱博科技有限公司,电化学发光(electrochemiluminescence,ECL)显色液购自上海西唐生物科技有限公司,肌酸激酶(creatine kinase,CK)、乳酸脱氢酶(lactate dehydrogenase,LDH)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛(malondialdehyde,MDA)酶联免疫试剂盒均购自上海科顺生物科技有限公司;聚合酶链反应仪购自美国Bio-Rad公司,全自动酶标仪购自美国Bio-Tek公司。
1.3 实验方法
1.3.1 实验分组及模型建立将24只SD大鼠适应性喂养7 d后按随机数字表法分为假手术组、模型组、agomir-miR-590-3p组和阴性对照(negative control,NC)组,每组6只。4组大鼠术前24 h禁食,腹腔注射15 mg·kg-1戊巴比妥钠麻醉后取仰卧位固定,分离大鼠气管,气管插管后接呼吸机,呼吸机参数设定为潮气量10 mL,呼吸频率70~80次·min-1,迅速开胸,于左侧第3、4肋间沿胸骨左缘依次剪开胸骨、纵隔胸膜,露出心包,用镊子夹起心包壁层并剪开,暴露心脏;agomir-miR-590-3p组大鼠于左心室前壁注入5 nmol agomir-miR-590-3p,NC组大鼠注入5 nmol agomir NC,假手术组和模型组大鼠注入等量生理盐水;注射后,模型组、agomir-miR-590-3p组和NC组大鼠于左心耳与肺动脉圆锥间穿医用缝合线结合硅胶管进行套扎,拉紧丝线,形成心肌缺血,结扎30 min后松开结扎线,取出硅胶管使心脏恢复灌注2 h[8];假手术组大鼠仅做开胸和心脏分离不进行结扎。
1.3.2 大鼠血清中CK、LDH、MDA、SOD、IL-1β和TNF-α 水平测定4组大鼠模型建立后于腹主动脉采血,血液室温自然凝固15 min,2 500 r·min-1离心20 min,收集上层血清,应用全自动酶标仪测定大鼠血清CK、LDH、TNF-α、SOD、MDA表达水平,严格按酶联免疫试剂盒说明书进行操作。
1.3.3 心肌组织取材及保存腹主动脉取血后断颈法处死大鼠,开胸取出心脏,一半心肌组织使用40 g·L-1多聚甲醛固定后进行常规组织切片,用于后续苏木精-伊红(hematoxylin-eosin,HE)染色和TUNEL染色;另一半心肌组织置于液氮中保存,用于后续qRT-PCR检测和Western-blot检测。
1.3.4 qRT-PCR法检测大鼠心肌组织中miR-590-3p表达分别取4组大鼠心肌组织100 mg,加入1 mL RNA提取试剂,冰上匀浆30 s后,加入0.2 mL氯仿,充分震荡混合30 s后,室温下15 000 r·min-1离心15 min,取上清液;在上清液中加入异丙醇,混合后,12 000 r·min-1离心10 min,获取总RNA。按反转录试剂盒说明书操作将总RNA反转录为cDNA,采用qRT-PCR法检测miR-590-3p表达。反应条件:95 ℃预变性2 min,95 ℃变性10 s,65 ℃退火 30 s,72 ℃延伸30 s,72 ℃终延伸5 min,共30个循环。U6上游引物序列为5′-CTCGCTTCGGCAGCACA-3′,下游引物序列为5′-AACGCTTCACGAATTTGCGT-3′;miR-590-3p上游引物序列为 5′-CCTTCCCATCTGTTCTCCCTTCC-3′, 下游引物引物序列为5′-CTGTATCTAGTTCCAAGCTGGGTGAT-3′。以U6作为内参,采用2-△△Ct法计算miR-590-3p相对表达量。实验重复3次,取均值。
1.3.5 HE染色观察大鼠心肌组织形态学改变取40 g·L-1多聚甲醛溶液中浸泡固定的4组大鼠心肌组织,常规梯度乙醇脱水后二甲苯透明,石蜡包埋、切片(片厚约4 μm),HE染色,中性树胶封片,置于光学显微镜下观察大鼠心肌组织形态学改变。
1.3.6 TUNEL法检测大鼠心肌细胞凋亡情况取4组大鼠心肌组织切片(片厚约4 μm)置于二甲苯中脱蜡10 min。换新鲜的二甲苯再脱蜡10 min,梯度乙醇水合。磷酸缓冲盐溶液(phosphate buffer saline,PBS)漂洗3次,每次5 min。滴加20 mg·L-1蛋白激酶K溶液,37 ℃反应温度下孵育20 min,PBS洗涤后,滴加50 μL TUNEL检测液,37 ℃避光孵育60 min,PBS洗涤3次后,封片液封片,在光学显微镜下观察细胞凋亡情况,棕色为凋亡细胞。以凋亡细胞占细胞总数的比例表示细胞凋亡率。
1.3.7 Western blot法检测大鼠心肌组织中Bcl-2、Bax蛋白表达水平分别取4组大鼠心脏组织100 mg,于匀浆器中尽量剪碎,加400 μL裂解液置于冰上匀浆;裂解30 min后,于4 ℃下12 000 r·min-1离心5 min,取上清液。BCA法定量上清液总蛋白浓度,100 ℃煮10 min后置于-20 ℃冰箱保存;取蛋白样品行十二烷基硫酸钠聚丙烯酰胺凝胶电泳,湿转法转至聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜;加入50 g·L-1脱脂牛奶封闭2 h,PBS清洗PVDF膜,加入Bax、Bcl-2抗体稀释液(稀释度均为1500),4 ℃过夜孵育;再次PBS清洗后滴加二抗稀释液(稀释度为15 000),30 ℃孵育2 h;PBST清洗后,滴加ECL显色液,应用Image J凝胶成像仪分析各条带灰度值,以甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogernase,GAPDH)为内参,以目的蛋白灰度值与内参蛋白灰度值比值代表目的蛋白的相对表达量。实验重复3次,取均值。
2 结果
2.1 4组大鼠心肌组织中miR-590-3p相对表达量比较假手术组、模型组、NC组、agomir-miR-590-3p组大鼠心肌组织中miR-590-3p相对表达量分别为1.00±0.03、0.51±0.06、0.49±0.06、3.91±0.39。agomir-miR-590-3p组大鼠心肌组织中miR-590-3p相对表达量显著高于假手术组、模型组、NC组,差异有统计学意义(P<0.05);模型组和NC组大鼠心肌组织中miR-590-3p相对表达量显著低于假手术组,差异有统计学意义(P<0.05);模型组与NC组大鼠心肌组织中miR-590-3p相对表达量比较差异无统计学意义(P>0.05)。
2.2 4组大鼠心肌组织病理学改变结果见图1。假手术组大鼠心肌纤维结构完整,细胞排列整齐;模型组和NC组大鼠心肌纤维断裂,细胞排列较乱,部分细胞出现坏死;与模型组和NC组相比,agomir-miR-590-3p组大鼠心肌纤维断裂和心肌细胞排列紊乱情况得到缓解。
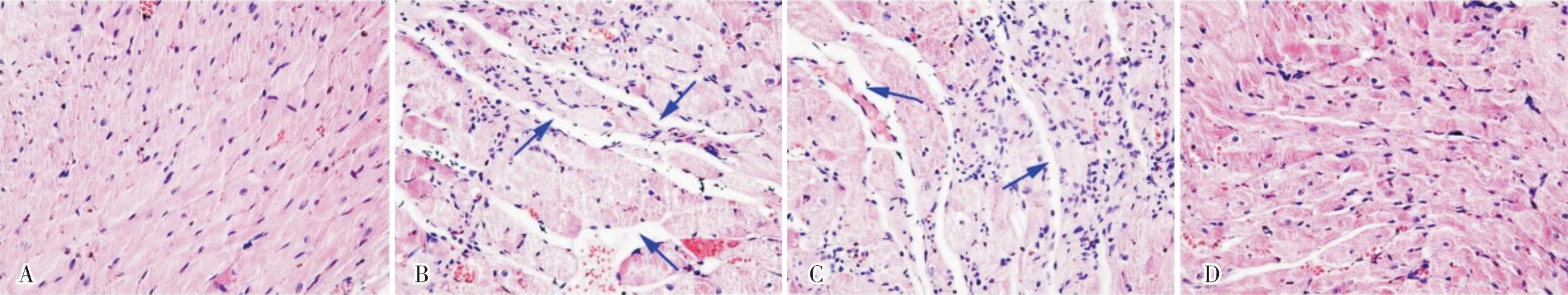
A:假手术组;B:模型组;C:NC组;D:agomir-miR-590-3p组。
2.3 4组大鼠血清炎症因子、氧化应激及心肌损伤标志物水平比较结果见表1。与假手术组比较,模型组、NC组和agomir-miR-590-3p组大鼠血清IL-1β、TNF-α、CK、LDH、MDA水平显著升高,SOD水平显著降低,差异有统计学意义(P<0.05);与模型组和NC组比较,agomir-miR-590-3p组大鼠IL-1β、TNF-α、CK、LDH、MDA水平显著下降,SOD水平显著升高,差异有统计学意义(P<0.05);模型组与NC组大鼠血清IL-1β、TNF-α、CK、LDH、MDA、SOD水平比较差异无统计学意义(P>0.05)。

表1 4组大鼠血清炎症因子、氧化应激及心肌损伤标志物水平比较Tab.1 Comparison of serum inflammatory factors,oxidative stress markers and myocardial injury markers among the four groups
2.4 4组大鼠心肌细胞凋亡情况比较结果见图2。假手术组、模型组、NC组、agomir-miR-590-3p组大鼠心肌细胞凋亡率分别为(4.00±1.00)%、(46.67±7.64)%、(49.67±8.50)%、(27.67±7.51)%。模型组、NC组和agomir-miR-590-3p组大鼠心肌细胞凋亡率显著高于假手术组,差异有统计学意义(P<0.05);agomir-miR-590-3p组大鼠心肌细胞凋亡率显著低于模型组和NC组,差异有统计学意义(P<0.05);模型组与NC组大鼠心肌细胞凋亡率比较差异无统计学意义(P>0.05)。
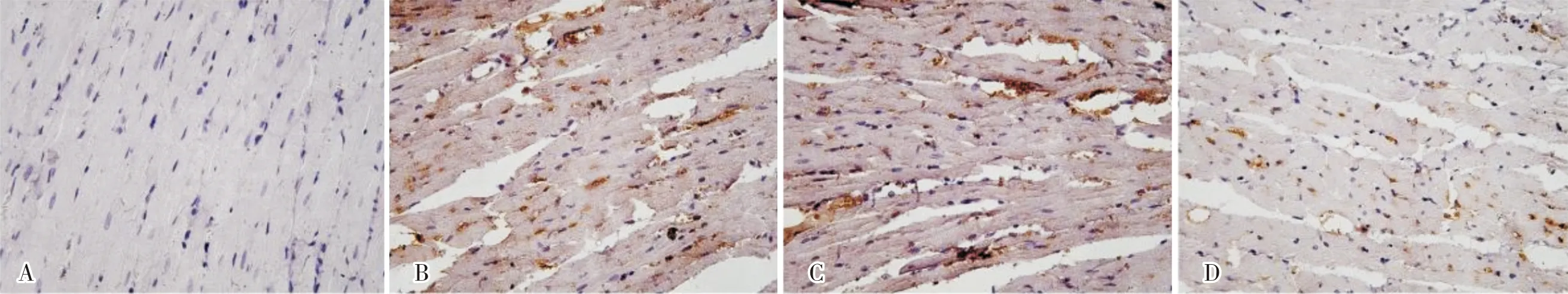
A:假手术组;B:模型组;C:NC组;D:agomir-miR-590-3p组。
2.5 4组大鼠心肌组织中Bcl-2、Bax蛋白表达水平比较结果见表2和图3。与假手术组比较,模型组、NC组和agomir-miR-590-3p组大鼠心肌组织中 Bcl-2 蛋白表达水平显著降低,Bax蛋白表达水平显著升高,差异有统计学意义(P<0.05);与模型组和NC组比较,agomir-miR-590-3p组Bcl-2蛋白表达水平显著升高,Bax蛋白表达水平显著降低,差异有统计学意义(P<0.05);模型组与NC组大鼠心肌组织中 Bcl-2、Bax蛋白表达水平比较差异无统计学意义(P>0.05)。

1:假手术组;2:模型组;3:NC组;4:agomir-miR-590-3p组。

表2 4组大鼠心肌组织中Bcl-2和Bax相对表达量比较Tab.2 Comparison of relative expression of Bcl-2 and Bax in myocardial tissues of rats among the four groups
3 讨论
急性心肌梗死是一种严重的缺血性心脏病,可导致心肌坏死、无法控制的心力衰竭甚至死亡。尽管再灌注治疗对急性心肌梗死的治疗有重要作用,但也不可避免地导致严重心律失常和心肌微血管功能障碍等不良反应而限制了其临床应用[9]。研究表明,MIRI可能与再次供血供氧后的心肌细胞凋亡、氧化应激、中性粒细胞浸润等有关[10]。目前关于MIRI的发病机制尚未完全明确。因此,深入研究MIRI发病的分子机制,对于开发有效的治疗靶点、提高急性心肌梗死患者的生存率及生活质量有重要意义。
miRNA是一类参与转录后基因表达调控的非编码单链RNA,在细胞增殖、分化、传导、凋亡等方面发挥重要作用,与心血管疾病紧密相关[11-12]。研究发现,miR-30a可通过抑制心肌细胞纤维化参与心脏的纤维化[13]。LESIZZA等[14]研究发现,在小鼠心肌缺氧缺血后立即给予合成的miR-590-3p脂质制剂可显著减少心肌梗塞面积并持续恢复心脏功能。YUAN等[15]研究表明,过表达miR-590-3p通过靶向锌指E-BOX结合同源异型盒1抑制心脏成纤维细胞的增殖、迁移和胶原合成,推测miR-590-3p可作为心肌梗死后恢复心脏功能潜在的治疗靶标。本研究结果显示,模型组和NC组大鼠心肌组织中miR-590-3p相对表达量显著低于假手术组,agomir-miR-590-3p组大鼠心肌组织中miR-590-3p相对表达量显著高于假手术组、模型组、NC组,说明miR-590-3p在缺血再灌组心肌组织中呈低表达,在结扎前注入agomir-miR-590-3p导致大鼠缺血再灌注损伤心肌组织中miR-590-3p过表达。本研究HE染色检测结果显示,模型组和NC组大鼠心肌纤维断裂,细胞排列较乱,部分心肌细胞死亡;agomir-miR-590-3p组大鼠心肌纤维断裂和心肌细胞排列紊乱情况得到缓解。模型组、NC组和agomir-miR-590-3p组大鼠血清心肌损伤标志物CK、LDH水平显著高于假手术组;agomir-miR-590-3p组血清CK、LDH表达水平显著低于模型组及NC组。该结果说明,缺血再灌注可导致心肌纤维断裂、心肌细胞死亡,miR-590-3p过表达可通过抑制细胞死亡、维持正常心肌结构对心肌损伤发挥保护作用。
MIRI显著影响心肌缺血的治疗效果,缺血后药物预处理可通过抑制氧化应激和炎症反应减轻再灌注损伤。何莹莹等[16]研究报道,鹿茸多肽通过激活核因子E2相关因子2/抗氧化物反应元件通路及降低血清心肌肌钙蛋白等心肌酶水平对大鼠MIRI发挥保护作用。本研究结果显示,模型组、NC组和agomir-miR-590-3p组大鼠血清IL-1β、TNF-α、MDA水平显著高于假手术组,SOD水平显著低于假手术组;agomir-miR-590-3p组大鼠血清IL-1β、TNF-α、MDA水平显著低于模型组和NC组,SOD水平显著高于模型组和NC组。这一结果表明,心肌缺血再灌注时可发生严重的炎症反应、氧化应激反应,造成心肌细胞损伤,过表达miR-590-3p可通过降低IL-1β、TNF-α、MDA水平及增加SOD水平抑制炎症反应和氧化应激反应从而改善MIRI。
为进一步研究miR-590-3p过表达对心肌细胞凋亡的调控作用,本研究应用TUNEL法检测miR-590-3p过表达对MIRI大鼠心肌细胞凋亡的影响,结果显示,模型组、NC组和agomir-miR-590-3p组大鼠心肌细胞凋亡率显著高于假手术组,agomir-miR-590-3p组大鼠心肌细胞凋亡率显著低于模型组及NC组,说明miR-590-3p过表达对心肌细胞凋亡有负调控作用。Bcl-2家族基因在细胞凋亡中起重要作用,Bcl-2作为原癌基因,通过编码Bcl-2蛋白发挥抑制细胞凋亡的作用。Bax是Bcl-2家族中的一员,其发挥促凋亡作用[17]。Bax/Bcl-2是细胞凋亡的“开关”,当细胞内Bax水平较高时,Bax自身形成同源二聚体促进细胞凋亡。当细胞内Bcl-2水平较高时,Bax与Bcl-2形成异源二聚体而抑制凋亡[18]。本研究结果显示,与假手术组比较,模型组和NC组大鼠心肌细胞中Bax蛋白表达水平显著升高,Bcl-2蛋白表达水平显著下降;agomir-miR-590-3p组大鼠心肌细胞中Bax蛋白表达水平显著低于模型组和NC组,Bcl-2蛋白表达水平显著高于模型组和NC组;这说明miR-590-3p可通过下调Bax蛋白、上调Bcl-2蛋白的表达抑制细胞凋亡,从而改善MIRI。
综上所述,miR-590-3p过表达能够改善MIRI,该作用可能与其减轻氧化应激及炎症反应、抑制心肌细胞凋亡有关。
